

利用CO2合成雜環化合物是一個充滿活力的研究領域,它可以將廉價的碳試劑固定為具有合成價值的中間體和產物。在藥物開發中,環氨基甲酸酯是一類極具吸引力的中間體,在構建具有生物活性的骨架中有重要作用。此外,化學家最近還發現了五元環氨基甲酸酯作為單體用于開環聚合合成聚氨酯的潛力。苯并噁嗪-2-酮類衍生物是一類特殊的環氨基甲酸酯,這類骨架經常在Droxicam等藥物分子中發現,在藥物化學領域具有重要意義。對于苯并噁嗪-2-酮直接催化方法的設計和開發仍然是一個挑戰。除了1,3-氨基醇、1,3-二鹵烷和相關前體以及1-氨基-3-氯丙烷-2-醇衍生物的化學計量轉化外,在50 bar下使用犧牲丁腈作為水清除劑的方式利用CeO2促進這些化合物的形成是可行的。另外,以NIS為基礎,在CO2存在下活化烯丙基胺可以高對映選擇性地合成六元環氨基甲酸酯。值得注意的是,Yamada課題組報導了在Ag-催化下通過2-烷基苯胺和CO2合成苯并噁嗪-2-酮。作者此前的工作展示了1,2-烷基二醇的用途:在與CO2結合后,首先形成α-烷基二醇碳酸酯,然后在分子內發生醇誘導的異構化,進而轉化為酮環碳酸酯。受到這種串聯過程的啟發,作者提出一種合成該類產物的新概念。該方法首先應生成五元環碳酸酯,然后由N-親核試劑進攻重排形成六元環氨基甲酸酯。該方法顯著擴大了苯并噁嗪-2-酮的范圍和合成用途。另外,從廉價易得的碳試劑中獲得更廣泛的基于CO2的雜環化合物將進一步促進新的生物活性化合物的設計與合成。
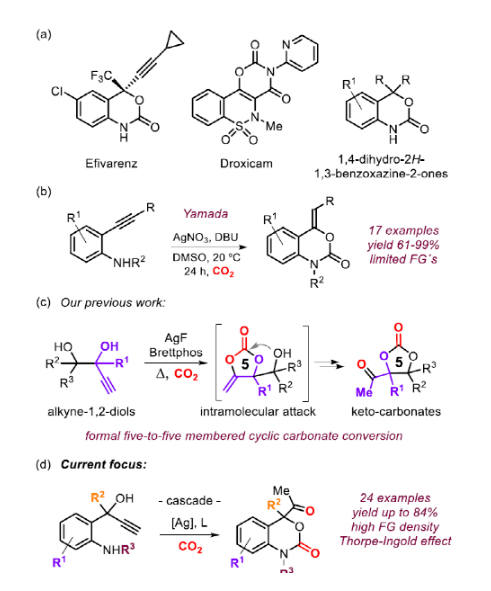
圖1. 研究背景(圖片來源:Angew. Chem. Int. Ed.)基于此前炔烴-1,2-二醇成功轉化為環狀碳酸鹽,作者認為,通過用胺取代其中一個羥基,在加入CO2時有利于半氨基甲酸酯的生成,作者猜測這類活潑中間體很容易與炔反應直接形成五元或六元環氨基甲酸酯。但起初對于反應條件的篩選沒有得到環氨基甲酸酯,相反,優先以80%的收率生成吡咯A。這一結果表明,胺對CO2的活化不能與熱力學上有利的五元環形成相競爭。各種反應條件和催化劑的篩選并沒有引發六元環氨基甲酸酯產物的形成,但意外地發現2,2'-雙吲哚林-3,3'-二酮D作為反應的主要產物,最高產率為30%。最后,作者對底物進行改動(E),將二級醇改為三級醇,提高了在-OH基團活化CO2時通過Thorpe-Ingold效應關環的概率。
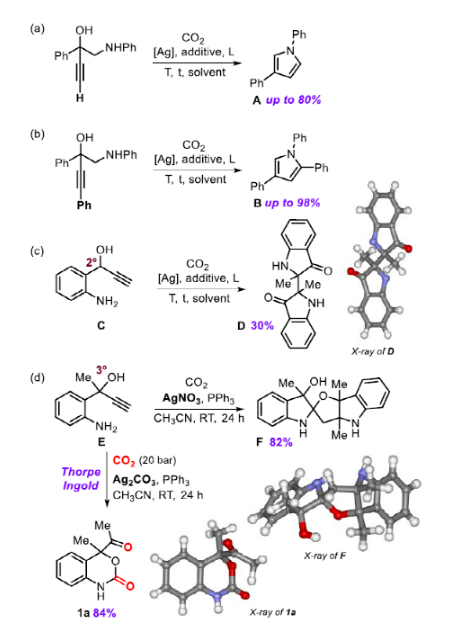
圖2. 條件篩選一(圖片來源:Angew. Chem. Int. Ed.)
在一系列嘗試后,作者確定反應的最佳條件為Ag2CO3(1.5 mol%)、PPh3(6 mol%)、CO2(20 bar)且乙腈為溶劑時在室溫下反應24 h可以84%產率得到目標產物1a。
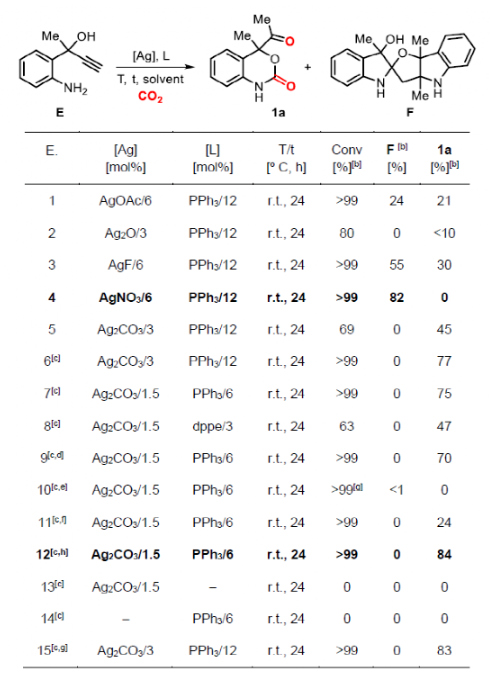
圖3. 條件篩選二(圖片來源:Angew. Chem. Int. Ed.)
隨后,作者在最優條件下進行底物拓展。首先,作者對苯環取代基的適用范圍進行探索。不同種類和位置的鹵素取代的苯并噁嗪-2-酮(1b-1d, 1f和1g)收率最高達65%,且延長反應時間和適當升高反應溫度利于某些反應的進行。苯基取代底物1e(68%)和萘環底物1h(63%)同樣可以順利反應。鄰位取代的芳環(1i和1j)也是可行的,底物轉化率高和收率良好(51-76%)。
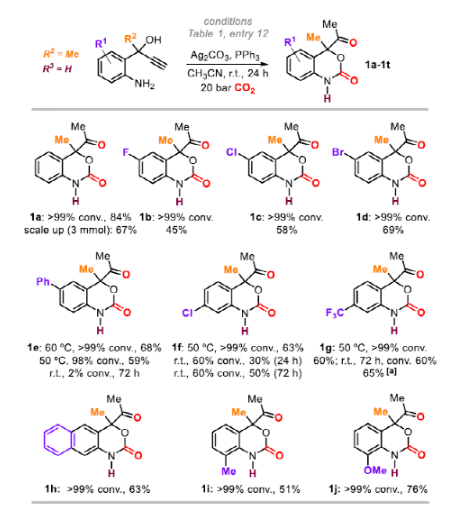
圖4. 底物拓展一(圖片來源:Angew. Chem. Int. Ed.)
接下來是對R2范圍的探究。芳基取代產物2a產率為40%,烷基取代產物(2b-2h)的產率為34-56%。R2的空間位阻對反應結果有著關鍵作用,這可能解釋了為什么2a(40%)和2h(32%)的產率相對較低。末端烯烴(2e)和環庚基(2h)取代的底物同樣適用,產率分別為52%和44%。當R2中含有雜環時為觀察到產物,這可以解釋為,雜原子與Ag配位阻止了關鍵的炔活化步驟,從而導致催化劑失活。
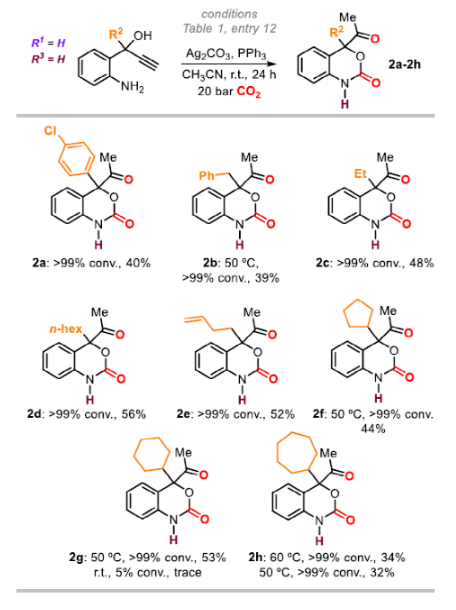
圖5. 底物拓展二(圖片來源:Angew. Chem. Int. Ed.)
最后,作者通過引入酰基取代基來改變底物中的N-基團。N-乙酰基的產物3a的產率為53%,更復雜的酰基(3b和3c)的產率為53%和56%。較大位阻N-酰基需要使用更高的反應溫度/壓力和更長的反應時間,如3d (56%,72 h, 50oC),3e (84%,50 bar, 75oC)和3f(62%,75oC)。
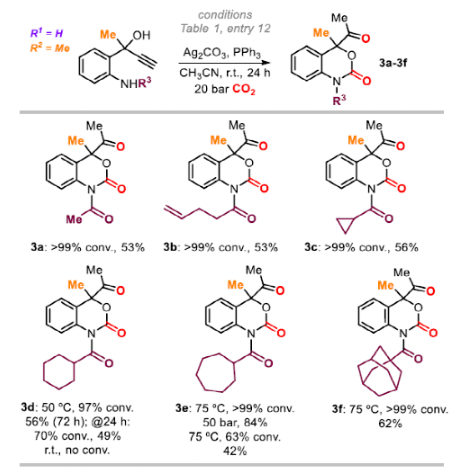
圖6. 底物拓展三(圖片來源:Angew. Chem. Int. Ed.)
結合前人的工作和實驗結果,作者基于底物G對反應機理進行了探究。作者設想的反應機理遵循一個串聯過程,首先是五元環碳酸酯的生成,然后通過N-親核試劑對Ag活化的環碳酸酯進攻,最終生成六元環氨基甲酸酯。前人的工作顯示相對缺電子的PPh3可以最大程度地提高Ag+對炔的活化電位。而N取代基的大小對于第二步的動力學非常重要。為驗證這一假設,作者進行了一系列對照實驗。當反應條件為室溫時,24 h后未觀察到G反應。當溫度提高到50 ℃時,產物H產率為79%。1H-NMR和IR的結果顯示反應生成了α-烷基碳酸酯,這可以通過X-射線晶體學分析得到證實。作者設想的六元環碳酸酯3f是在75 oC下生成的,因此作者想確定H是否可以通過Ag催化劑轉化為3f。在Ag2CO3/PPh3存在的情況下,在82 oC處理H會緩慢地轉化為3f(收率35%)。在沒有催化劑的情況下重復實驗結果相似。這表明Ag催化劑沒有參與第二步。另外,雖然第二步可以通過增加N-取代基的位阻來減慢,但第一步也容易受到位阻的影響。當1a中的-Me被-tBu (I)取代時,即使將溫度提高到60 oC,也沒有觀察到任何反應。這與作者串聯過程的機理假設很吻合,串聯過程提供了獨特的擴環產物,從而產生新的藥物分子。
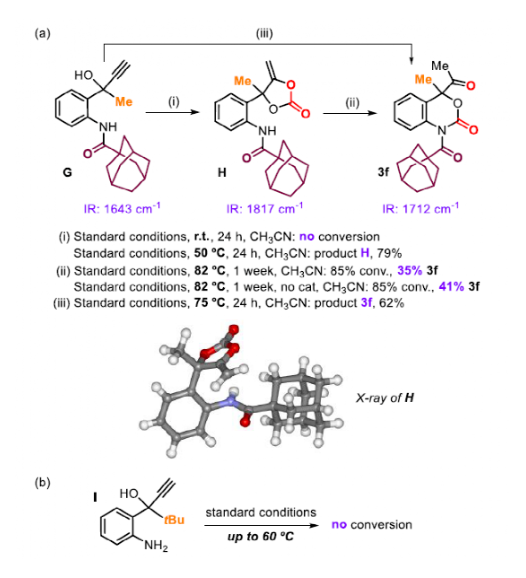
圖7. 機理實驗(圖片來源:Angew. Chem. Int. Ed.)
總結
Arjan W. Kleij課題組利用廉價的CO2為碳源提出了一個全新概念的串聯合成路線,以合成1,4-二氫- 2h -1,3-苯并噁嗪-2-酮,具有良好的適用范圍。該方法利用獨特的Ag活化方式,經歷五元碳酸酯中間體后與N-親核試劑作用得到目標產物六元氨基甲酸酯。這一新概念可用于藥物相關化合物庫的快速擴展,從而為藥物發現提供新的可能。
文獻詳情:
Xuetong Li, Jordi Benet-Buchholz, Eduardo C. Escudero-Adán, Arjan W. Kleij*. Silver-Mediated Cascade Synthesis of Functionalized 1,4-dihydro-2H-Benzo-1,3-Oxazin-2-Ones from Carbon Dioxide. Angew. Chem. Int. Ed. 2023
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn