



(圖片來源:Science)
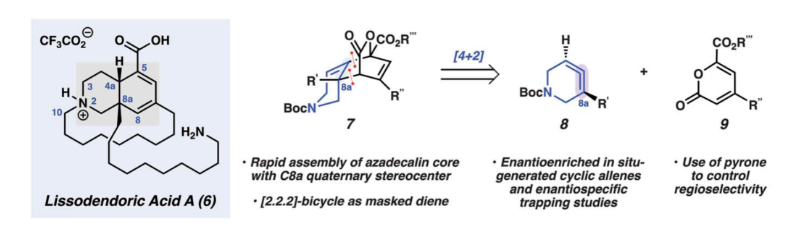
具有張力的有機(jī)分子一直吸引著化學(xué)家們的關(guān)注。20世紀(jì)初,人們對含有三鍵的小環(huán)進(jìn)行了探索,最終在20世紀(jì)50年代證實了苯炔(1)和環(huán)己炔(2)的存在(Fig. 1A)。此外,最近獲得諾貝爾化學(xué)獎的生物正交化學(xué)就依賴于環(huán)辛炔(3)和其它張力中間體。自20世紀(jì)60年代以來,含有聯(lián)烯的小環(huán)結(jié)構(gòu)(4)作為一種非常規(guī)的瞬態(tài)中間體化合物被化學(xué)家們所知曉。盡管其與苯炔差不多在同一時間被發(fā)現(xiàn),但張力環(huán)狀聯(lián)烯化合物在合成化學(xué)中的應(yīng)用與苯炔相比相對較少。基于作者長期以來對雜環(huán)狀聯(lián)烯(5)的研究興趣(Fig. 1B),最近,美國加州大學(xué)洛杉磯分校Neil K. Garg課題組通過立體專一性的捕獲瞬態(tài)張力環(huán)狀聯(lián)烯中間體,實現(xiàn)了manzamine生物堿lissodendoric acid A(6)的全合成(Fig. 1C)。此合成過程中迅速構(gòu)建天然產(chǎn)物的azadecalin骨架是整個過程中關(guān)鍵步驟,使得通過12步即可實現(xiàn)整個全合成過程(0.8%總收率)。

(圖片來源:Science)
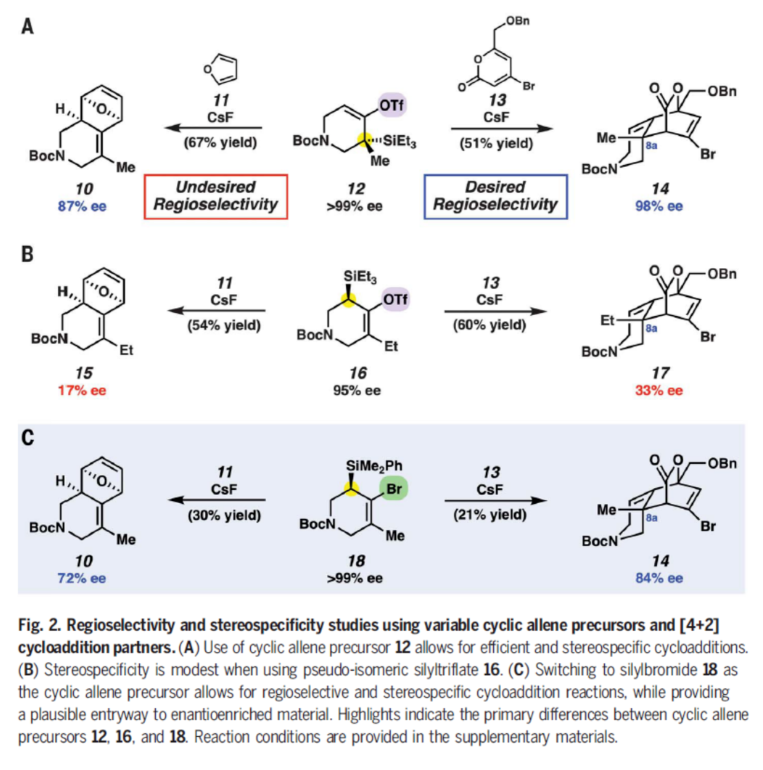
首先,作者利用12分別與呋喃11和吡喃酮13的關(guān)鍵[4+2]環(huán)加成過程進(jìn)行了探索,實驗結(jié)果表明環(huán)狀聯(lián)烯的[4+2]環(huán)加成過程的區(qū)域選擇性可以通過使用不同的捕獲試劑來進(jìn)行調(diào)控(Fig. 2A)。盡管此結(jié)果令人振奮,但局限是在不使用手性分離技術(shù)時無法以良好的對映選擇性獲得起始原料12。于是,作者分別使用硅基三氟甲磺酸酯16(Fig. 2B)和硅基溴化物18(Fig. 2C)作為新的環(huán)狀聯(lián)烯前體來探索反應(yīng)(其中硅基連在取代較少的碳上)。然而,當(dāng)使用16作環(huán)狀聯(lián)烯前體時,無論使用何種捕獲試劑,產(chǎn)物的ee值均不高。而當(dāng)作者使用West課題組報道的類似化合物18作環(huán)狀聯(lián)烯前體時,可以以良好的對映選擇性和中等產(chǎn)率分別實現(xiàn)10(30%產(chǎn)率,72% ee)和14(21%產(chǎn)率,84% ee)的合成。這也是首次利用18作環(huán)狀聯(lián)烯前體來實現(xiàn)對映選擇性合成轉(zhuǎn)化。值得注意的是,F(xiàn)ig. 2所展示的環(huán)狀聯(lián)烯化學(xué)可以在溫和條件下進(jìn)行,且構(gòu)建了兩根C-C鍵,具有優(yōu)秀的endo非對映選擇性,實現(xiàn)了含有三個立體中心的復(fù)雜雜環(huán)產(chǎn)物的合成。搜索下載安裝化學(xué)加APP,看到更多精彩。
(圖片來源:Science)
在確定了關(guān)鍵的環(huán)狀聯(lián)烯捕獲過程的可行性后,作者嘗試?yán)么藦埩Νh(huán)狀聯(lián)烯化學(xué)來實現(xiàn)lissodendoric acid A的全合成。首先,利用商業(yè)可得的羧酸19通過雙對甲苯磺酰化后加入t-BuOH得到含有叔丁酯取代的20。隨后20與有機(jī)鋅試劑21通過Negishi偶聯(lián)得到含有端烯取代的吡喃酮22(Fig. 3A)。接下來,作者利用商業(yè)可得的溴三氟甲磺酸酯23與烷基鋯試劑24反應(yīng)通過1,4-加成以及三氟甲磺酸酯的離去得到酮25。接著,25通過Corey-Bakshi-Shibata(CBS)還原以及與氯甲酸乙酯反應(yīng)得到26(66%產(chǎn)率,90-92% ee)。隨后,碳酸酯部分被硅銅親核試劑取代得到立體化學(xué)翻轉(zhuǎn)的環(huán)狀聯(lián)烯前體27,且對映選擇性得到了保持(Fig. 3B)。在得到了吡喃酮22和環(huán)狀聯(lián)烯前體27后,作者探索了關(guān)鍵的[4+2]環(huán)加成過程(Fig. 3C)。當(dāng)在體系中加入CsF和Bu4NBr,在-20 °C反應(yīng)可以以73%的分離產(chǎn)率得到環(huán)加合物28(> 20:1 dr)(Fig. 3C)。

(圖片來源:Science)
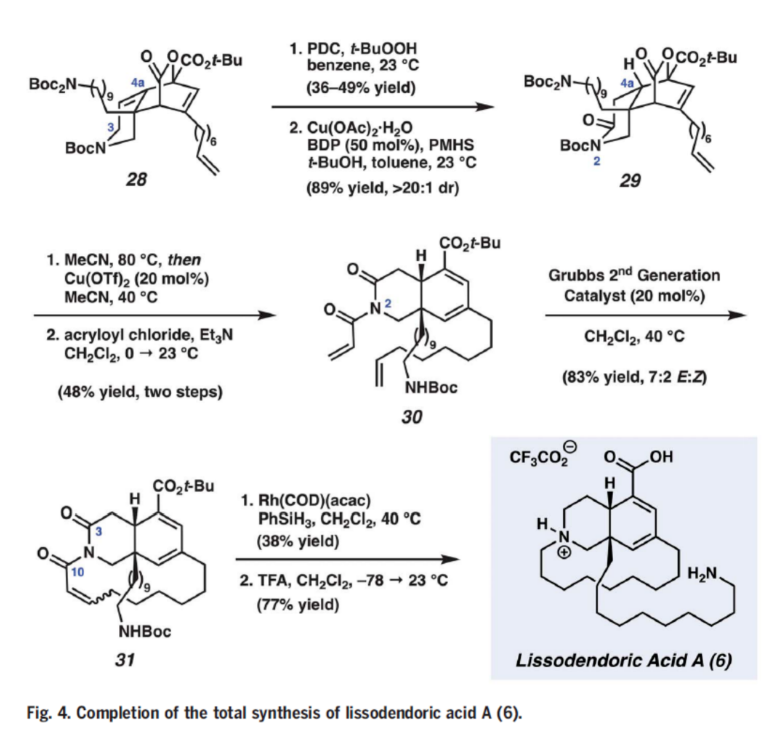
最后,作者利用環(huán)加合物28完成了lissodendoric acid A的全合成(Fig. 4)。首先,作者對28的C3進(jìn)行PDC/tBuOOH氧化得到α,β-不飽和內(nèi)酰胺中間體并通過對映選擇性的1,4-還原得到cis-azadecalin 29。隨后,29通過釋放二氧化碳、Cu(OTf)2促進(jìn)的脫Boc以及哌啶氮原子的酰胺化得到30。接著,30在Grubbs’二代催化劑的存在下發(fā)生關(guān)環(huán)復(fù)分解反應(yīng),以83%的產(chǎn)率得到目標(biāo)大環(huán)31。最后,作者利用Das課題組報道的方法選擇性的實現(xiàn)了C3和C10的選擇性還原(保留酯基和共軛二烯基),并在TFA的作用下完成了lissodendoric acid A的全合成。至此,作者通過12步,0.8%的總收率合成出了lissodendoric acid A。
(圖片來源:Science)
總結(jié)
美國加州大學(xué)洛杉磯分校Neil K. Garg課題組通過立體專一的捕獲瞬態(tài)張力環(huán)狀聯(lián)烯中間體,實現(xiàn)了manzamine生物堿lissodendoric acid A(6)的全合成。其中迅速構(gòu)建azadecalin骨架是此合成過程中的關(guān)鍵步驟,使得通過12步即可實現(xiàn)整個全合成過程(0.8%總收率)。此研究的發(fā)展證明了環(huán)狀聯(lián)烯化學(xué)可以作為重要的合成工具實現(xiàn)復(fù)雜分子的合成。
文獻(xiàn)詳情:
Francesca M. Ippoliti, Nathan J. Adamson, Laura G. Wonilowicz, Daniel J. Nasrallah, Evan R. Darzi, Joyann S. Donaldson, Neil K. Garg*. Total synthesis of lissodendoric acid A via stereospecific trapping of a strained cyclic allene. Science, 2023
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn