

(圖片來源:Angew. Chem. Int. Ed.)
從頭合成在藥物發現和材料科學中至關重要,但后期多樣化方法能夠對其進行相應的補充。自然界中普遍存在的一種后期修飾是異戊烯基化(prenylation),即類異戊烯衍生物(isoprenoid)向生物分子的基團轉移,范圍從蛋白質到次級代謝產物(Figure 1)。在大多數情況下,親脂修飾使其次級代謝產物的效力增強,這被認為是類異戊烯基團的疏水、π-π相互作用和細胞膜束縛能力的結果。雖然異戊烯基化可以提高異戊烯基化天然產物的生物活性,但高度親脂性標簽會降低生物利用度、血漿吸收,并對藥物運輸、分布和代謝產生不利的影響。因此,對異戊烯基團進行可行且普遍的后期C-H官能團化,能夠改善異戊烯基化天然產物的關鍵藥代動力學特性,以及優化物理化學藥物特性和促進構效關系探索的潛力,將是非常有意義的。
(圖片來源:Angew. Chem. Int. Ed.)
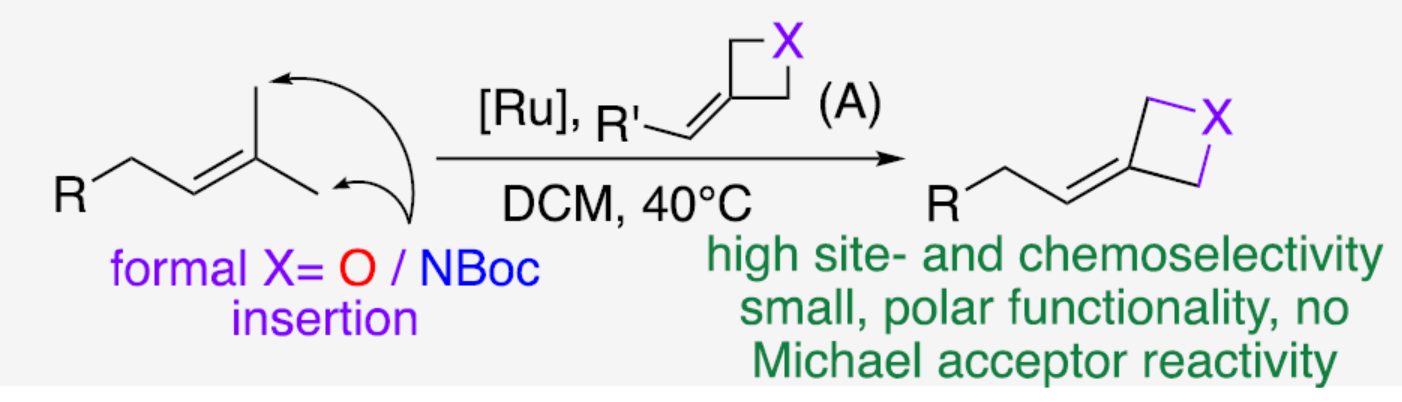
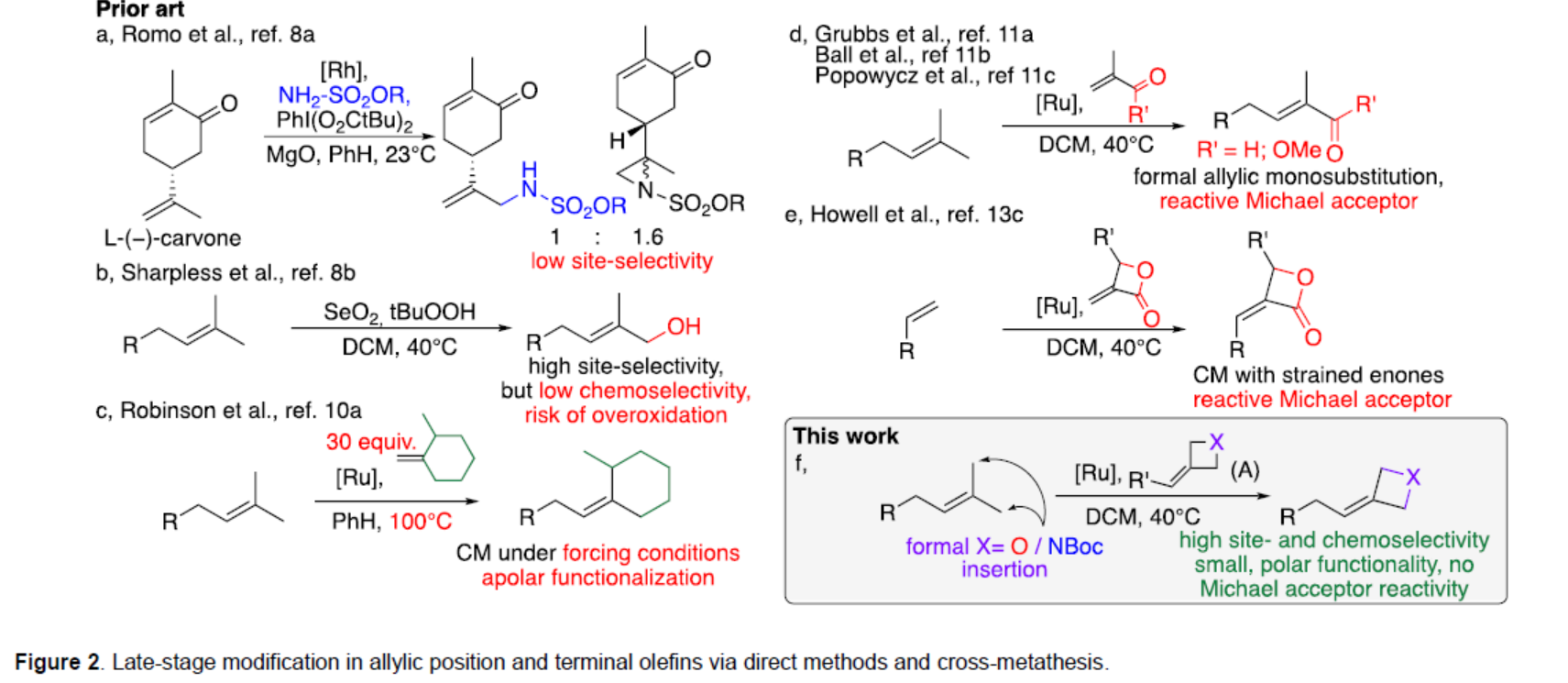
前期,化學家們開發了多種異戊烯衍生物的C-H官能團化反應的方法(Figure 2)。例如,Romo與Sharpless課題組實現了異戊烯衍生物中烯丙基位的直接后期C-H官能團化反應,但存在位點選擇性低、化學選擇性低或存在過度氧化的風險(Figures 2a-2b)。同時,化學家們還提出了一種可替代的和概念上不同的策略,該策略使用烯基鍵作為合成手柄,并通過交叉復分解(CM)實現了形式C-H鍵的活化,但常需茍刻的反應條件(Figure 2c),并形成了反應性的Michael受體(Figure 2d)。為了解決上述挑戰,Tibor Soós與Imre Pápai課題組考慮了在CM反應中引入isosteric氧雜環丁烷和氮雜環丁烷單元的可能性(Figure 2f),因為這兩種四元雜環單元最近已成為藥物開發中的流行骨架,并被用作極性偕-二甲基替代物。然而,對于富電子和高度取代的烯烴之間進行CM的方法,仍有待進一步探索。2006年,Howell課題組(Org. Lett. 2006, 8, 2139.)研究表明,氧雜環丁烷和氮雜環丁烷衍生物的環外張力C=O或C=C鍵能夠增強反應性,包括缺電子烯烴衍生物的CM反應(Figure 2e)。
(圖片來源:Angew. Chem. Int. Ed.)
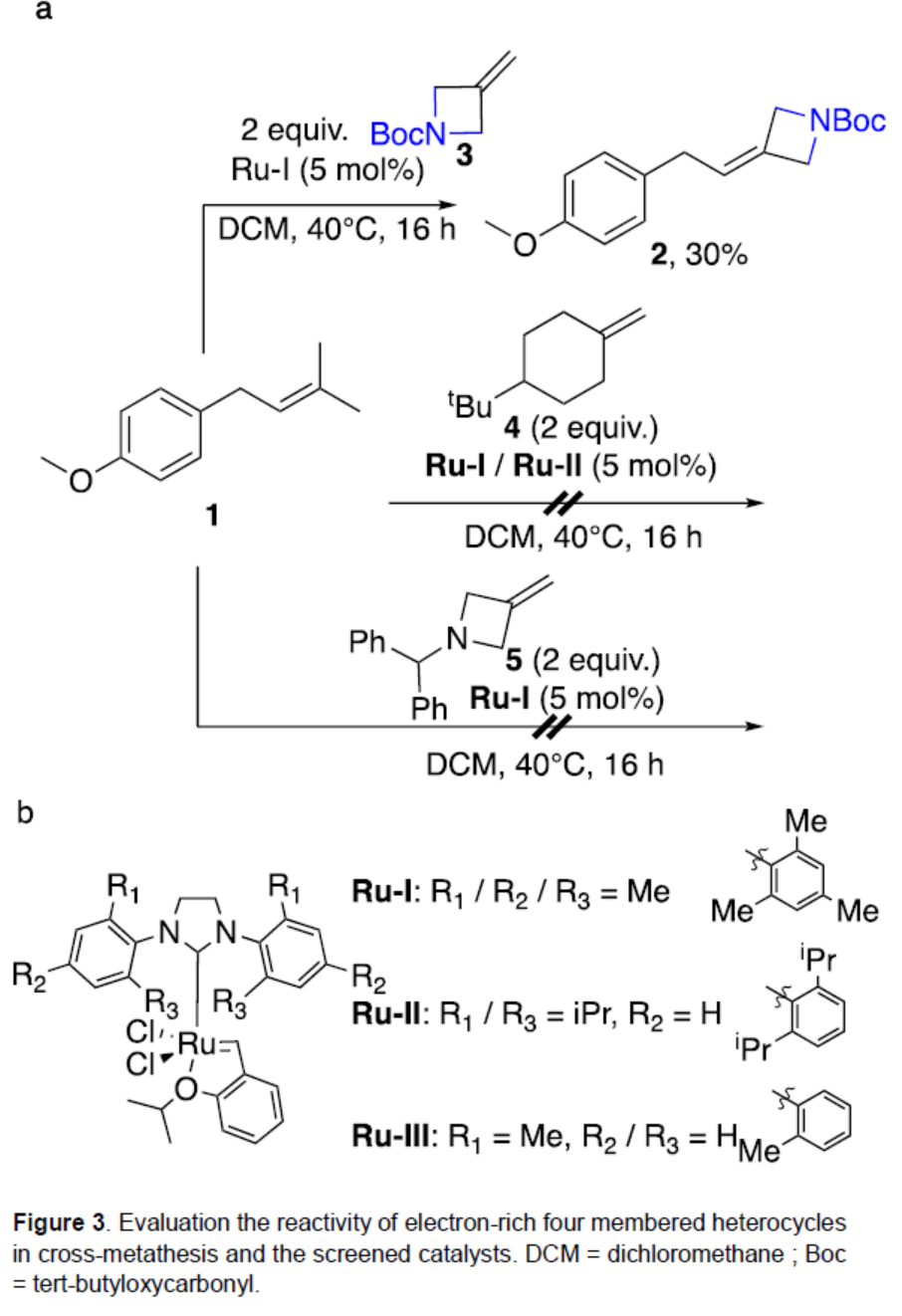
首先,作者以異戊烯化的茴香醚1作為模型底物,對幾種富電子的四元雜環化合物進行了篩選(Figure 3)。當以Ru-I作為催化劑,在DCM溶劑中40 oC反應16 h,僅當使用N-Boc保護的3-亞甲基氮雜環丁烷3為底物時,可以30%的收率得到產物2。為了進一步提高反應的收率,作者對反應條件進行了優化(Table 1)。當以Ru-II作為催化劑,在DCM溶劑中40 oC反應16 h,可將反應的收率提高至99%。
(圖片來源:Angew. Chem. Int. Ed.)
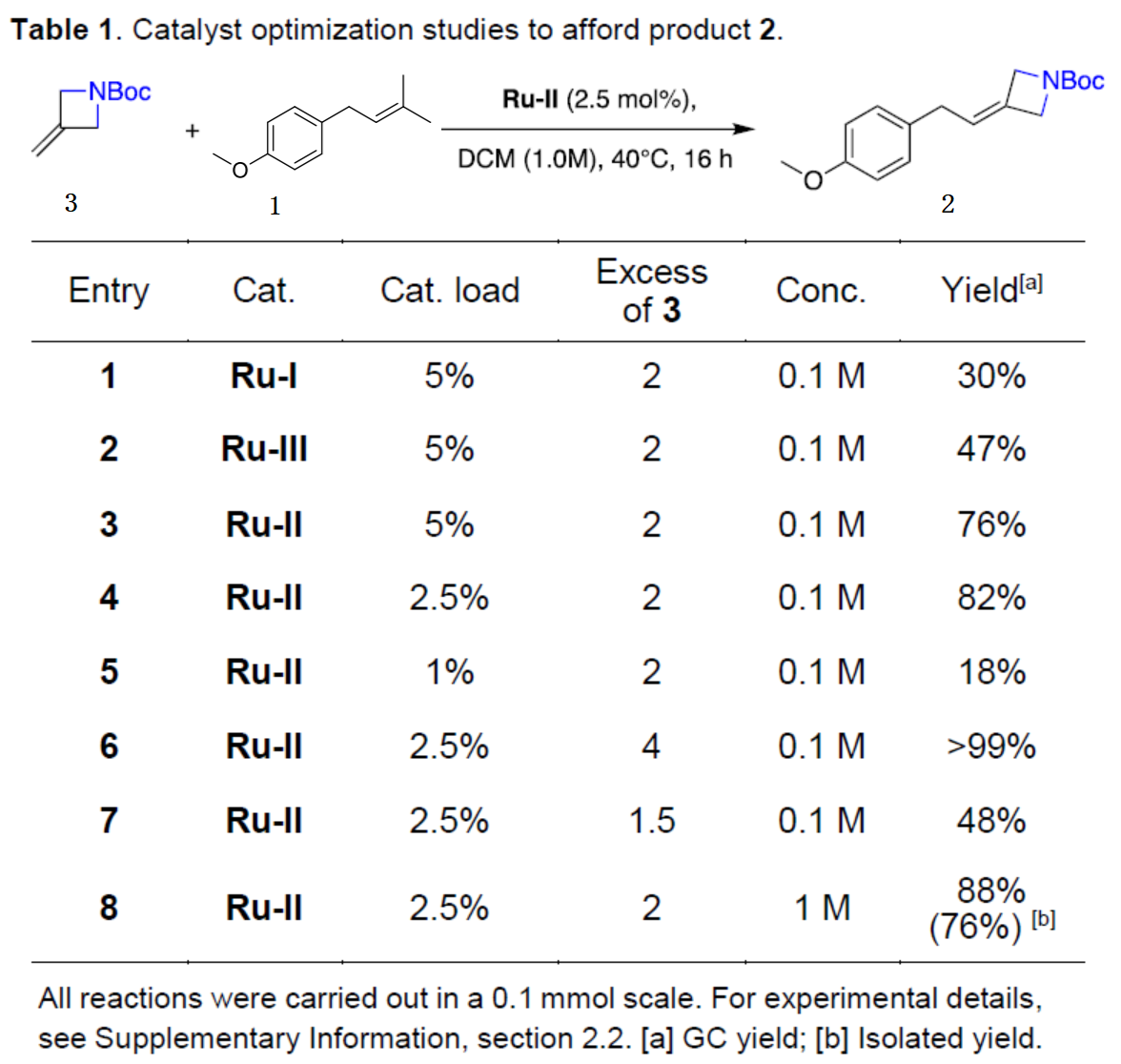
(圖片來源:Angew. Chem. Int. Ed.)
在獲得上述最佳反應條件后,作者以氮雜環丁烷衍生物3為底物,對烯烴的底物范圍進行了擴展(Table 2)。研究表明,含有各種O-基Lewis堿官能團的底物,均與體系兼容,獲得相應的產物6-12,收率為31-89%。然而,對于缺電子的三取代烯烴,未能發生反應,如13和14。空間位阻較小的末端烯烴類似物,也是合適的底物,可獲得相應的產物15-16,收率為40-84%。富電子的末端烯烴,也是合適的底物,可以67%的收率得到產物17。值得注意的是,該策略還可用于結構復雜分子的后期衍生化,如檸檬醛、(-)-α-紅沒藥醇、蛇床子素,獲得相應的產物18-20,收率為77-83%。
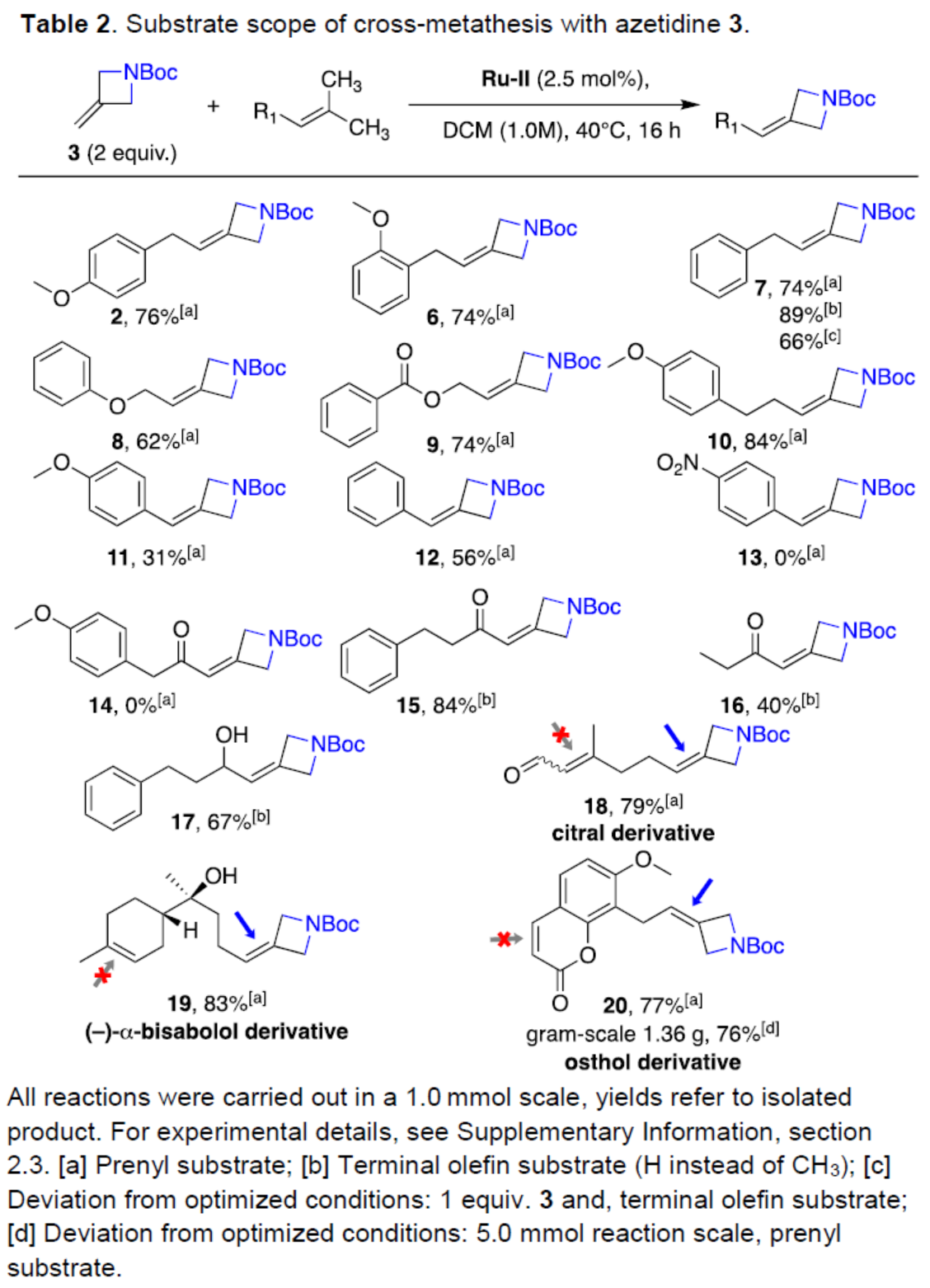
(圖片來源:Angew. Chem. Int. Ed.)
緊接著,作者以氧雜環丁酮為底物,通過還原反應,可獲得3-亞甲基氧雜環丁烷21(Figure 4a)。同時,以22和1為底物,通過串聯接力關環復分解反應(RCM)和交叉復分解反應(CM),可合成氧雜環丁烷-異戊烯衍生物23(Figure 4b)。
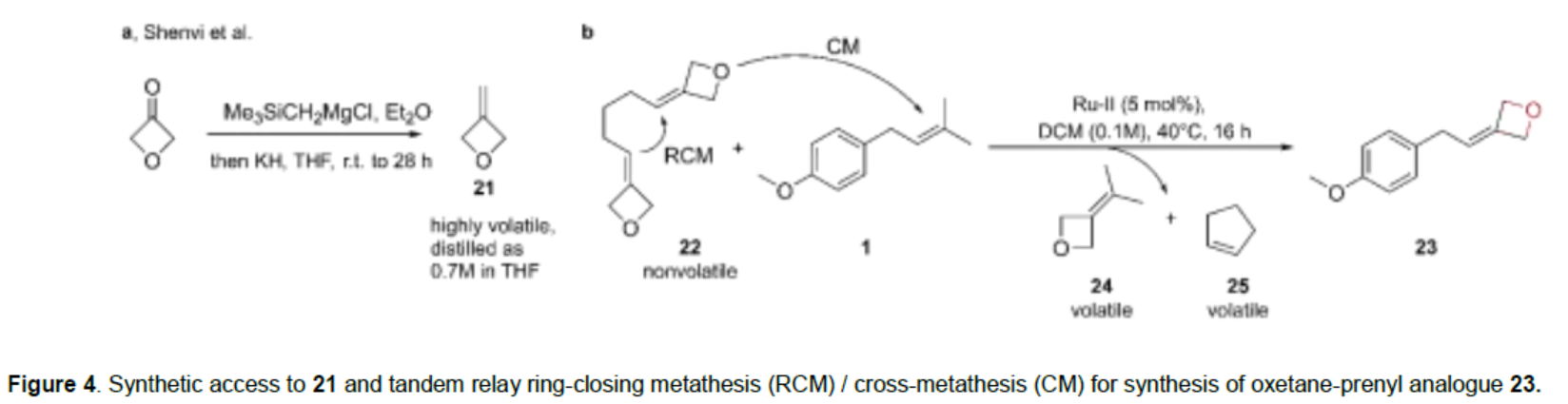
(圖片來源:Angew. Chem. Int. Ed.)
隨后,作者以雙氧雜環丁烷衍生物22為底物,對烯烴底物的范圍進行了擴展(Table 3)。研究表明,一系列異戊烯基底物和烯丙基底物,均可與22順利反應,獲得相應的產物23-29,收率為73-81%。在稍微修改的條件下,可以26%的收率得到香葉醇衍生物30。然而,N-異戊烯基-1,2,3,4-四氫異喹啉的三氟乙酸鹽,未能發生反應,如31。此外,該策略還可用于一些復雜天然產物的后期衍生化,獲得相應的產物32-38,收率為34-87%。
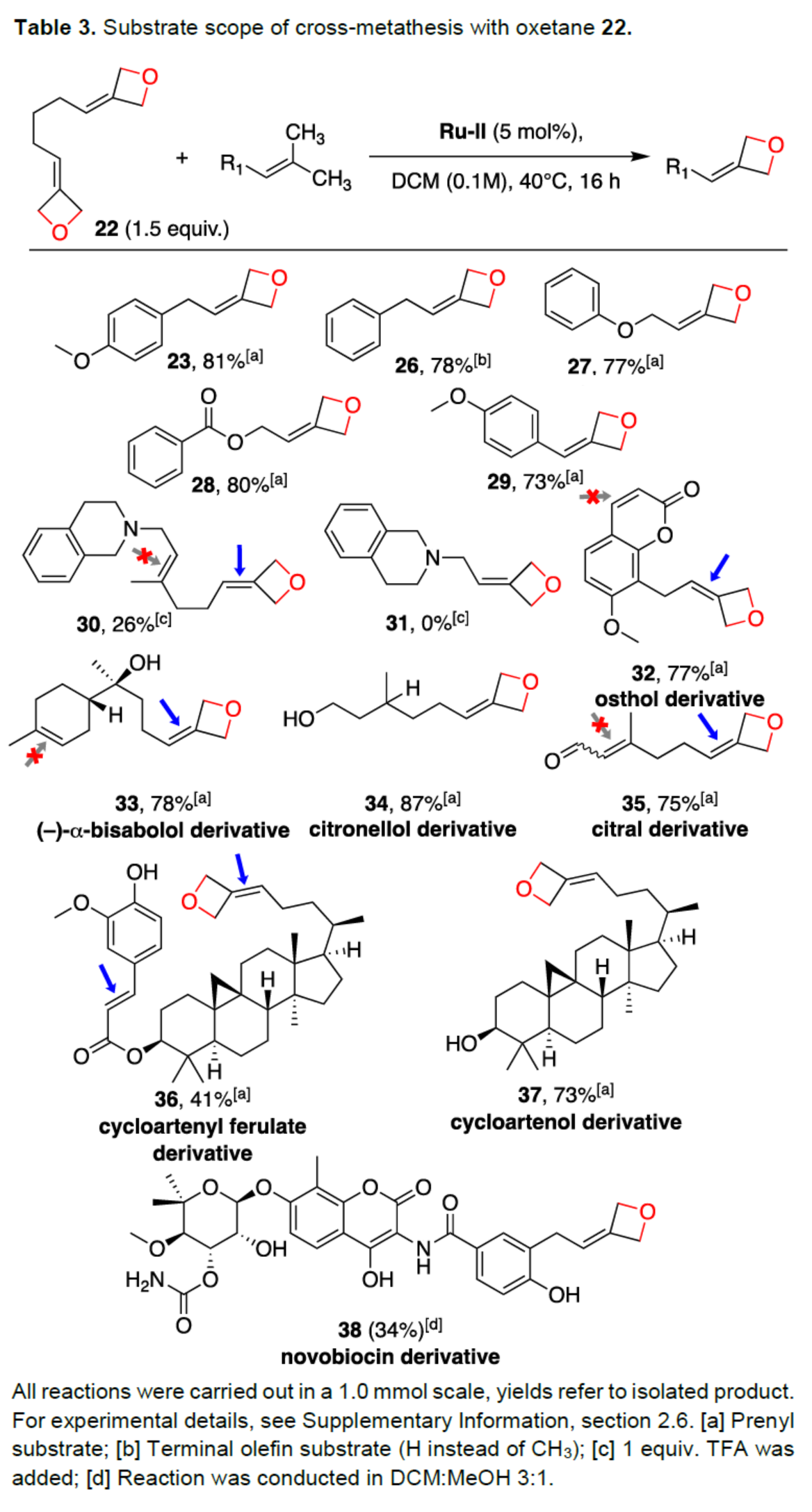
(圖片來源:Angew. Chem. Int. Ed.)
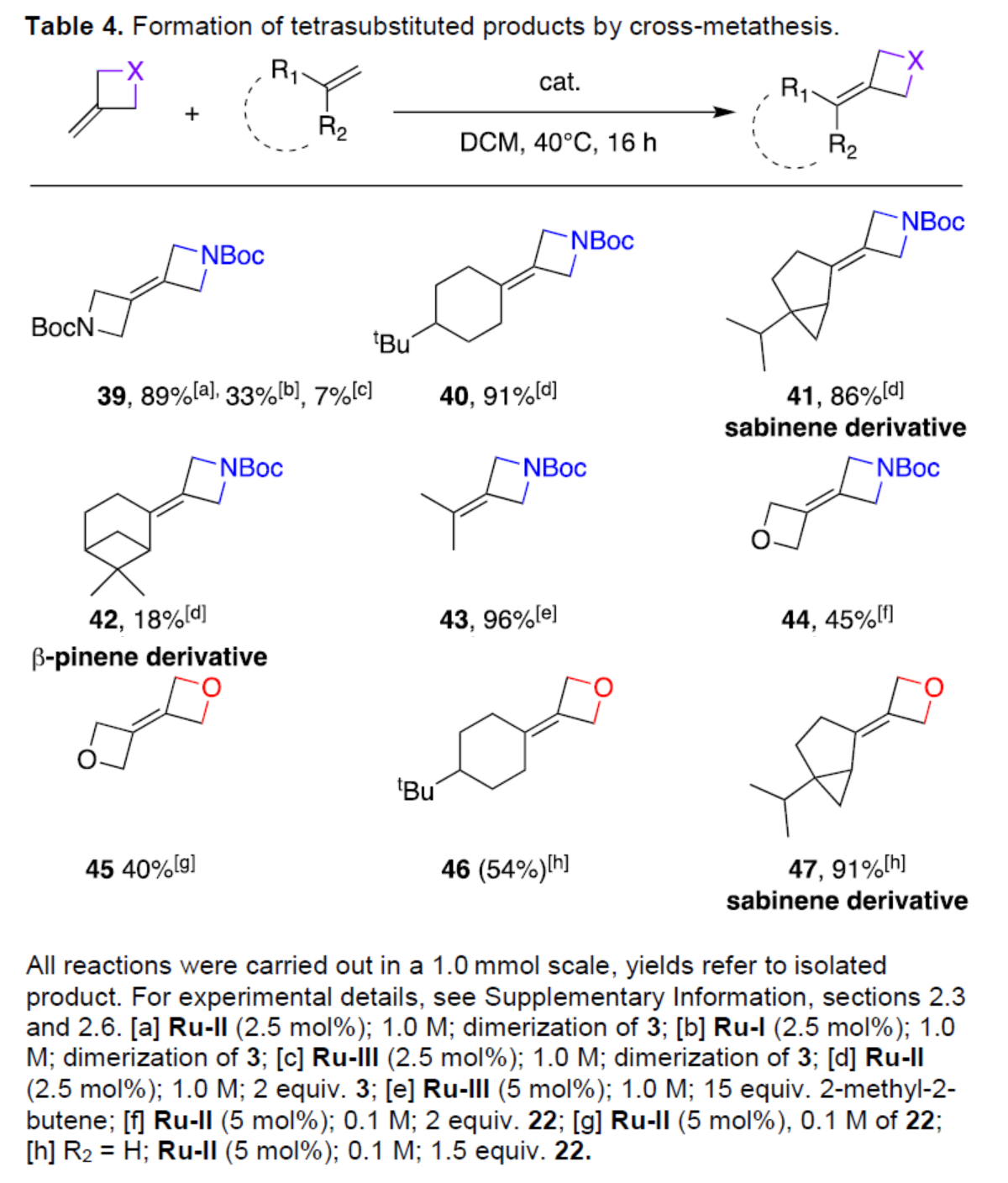
此外,通過條件的優化后發現,一系列氧/氮雜環丁烷衍生物,均可與烯烴衍生物順利進行交叉復分解反應,獲得相應的四取代產物39-47,收率為18-96%(Table 4)。
(圖片來源:Angew. Chem. Int. Ed.)
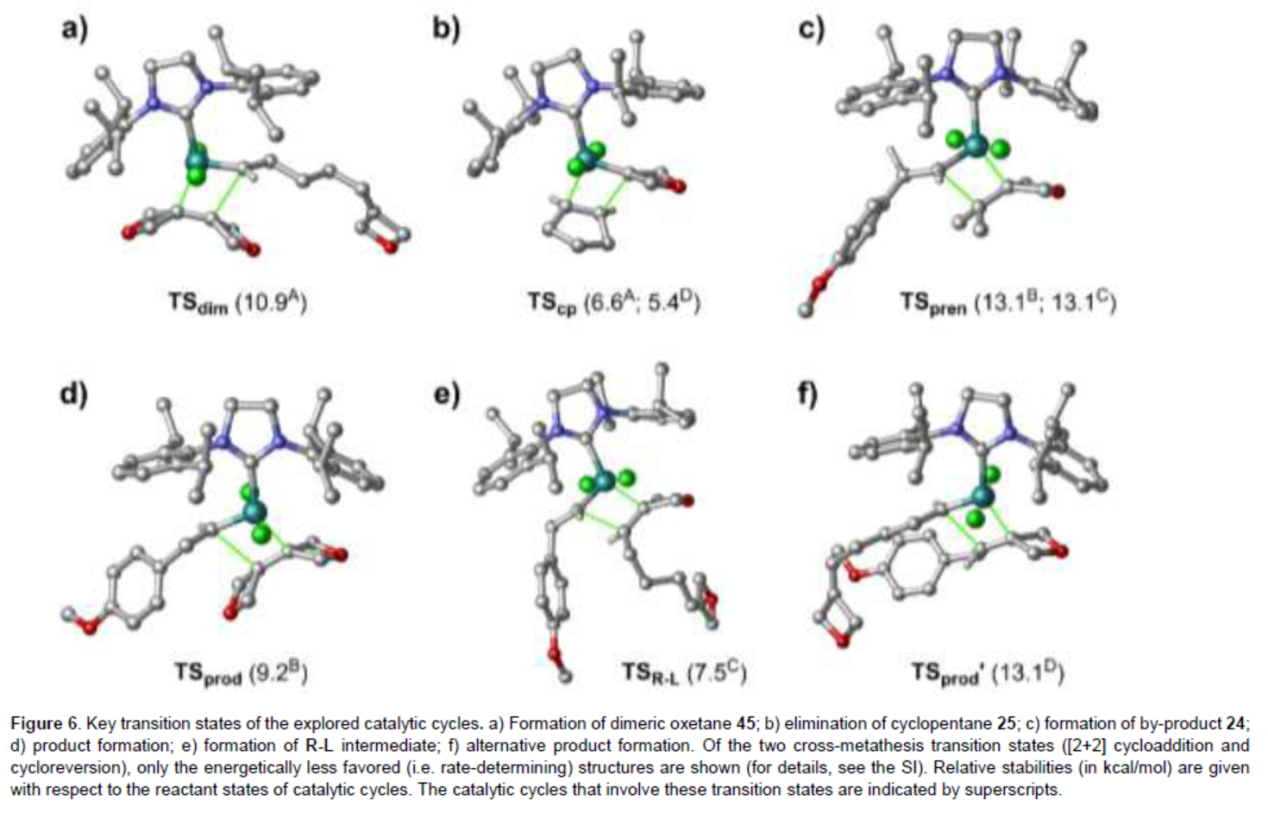
最后,作者通過相關的DFT以及相關文獻的查閱,對反應機理進行了研究(Figure 5)。首先,Ru-II與氧雜環丁烷22反應,生成氧雜環丁烷衍生的Ru卡賓cat-L。cat-L通過分子內交叉復分解反應可進行環戊烯(25)的消除,生成cat-ox配合物。上述過程,作為反應的引發步驟(Figure 5a)。其次,根據相關的過渡態的結構分析(Figure 6),作者提出了兩種合理的催化循環過程。在第一種機理中(Figure 5b),催化活性Ru配合物cat-ox優先與雙氧雜環丁烷22反應,生成氧雜環丁烷二聚物45(涉及TSdim,Figure 6a)和相應的Ru卡賓cat-L。cat-L消除了揮發性環戊烯(25)(涉及TScp,Figure 6b),并且再生了cat-ox。盡管如此,異戊烯基底物1也可以與cat-ox反應(cycle B),但預計副產物24的形成(涉及TSpren,Figure 6c)在動力學和熱力學上都比直接形成的產物23更有利。最后,cat-R和45之間反應(涉及TSprod,Figure 6d),從而獲得產物23,并回收cat-ox。在第二種機理中(Figure 5c),cat-ox + 1→cat-R + 24(與cycle B中相同)。cat-R可與22反應,生成中間體R-L(涉及TSR-L,Figure 6e)。cat-ox和R-L反應(涉及TSprod′,Figure 6f),可生成產物23。

(圖片來源:Angew. Chem. Int. Ed.)
(圖片來源:Angew. Chem. Int. Ed.)
總結
匈牙利自然科學研究中心有機化學研究所Tibor Soós與Imre Pápai課題組開發了一種廣泛適用的環外張力驅動的交叉復分解反應,可在溫和條件下對異戊烯基化合物和天然產物進行選擇性的后期衍生化。該策略代表了一種獨特的、形式的雙重C-H鍵的氧化策略,可用于后期官能團化,以改善異戊烯基化天然產物的關鍵藥代動力學特性,以及優化物理化學藥物特性和促進構效關系探索。此外,該策略還提供了一種構建具有挑戰性的富電子的三/四取代烯烴的方法。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn