


(封面圖片)
手性α-三級胺是許多藥物和天然產物分子的重要結構片段,現已發展了諸多構建手性α-三級胺的催化方法。此外,手性α-三級胺也可由相應三級硝基化合物直接還原得到,但三級硝基化合物的催化不對稱合成方法尚且有限,通常由過渡金屬催化的烯丙基化或有機小分子催化的加成反應得到,亟待發展更多的催化方法。對二級硝基化合物進行C-烷基化反應是一類潛在的直接構建三級硝基化合物的方法,但是這類反應通常伴隨著較多的硝基O-烷基化反應副反應。為解決這個難題,前人采用單電子轉移機理以及特殊的親電試劑來提高C-烷基化的化學選擇性。例如,Watson課題組以烷基鹵代物為親電試劑,發展了一系列過渡金屬催化的硝基化合物C-烷基化反應,隨后實現了該類反應的不對稱催化。然而,通過對硝基化合物不對稱C-烷基化來得到手性三級硝基化合物的催化方法還未見報道。
生物催化以高效、高選擇性、易進化著稱,美國康奈爾大學的Todd Hyster教授課題組的研究者嘗試采用生物催化的方法來實現對硝基化合物的不對稱C-烷基化反應。盡管已有許多酶催化的共軛加成或亨利反應可以利用nitronate(去質子化的硝基烷烴)作為親核試劑,但沒有一例可以制備手性三級硝基化合物。由于天然酶并不能催化硝基化合物C-烷基化反應,他們發展了一種全新的非天然光酶催化策略,以α-鹵代羰基化合物1作為烷基化試劑,在可見光激發的烯酮還原酶(‘ene’-reductases, EREDs)催化下,高化學選擇性和對映選擇性地實現了對硝基烷烴的C-烷基化反應,得到了高價值的手性三級硝基化合物3(圖1B)。
值得注意的是,該團隊近期采用類似的非天然光酶催化策略,以α-鹵代羰基化合物和α-芳香取代硝基烷烴為親電試劑,實現了高交叉和對映選擇性的Csp3–Csp3親電偶聯反應(XEC),見化學加報道《Nature:不對稱sp3-sp3交叉親電偶聯——“酶”有可能嗎?》(Nature 2022, 610, 302–307)。該光酶催化XEC的關鍵步驟包括光誘導的選擇性自由基引發、自由基加成、硝基自由基中間體發生C–N鍵均裂(硝基離去)、選擇性氫原子轉移淬滅。作者設想,如果可以通過酶來控制自由基加成的立體選擇性,同時減慢硝基自由基6的C–N鍵均裂,加速該自由基中間體的氧化,便可得到手性三級硝基化合物3(圖1B)。
首先,作者以α-氯代酰胺1a和α-芐基硝基乙烷2a為模板底物,在青藍光(Cyan light, λmax = 497 nm)激發下,篩選了一系列烯酮還原酶,發現大多酶都可以催化反應得到消旋的三級硝基化合物3a。其中,只有來自Geobacillus kaustophilus菌株的烯酮還原酶(GkOYE)能夠以56%的產率和78:22的er值得到(R)-型目標產物3a。有意思的是,當使用先前可高效催化1a和α-苯基硝基乙烷進行XEC的烯酮還原酶CsER時,也可以得到目標產物3a(85%, 50:50 er)。作者認為該化學選擇性(C-烷基化vs XEC)來源于烷基取代的硝基自由基6的C–N鍵均裂速度較慢,從而傾向于發生單電子氧化,凈反應為氧化還原中性。對照實驗證實,烯酮還原酶和Cyan光對于反應性至關重要(圖1C)。隨后,作者基于GkOYE蛋白結構,采用迭代飽和突變策略對GkOYE進行了三輪定向進化,最終找到一個三突變體D73C/A104H/Y264W(GkOYE-G7,0.5 mol%)可高效、高立體選擇性地催化反應得到3a(96%, 96:4 er, 圖1D),且該反應可以放大到1.0 mmol規模(78%, 96:4 er, 196 mg)。
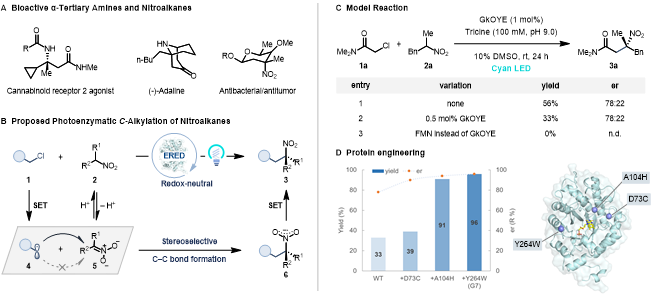
圖 1.光酶催化的硝基化合物不對稱C-烷基化反應。圖片來源:JACS
隨后,作者對該光酶催化體系的底物范圍進行了探索(圖 2)。多種類型的α-芐基取代硝基烷烴2a-z都可以很好地與α-氯代酰胺1a發生C-烷基化反應。如苯環的鄰、間、對位可兼容帶有不同電性的取代基,以56–98%的產率以及優異的對映選擇性(>93:7 er)得到β-手性四取代硝基酰胺產物(7-16)。但該體系對硝基烷烴α-位取代基的體積比較敏感。此外,該體系還可以兼容不同雜環,包括富電子的噻吩和缺電子的吡啶、吡嗪取代的硝基烷烴,以91–98%的產率和高對映選擇性(最高95:5 er)得到相應的雜環取代手性三級硝基化合物(20-26)。同時,直鏈或環狀脂肪硝基烷烴也可以被該體系接受,得到相應四取代硝基產物(27-37, 22–96%),突顯出該光酶催化體系廣泛的底物譜。另外,多種不同類型的α-鹵代羰基化合物均可被該體系兼容,包括α-氯代酰胺(如Weinreb酰胺、環狀酰胺),α-鹵代酮和α-鹵代酯/砜(需使用CsER)均可與硝基烷烴反應得到相應三級硝基產物(32-37,圖 2)。
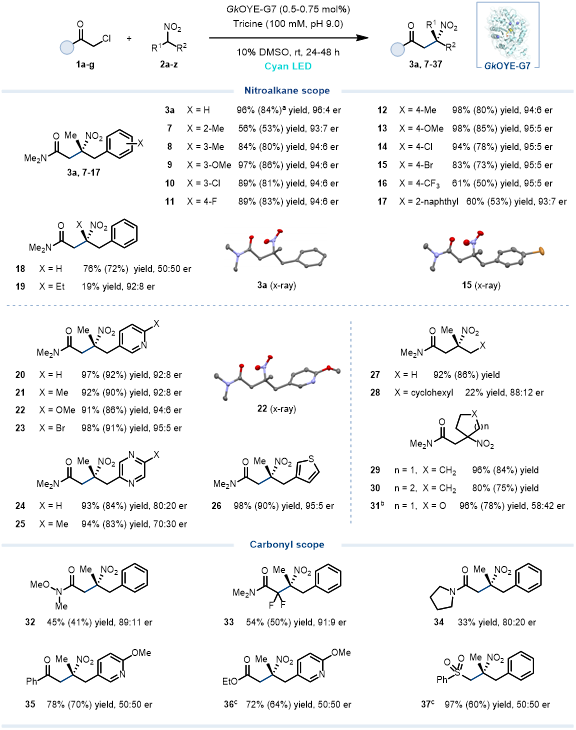
圖 2. 底物范圍。圖片來源:JACS
對于高度進化的酶,它們通常具有很高的反應專一性。作者發現,當采用CsER來催化1a與α-芳香取代硝基烷烴38的反應時,主要得到XEC產物39b-43b(82–93%, 最高99:1 er),以及僅微量的C-烷基化產物39a-43a(b/a > 27:1,圖3)。引人注目的是,當采用進化的GkOYE-G7在完全一致的條件下來催化該反應時,卻得到了相反化學選擇性的產物,即主要得到C-烷基化產物39a-43a(65–92%, 最高99:1 er),而幾乎觀察不到XEC產物39b-43b(a/b > 25:1, 圖3)。到此,作者發展了兩個高度專一的酶催化劑,GkOYE-G7可高效催化硝基化合物的C-烷基化,而CsER則可更好的催化XEC反應,即硝基的“留”或“去”取決于酶,充分體現了生物催化優越的化學選擇性。
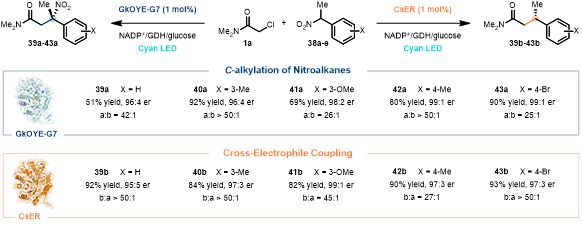
圖 3. 酶控制反應性。圖片來源:JACS
隨后,作者設計了一條巧妙“單酶雙機理”的串聯反應,即原料硝基烯烴44先經由烯酮還原酶的天然氫負轉移機理被還原成硝基烷烴,隨后硝基烷烴再通過非天然自由基機理發生C-烷基化反應,“一酶兩步”生成三級硝基化合物。以GkOYE-G7為催化劑,該串聯反應具有很廣的底物譜,原料硝基烯烴44全部轉化為相應硝基烷烴,且以較高的產率和立體選擇性得到三級硝基終產物(86–96%, 最高96:4 er, 圖4A)。最后,作者對三級硝基酶產物3a進行還原,得到相應手性α-三級胺45(65%,96:4 er, 圖4B)。
機理方面,作者通過UV-Vis光譜實驗證實FMNhq、α-氯代酰胺1a、硝酮(nitronate模擬物)在酶的活性口袋內形成了四元電荷轉移復合物(CT complex)。激發該四元復合物可實現FMNhq對1a選擇性的單電子還原,得到α-酰胺自由基4,該自由基隨后對nitronate 5進行立體選擇性加成得到硝基陰離子自由基6,最后被FMNsq單電子氧化得到產物3(圖1B)。
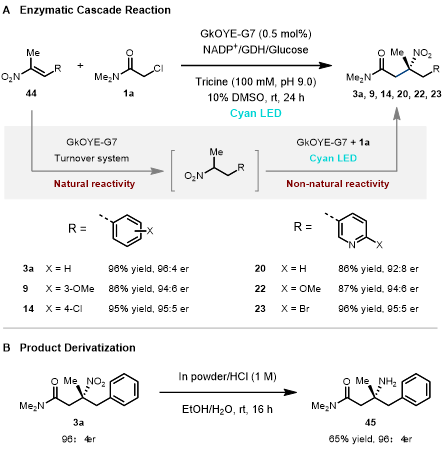
圖 4. 串聯反應及產物衍生化。圖片來源:JACS
總之,本文采用非天然光酶催化策略,實現了對消旋二級硝基烷烴的不對稱C-烷基化反應,獲得了過渡金屬催化難以得到的手性三級硝基產物,進一步拓展了酶催化反應類型的邊界,對現有化學方法起到很好的互補。基于酶本身所特有的高選擇性和易進化性,結合化學原理和蛋白改造,是未來實現更多非天然、普適生物催化方法的有效策略。相關成果在JACS上發表,康奈爾大學博士后付海根和二年級博士生喬天章為本文的共同一作,Todd Hyster教授為通訊作者。
招聘信息:付海根博士將于2023年2月加入中國醫學科學院/北京協和醫學院醫藥生物技術研究所開展研究工作,目前以第一或共同一作在Nature, Nature Catalysis, JACS, J Med Chem等高水平期刊上發表論文十余篇,入選2022年國家海外青年人才計劃。課題組的主要研究方向為生物催化及藥物化學,將致力于發展新的生物催化方法學用于藥物的研發和制備,具體包括:1. 新酶發現或探索酶的非天然機理,解鎖酶催化的全新反應類型;2. 采用酶-化學偶聯來制備手性藥物中間體;3. 抗耐藥菌、病毒小分子藥物研發。因工作需要,擬公開招聘具有藥物化學、有機化學、生物催化、化學生物學等背景的助理研究員2名(國家正式事業編制,需海外博后經歷或國內博后出站)和博士后1名,同時還有少量博士和碩士生名額,歡迎申請或推薦,請將申請材料(簡歷、研究總結、代表作等,申請材料將嚴格保密)發送至人事處辛老師郵箱imb_hrm@126.com,同時抄送付老師fuhaigen@hotmail.com。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn