

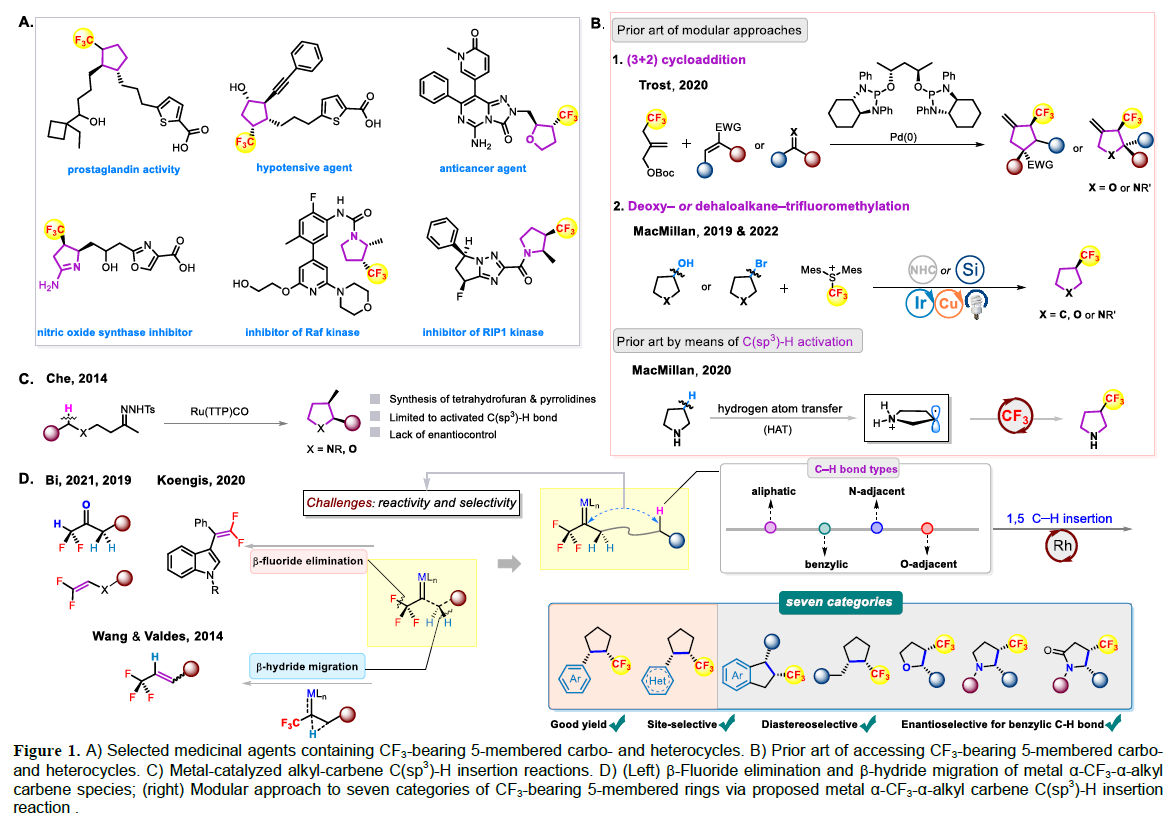
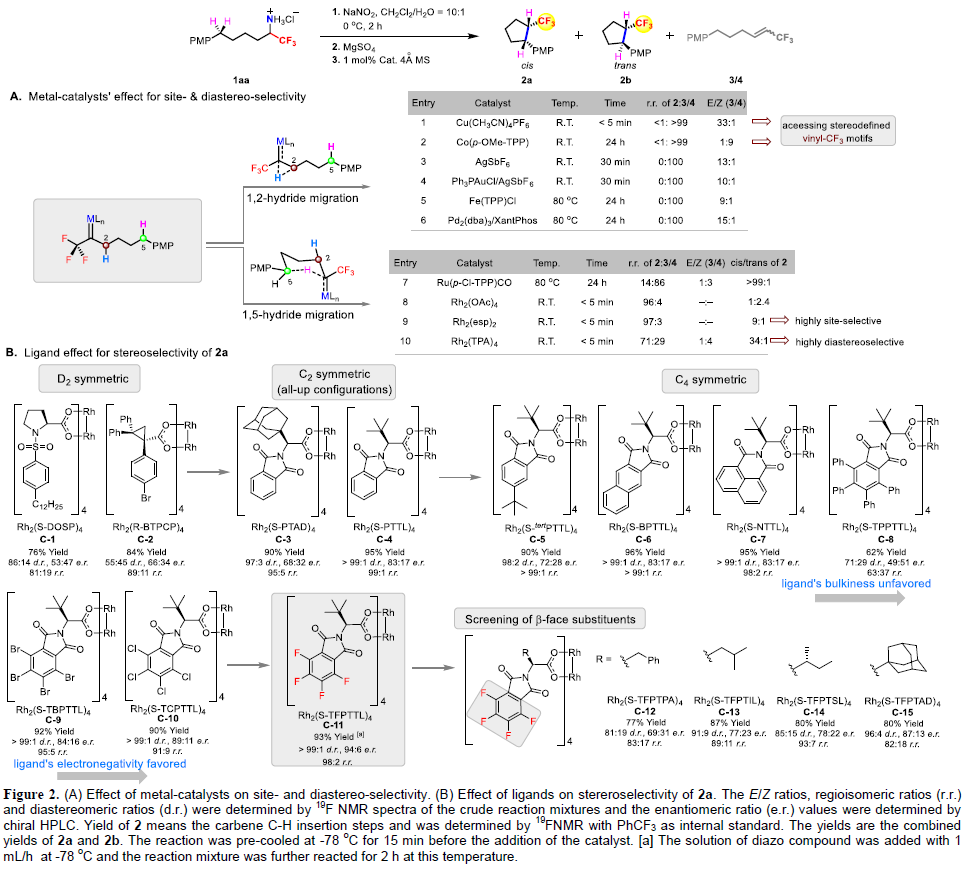
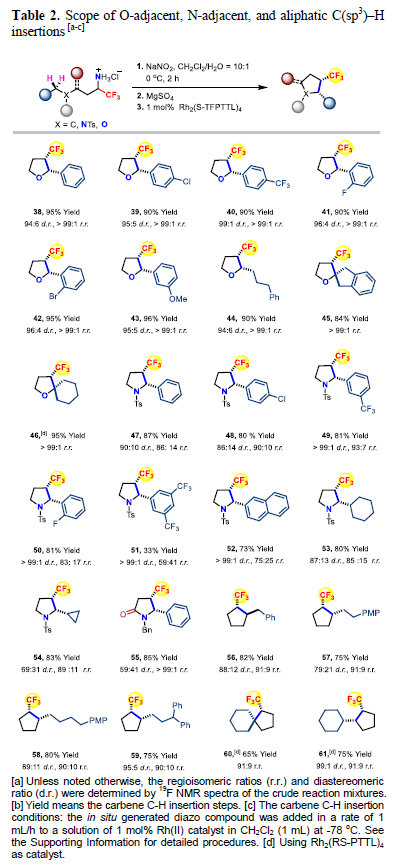
(圖片來源:Angew. Chem. Int. Ed.) 含氟取代基(如CF3)和飽和五元環是廣泛存在于眾多生物活性分子和藥物中的重要結構單元。近些年,三氟甲基官能團化的五元環化合物在藥物設計中受到廣泛關注(Figure 1A)。因此,發展模塊化的合成方法實現此類化合物的合成具有重要的意義。目前發展的Pd-催化的不對稱(3+2)環加成反應以及Ir/Cu-催化烷烴的脫氧或脫鹵三氟甲基化反應均依賴于活性官能團的使用(如烯烴、醇、鹵素等)(Figure 1B)。而通過具有挑戰性的C(sp3)-H直接三氟甲基化來構建CF3官能團化的五元環則少有報道。因此利用模塊化的合成方法高化學選擇性和立體選擇性的實現C(sp3)-H直接三氟甲基過程有待進一步發展。 金屬催化卡賓C(sp3)-H插入反應已在現代有機合成中得到了廣泛的應用。最近,支志明院士課題組利用金屬α-烷基-α-烷基卡賓卟啉物種實現了分子內與O-和N-相鄰的C(sp3)-H的插入,以良好的非對映選擇性構建了一系列五元環化合物(四氫呋喃和吡咯烷)(Figure 1C)。作者設想如果使用α-三氟甲基-α-烷基卡賓來代替α-烷基-α-烷基卡賓來實現反應即可構建一系列CF3官能團化的五元環。實現此過程的主要挑戰在于需要使用有毒和揮發性的氟烷基重氮化合物,高位點選擇性和立體選擇性實現惰性C(sp3)-H鍵的官能團化以及避免潛在的競爭性轉化(β-H消除或β-F消除)(Figure 1D)。最近,香港大學支志明院士課題組使用雙Rh(II)催化劑,利用α-三氟甲基-α-烷基卡賓插入C(sp3)-H鍵,以良好的位點選擇性和立體選擇性控制實現了七類三氟甲基官能團化的飽和五元環化合物的合成。 (圖片來源:Angew. Chem. Int. Ed.) 首先,作者利用可以實現十克級規模制備的α-三氟甲基胺鹽酸鹽1aa作為模板底物進行反應嘗試和條件篩選(Figure 2)。通過對一系列過渡金屬催化劑(Figure 2A)、配體(Figure 2B)等條件進行優化,作者發現首先使用1aa與NaNO2在CH2Cl2/H2O(10:1)中反應原位實現α-三氟甲基-α-烷基重氮化合物的合成,隨后使用Rh2(S-TFPTTL)4 (1 mol%)作為催化劑,在CH2Cl2 (1 mL)中-78 oC反應4小時可以以93%的產率實現產物2的合成(>99:1 d.r.; 98:2 r.r.; 94:6 e.r.)。 (圖片來源:Angew. Chem. Int. Ed.) 在得到了最優反應條件后,作者對一系列α-三氟甲基胺鹽酸鹽的底物范圍進行了探索。通過芐基C-H插入過程,以良好的產率(55-95%)和立體選擇性實現了一系列三氟甲基官能團化的環戊烷2-37的合成(Table 1)。值得注意的是,不同的含氟烷基C2F5(21)和C3F7(22)以及一系列雜芳環,如呋喃(23)、噻吩(24)、苯并呋喃(25)、吲哚(26,28)、苯并噻吩(27)、咔唑(29)、二苯并呋喃(30)、二苯并噻吩(31)等均可兼容此轉化。 (圖片來源:Angew. Chem. Int. Ed.) 接下來,作者探索了O-和N-相鄰的C-H的插入反應(Table 2)。一系列取代的芐醚可以經歷α-三氟甲基-α-烷基卡賓插入相對較弱的C-H鍵,以90-96%的產率,>99:1的非對映選擇性實現四氫呋喃產物38-43的合成。此外,烷基醚底物也可順利兼容,以90%的產率得到產物44。具有較大立體位阻的三級C-H鍵亦可兼容,以良好的產率實現螺環化合物45和46的合成。除此之外,不同芳基(47-52)、烷基取代(53, 54)的Ts保護的胺類底物也可順利實現轉化。值得注意的是,對于具有挑戰性的含有非活化脂肪C-H鍵的底物,仍可以順利實現轉化,以良好的位點選擇性實現56-59的合成。 (圖片來源:Angew. Chem. Int. Ed.) 由于自然界的生物分子缺少含氟基團,并且在藥物發現中對氟化分子的需求日益增加。作者利用此策略合成出的活性雜芳環化合物的衍生化快速構建了含有CF3取代環戊烷骨架的小分子藥物和生物活性化合物。例如,產物24通過乙酰化得到63(80%),隨后63與肼縮合得到64(91%),最后64與溴乙基咪唑經歷SN2取代得到平喘藥的手性CF3類似物65的合成(80%)。此外,利用產物23可以通過RuCl3/NaIO4氧化(68,83% 收率, > 99:1 d.r.)以及酯化過程實現三氟甲基官能團化的雌酮衍生物69(90% 收率, > 99:1 d.r., 89:11 e.r.)的合成。利用產物13可以通過BBr3去甲基化(71,90% 收率)以及與Ac保護的齊墩果酸反應得到三氟甲基官能團化的齊墩果酸衍生物72(81% 收率, > 99:1 d.r.)。 (圖片來源:Angew. Chem. Int. Ed.) 為了深入探索反應機理,作者進行了一系列控制實驗(Scheme 2)。首先,作者嘗試合成α-三氟甲基-α-烷基卡賓銠中間體,但是始終未能成功。但是作者合成了相對穩定的α-三氟甲基-α-烷基卡賓釕中間體78(85%)和79(65%),且通過核磁、紫外以及質譜對其結構對其表征。這是迄今為止首例實現了α-三氟甲基-α-烷基卡賓金屬絡合物的合成(Scheme 2A);盡管利用類似的方法并沒有實現活性更高的絡合物80的分離,但是通過對化學計量的轉化得到的產物證明了α-三氟甲基-α-烷基卡賓釕中間體的存在(Scheme 2C)。隨后,作者利用KIE實驗得出kH/kD = 2.1:1,這與傳統的雙Rh(II,II)催化α-重氮羰基化合物的分子內卡賓C-H插入過程相一致(Scheme 2B)。 (圖片來源:Angew. Chem. Int. Ed.) 最后,作者通過DFT計算對雙銠卡賓中間體的構象進行了探索(Figure 3A)。此外,為了進一步闡明此反應的位點選擇性、對映選擇性和非對映選擇性,作者對相應的過渡態的幾何構型進行了優化,并在此基礎上進一步分析了與選擇性密切相關的非共價相互作用(Figure 3B)。 (圖片來源:Angew. Chem. Int. Ed.) 總結 香港大學支志明院士課題組使用雙Rh(II)催化劑,利用α-三氟甲基-α-烷基卡賓插入C(sp3)-H鍵,以良好的位點選擇性和立體選擇性控制實現了七類三氟甲基官能團化的飽和五元環化合物的合成。該轉化對芐位C-H插入特別有效,且可以實現一系列CF3官能團化的生物活性分子類似物的合成,具有良好的實用性。DFT計算表明,芐位C-H插入的位點選擇性控制、非對映選擇性控制和對映選擇性控制源于強烈的π-π吸引以及C-H-F氫鍵。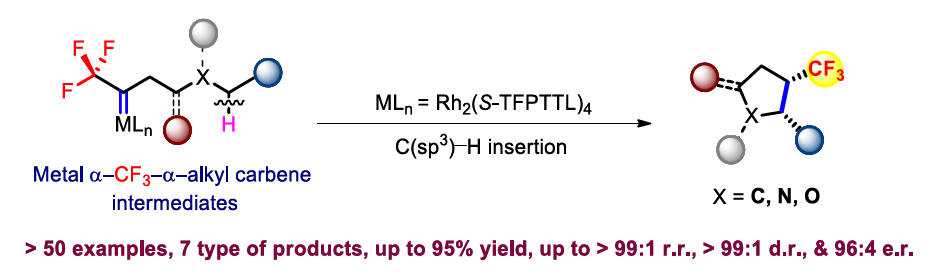


聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn