

1 月 8 日,2022 年國家醫保藥品目錄談判工作正式結束,Paxlovid 因輝瑞報價高未能成功。
Paxlovid 于去年 2 月在國內獲批上市,曾以 2300 元/盒的價格被臨時納入醫保,后又下調至 1890 元/盒,綜合上醫保報銷后患者最低自付為 189 元/盒。
在談判失敗后,醫保仍將臨時性支付到 2023 年 3 月 31 日,也就是說,自 4 月 1 日起,患者購買 Paxlovid 需要自費
醫保談判失敗,國內暫無仿制藥
一般來說,在醫保談判過程中,如果企業確認后的價格高于醫保方談判底價的 115%,則談判失敗,自動終止。雙方最終提出的價格未公布,輝瑞公司的首席執行官 Albert Bourla 表示,「中國要求的價格低于輝瑞對大多數中低收入國家的價格...中國是世界第二大經濟體,我認為他們支付的費用不應低于部分國家」。
去年 8 月,浙江華海藥業公告宣布,與輝瑞簽訂了《生產與供應主協議》, 華海藥業將在 5 年內為 Paxlovid 提供制劑委托生產服務,由輝瑞提供奈瑪特韋原料藥與利托那韋制劑,華海藥業負責奈瑪特韋制劑生產,并完成組合包裝。
今年 1 月 10 日,有投資者向華海藥業提問,「請問華海現在有生產輝瑞新冠藥品嗎?除了在國內合作,雙方有在國外市場合作代工生產嗎?」
圖源:中國經濟網
浙江華海藥業股份有限公司在互動平臺表示,公司正積極配合輝瑞加速推進Paxlovid本土化項目的各項工作,以滿足中國患者的新冠治療需求。

華海藥業初創于1989年,其前身為臨海市汛橋合成化工廠,2001年1月整體變更設立為浙江華海藥業股份有限公司。2003年3月,公司股票在上海證券交易所成功上市。浙江華海藥業股份有限公司是國家級高新技術企業、國家創新型企業和省政府確認的“五個一批”重點企業,設有國家級企業技術中心、博士后科研工作站,是全國首家榮獲“國家環境友好企業”稱號的醫藥企業。2000—2008年連續九年名列“浙江省醫藥工業十強企業”。
2019年浙江高新企業百強榜排名第84位。2020年3月18日,華海藥業以280億元人民幣市值位列《2020胡潤中國百強大健康民營企業》第52。
公司現有員工7000余人,在全球擁有40多家分子公司(包括中國、美國、日本、德國等);主要業務覆蓋化學藥、生物藥、醫藥包裝、貿易流通等多個領域,與全球800多家制藥企業建立了長期合作關系,為100多個國家和地區提供醫療健康產品。

此前,據彭博社消息稱,輝瑞公司首席執行官艾伯樂(Albert Bourla)當地時間周一表示,中國市場對Paxlovid的需求猛增,導致供應緊張,他正在與中國的合作伙伴合作,從今年上半年開始在中國提供新冠口服藥Paxlovid。他當日在舊金山舉行的摩根大通醫療保健會議上透露,該合作伙伴的生產尚未開始,但很快會啟動,“即使在未來3~4個月內就實現這個目標,我也不會感到意外。”不過他并未透露相關公司名稱。
去年,A股原料藥龍頭華海藥業(600521.SH)拿下了輝瑞Paxlovid的制劑委托生產協議,由華海藥業在協議期內為輝瑞在中國大陸市場銷售的Paxlovid提供制劑委托生產服務。其中,輝瑞提供奈瑪特韋原料藥與利托那韋制劑,華海藥業負責奈瑪特韋制劑生產,并完成組合包裝。
1月9日,華海藥業在回應媒體時稱,目前公司在加速推進輝瑞產品本地化生產項目的各項工作,以保障Paxlovid在中國市場的充足供應,但目前Paxlovid本土化還沒有批下來。
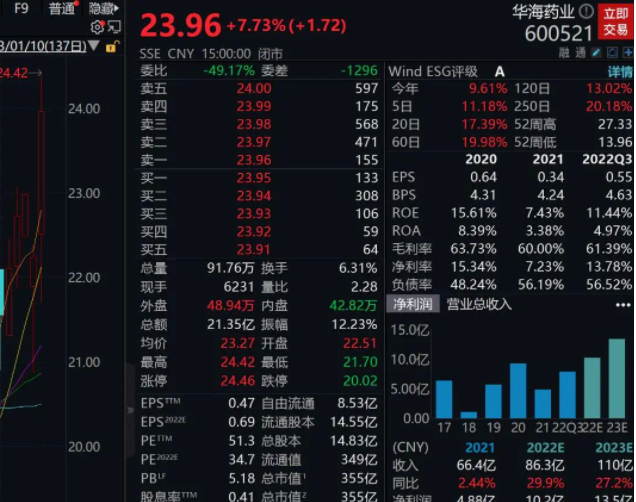
截至收盤,華海藥業(600521.SH)漲近8%,報23.96元/股,總市值355億元。
那么,Paxlovid要從進口產品轉為本地化生產,需要經過哪些程序?這一過程大致需要多久完成?
我國目前實行MAH制度(藥品上市許可持有人),何時進行生產取決于輝瑞何時拿到本地化生產許可證。
俄羅斯工程院外籍院士、昆翎醫藥聯合創始人張丹向記者表示,輝瑞之所以選擇進口轉地產,是因為在國內生產可能會大幅降低成本。對于輝瑞而言,要實現在中國的本地化生產有兩種路徑選擇。一是由輝瑞的在華子公司為代理;二是選擇合作伙伴,例如華海藥業為代理。
上述業內人士進一步分析,前一種方式為輝瑞自己的子公司持證,相當于華海藥業僅賺取Paxlovid的加工費。而后者相當于輝瑞和華海藥業的BD(商務拓展)合作,輝瑞將Paxlovid的相關專利、生產工藝、質量體系等都轉賣給華海藥業,由華海藥業生產Paxlovid后,獲取銷售分成。
此前,1月9日,華海藥業投資者關系部門相關人士在回應媒體時稱,“醫保是輝瑞在談,公司只是給輝瑞做代工”。不過,上述業內人士認為,僅從商業合作的角度上看,選擇后者的方式對輝瑞而言更加方便。因為按照現行規定,持證方需要自行負責產品的質量體系,放行檢測等工作不可以外包。換而言之,授權給合作伙伴對于輝瑞而言減少了一些工作。而張丹指出,選擇何種方式是出于公司的整體戰略考量,外部人士難以預測。
在決定本地化生產方式后,輝瑞與合作伙伴還需要完成進口API(原料藥)登記和補充產品驗證性數據。這是為了來驗證轉為本地生產的產品與原來的進口產品是否完全一致,包括轉交本地生產的API處方、生產工藝、質量系統等是否一致,本地生產的產品與進口產品在臨床上的藥效、安全性是否存在差異等。具體而言,對于一些結構簡單、穩定、合成過程并不復雜的化藥來說,通過溶出試驗等體外試驗就足以完成這一過程。而對于一些結構不穩定、合成工藝復雜、緩釋制劑、吸入式藥物等,則可能需要做臨床試驗。前者花費的時間一般在3至6個月,后者則相對繁瑣,涉及臨床批件、倫理審查等,需要半年至一年。
對于比對試驗,上述業內人士認為,Paxlovid可能僅需完成體內外相關性(IVIVC)評價即可。其與驗證性臨床試驗的區別在于,IVIVC評價入組的是健康人群,驗證性臨床試驗入組的是相關患者。因此IVIVC評價完成難度更小、速度更快。但其認為,無論補充何種試驗,由于Paxlovid的半衰期本身就很短,因此這一過程不會花很長時間。業內人士認為,若輝瑞的合作伙伴,如華海藥業的工藝驗證、清潔驗證等都沒有問題,也有空置的生產線專門用來生產相關產品,預計從申報到上市的時間大約在三到四個月。
香港大學李嘉誠醫學院生物醫學學院、病毒學專家金冬雁教授表示,Paxlovid患者在感染后的72小時內服用效果最好,若出現重癥就沒有太大價值,數據顯示該藥對65歲以上老人及有基礎病的患者較為有效,能降低81%死亡率,但40-64歲年齡組沒有明顯獲益。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn