- 首頁
- 資訊
JMC:山大李敏勇團隊在靶向蛋白降解新策略和新技術研究方面取得新進展
來源:山東大學 2023-01-09
導讀:近日,山東大學藥學院李敏勇教授團隊在新型靶向蛋白降解策略研究領域取得新進展,在藥物化學權威期刊Journal of Medicinal Chemistry(中科院一區,TOP)上發表了題為“Targeted Protein Degradation Induced by HEMTACs Based on HSP90”的研究性論文,藥學院博士研究生李臻臻為第一作者,李敏勇教授為獨立通訊作者,山東大學為第一作者單位和唯一通訊作者單位。

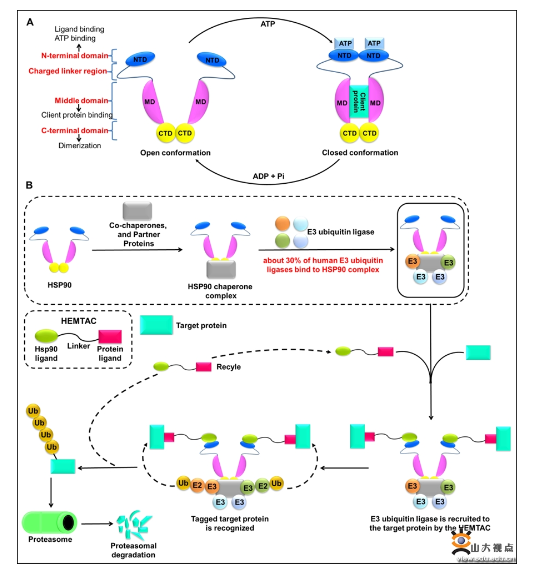
在對藥物化學的不斷探索中,新的靶向疾病驅動蛋白的策略正在不斷地被開發,其中,由小分子誘導的靶向蛋白降解策略是近年來最值得關注的,該策略可以靶向無活性位點或者不可成藥的蛋白靶標,使得降解任意一種蛋白成為了可能。PROTAC技術相關的候選藥物ARV-110和ARV-471已進入臨床II期,PROTAC技術主要針對細胞內蛋白,而LYTAC和AbTAC等一系列技術可以降解細胞外分泌蛋白和膜蛋白。蛋白降解技術在靶向不可成藥靶點和疾病治療方面展現出了非常大的潛力。雖然這些新的降解技術的出現可以克服小分子抑制劑的局限性,但是,新興的降解技術也存在一些局限性,小分子PROTAC通過“劫持”E3連接酶發揮其降解作用,然而已有研究表明基于VHL和CRBN的小分子PROTAC在細胞中會引起脫靶效應和耐藥機制的產生。因此,迫切需要擴大靶向降解技術的范圍,開發新的蛋白降解技術。李敏勇教授團隊基于熱休克蛋白90(HSP90)能夠結合E3泛素連接酶形成復合物的關鍵特性以及HSP90與腫瘤之間的密切關系,設計開發一種新型的蛋白降解技術,并將其命名為熱休克蛋白90介導的靶向嵌合體(HEat shock protein 90 (HSP90)-MediatedTArgetingChimeras, HEMTACs)。小分子HEMTACs包含三個部分:與靶蛋白結合的配體、連接鏈和與HSP90結合的配體。連接鏈連接兩個配體構成小分子HEMTACs。HEMTACs通過“劫持”HSP90,也就是“劫持”HSP90/E3泛素連接酶復合物(HSP90/E3),可以誘導目標蛋白(POI)、HEMTAC和HSP90/E3復合物之間形成新的三元復合物。形成的POI-HEMTAC-HSP90/E3三元復合物是將E3泛素連接酶招募到目標蛋白以及隨后的泛素分子轉移并誘導目標蛋白被蛋白酶體降解的必要條件。該研究工作以CDK4/6抑制劑和HSP90抑制劑作為相應的配體設計并合成了一系列靶向CDK4/6的小分子HEMTACs。活性評價結果表明,小分子HEMTAC在B16F10黑色素瘤細胞中能夠成功誘導CDK4/6的降解,并且小分子HEMTAC具有顯著的體內抗黑色素瘤的作用。綜上,這一概念驗證研究證明了小分子HEMTACs作為一種新型的靶向降解策略的可行性,并為降解同一靶點提供了更多的選擇,同時也為開發其他相關的蛋白降解技術提供了一種新的、行之有效的策略。近年來,李敏勇教授團隊綜合應用合理藥物設計、計算機輔助藥物分子設計、分子生物學和化學生物學等手段進行藥物化學研究工作,在生物活性的可視化研究、分子探針研究以及合理藥物設計與藥物化學研究等方面取得了一系列研究成果,近5年先后以通訊作者在J. Am. Chem. Soc.、Cell Chem. Biol.、Acta Pharm. Sin. B、J. Med. Chem.、Anal. Chem.等期刊發表SCI論文70余篇,被SCI引用5400余次,被引H指數為41;授權中國和PCT發明專利20項。上述研究成果獲得了國家自然科學基金、山東省泰山學者、山東省自然科學基金、微生物技術國家重點實驗室創新群體基金等項目的資助。論文鏈接:https://doi.org/10.1021/acs.jmedchem.2c01648
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn