

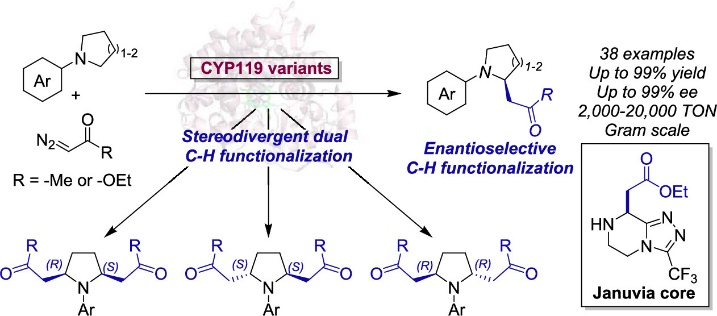
圖1. 酶催化環胺的高對映選擇性α-C–H功能化(圖片來源:J. Am. Chem. Soc.)
飽和含氮雜環(如吡咯烷、哌啶、嗎啉)是許多藥物和生物活性天然產物的關鍵結構組成,通過C(sp3)–H功能化策略合成這類分子一直是科研工作者們努力的方向。但是大多數的C(sp3)–H功能化策略需要多步合成步驟才能實現,例如首先通過強堿作用生成活性a-胺基陰離子,然后使用過渡金屬催化實現烷基化/芳基化(圖2a);使用氧化C–H功能化方法先生成亞胺陽離子中間體,然后再和碳親核試劑反應(圖2b);經過光氧化還原反應生成胺基自由基后通過過渡金屬催化實現烷基化/芳基化(圖2c)。酶具有的專一化學選擇性、可持續性,以及可以通過蛋白質工程優化活性和立體選擇性,使酶催化成為實現C–H功能化強有力的手段。目前使用小分子有機金屬催化劑通過金屬-卡賓插入手段實現C–H功能化已多有報道,然而,對映選擇性分子間的C(sp3)?H卡賓插入仍具有很大的挑戰性,僅有的可行策略很大程度上局限于銠催化體系和“給體-受體”卡賓轉移試劑。近年來,Rudi Fasan 團隊和Hartwig團隊(Science 2016, 354, 102)以重氮乙酸乙酯(EDA)為卡賓前體,利用含有金屬取代血蛋白的人工金屬酶分別實現了鄰苯二甲醚類底物的C(sp3)?H烷基化以及吲哚類底物的C?H功能化(圖2d)。最近,Arnold等人則報道了一種來自P450BM3(P411-CHF)的生物催化劑(Nature 2019, 565, 67),用于將EDA對映選擇性插入芐基和烯丙基C(sp3)?H鍵中(圖2e),該生物催化劑經過優化可以實現a-C?H烷基化反應。盡管取得了這些進展,但通過卡賓轉移的酶催化C(sp3)?H功能化使用范圍仍具有很大的局限性。在此,作者使用重氮酮和重氮酯作為卡賓給體,報道了一種多功能的生物催化體系,以高效和高對映選擇性實現了對環胺的單/雙a-C(sp3)?H官能團轉化(圖2)。
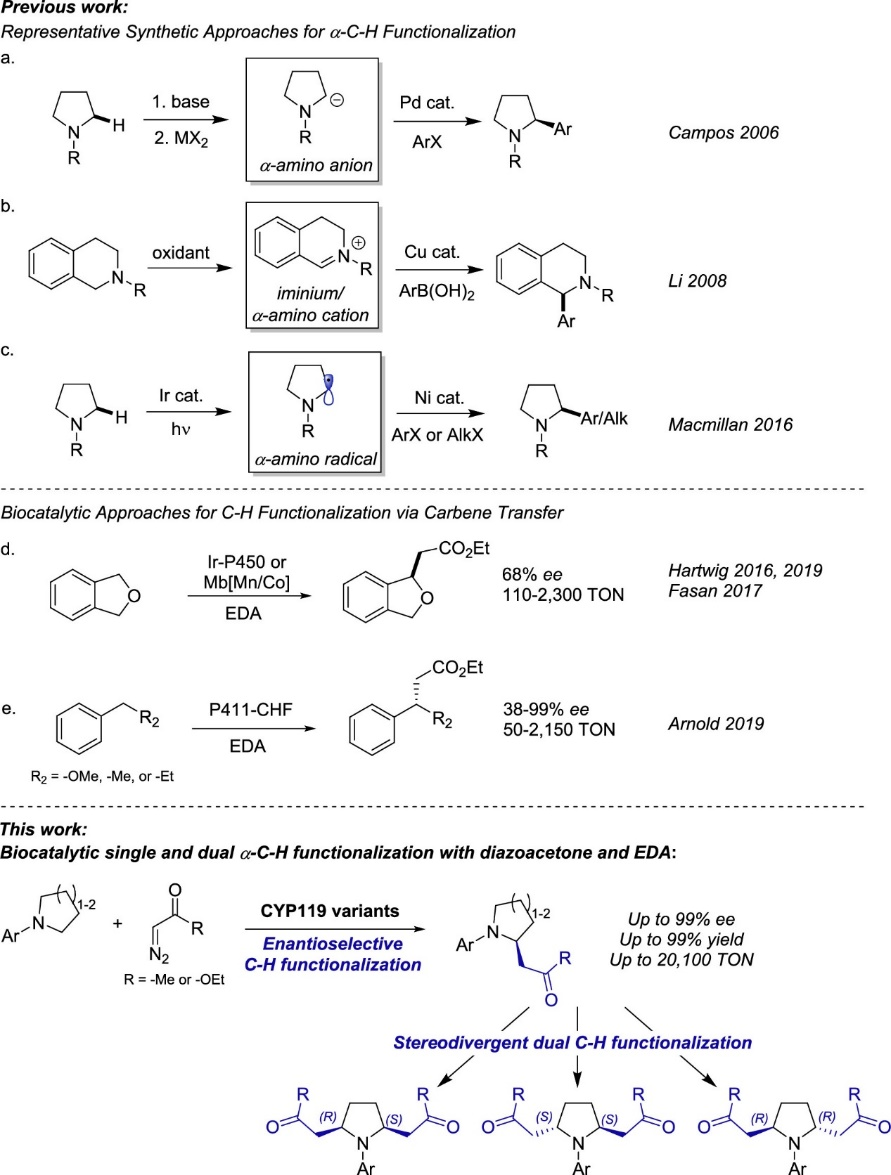
圖2. a-C?H功能化的化學催化法和生物催化法(圖片來源:J. Am. Chem. Soc.)
首先,作者嘗試了一系列肌紅蛋白及其類似物來催化未被報道過的N-取代吡咯烷2a與重氮酮1a的分子間C–H功能化(表1),然而,這些肌紅蛋白類似物無論是在整個細胞中還是作為純化的蛋白質均沒有表現出反應活性(entries 1-3)。作者同樣嘗試了文獻中可將EDA對映選擇性插入芐基和烯丙基C(sp3)?H鍵中P450系列生物催化劑(比如P450 XplA, P450cam, CYP119),但同樣沒有得到可檢測到的反應活性(entries 4-5)。鑒于嘗試的野生型P450生物酶缺乏反應活性,作者通過將位于靠近血紅素輔助因子的氨基酸殘基替換為丙氨酸,以此來系統性地改變這些酶的活性位點以及提高對目標底物的識別性能,得到了0.4%的收率(entry 6)。基于此,作者將CYP119(T213A)中的Cys317殘基突變為其它的蛋白質親核氨基酸殘基,如組氨酸(His)、絲氨酸(Ser)、蘇氨酸(Thr)、酪氨酸(Tyr)、精氨酸(Arg)、賴氨酸(Lys)、天冬氨酸(Asp)和谷氨酸(Glu),當使用CYP119(T213A, C317S)為催化劑時,得到了2%的收率和69:31的對映選擇性(entry 7)。作者還發現這類由絲氨酸連接的CYP119變體酶與CO結合的鐵質形式在406 nm處顯示一個Soret峰(圖3b)。為了進一步提高對胺2a的C?H功能化反應性,作者對CYP119(T213A,C317S)進行了多次活性位點誘變和篩選,例如將圖3a中活性位點殘基L69、F153、L205、A209和V254分別隨機使用或組合使用各種氨基酸殘基(Gly, Ala, Ser, Val, Leu, Trp, Thr, Asn, Gln, Cys, Pro, Ile, Met, Phe, Thr),將這些生物酶在大腸桿菌(E. coli)C41 (DE3)中表達并在96孔板中作為全細胞進行篩選,最終篩選得到高達er = 99.5:0.5的目標產物3a(圖3c,表1,entries 8-12)。最終,作者發現在細胞密度(OD600)為40的全細胞上進行反應,以CYP119(F153G, A209G, T213A, V254A, C317S)(即CHI-DA)作為酶催化劑,可以得到高達99%的收率、er = 99.5: 0.5的對映選擇性以及TON = 12900 的高催化活性(entry 10),該TON值比之前使用P411對其它C?H卡賓插入反應的催化活性高一到兩個數量級(圖2e)。
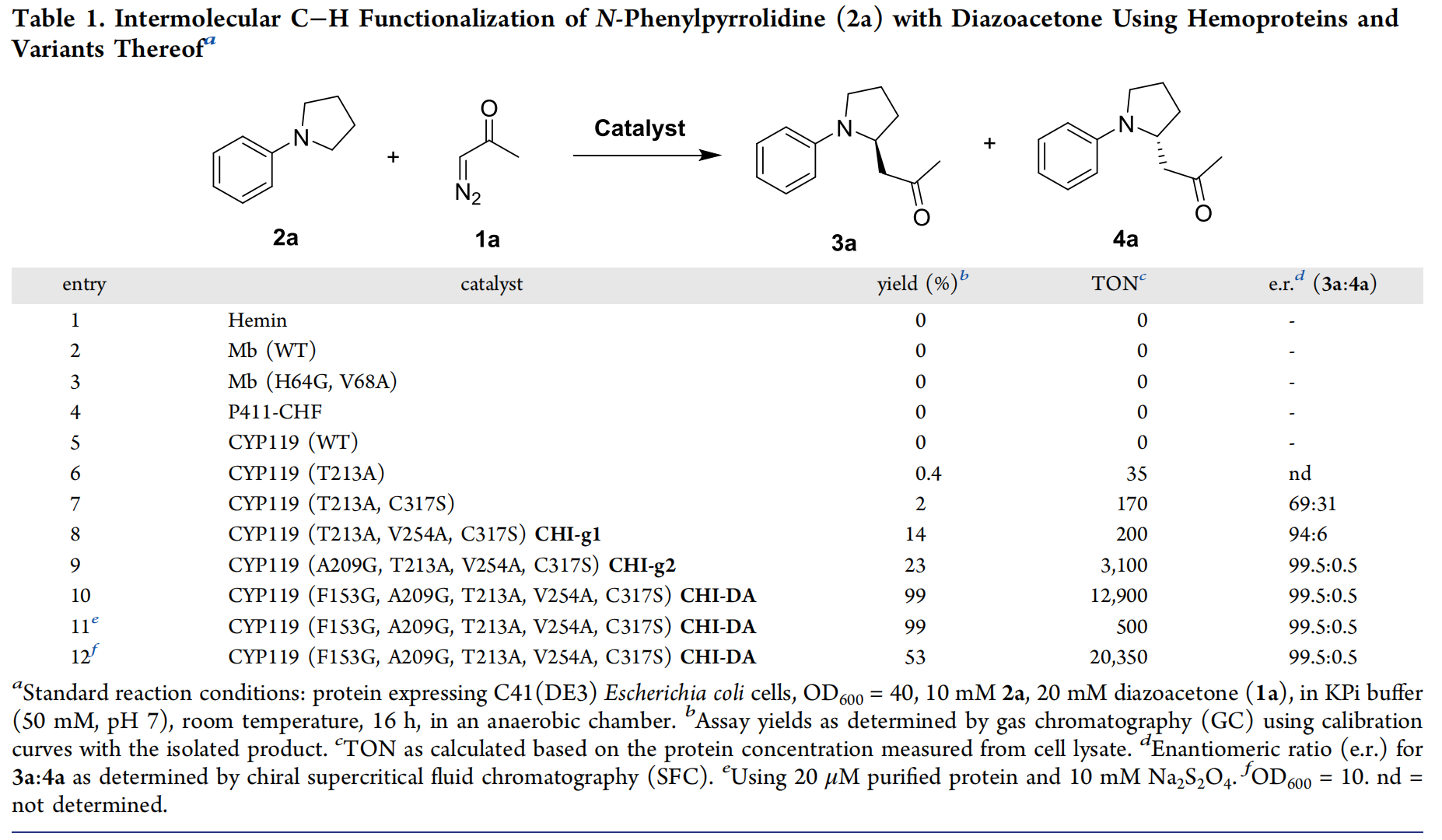
表1. 酶催化劑的篩選(圖片來源:J. Am. Chem. Soc.)
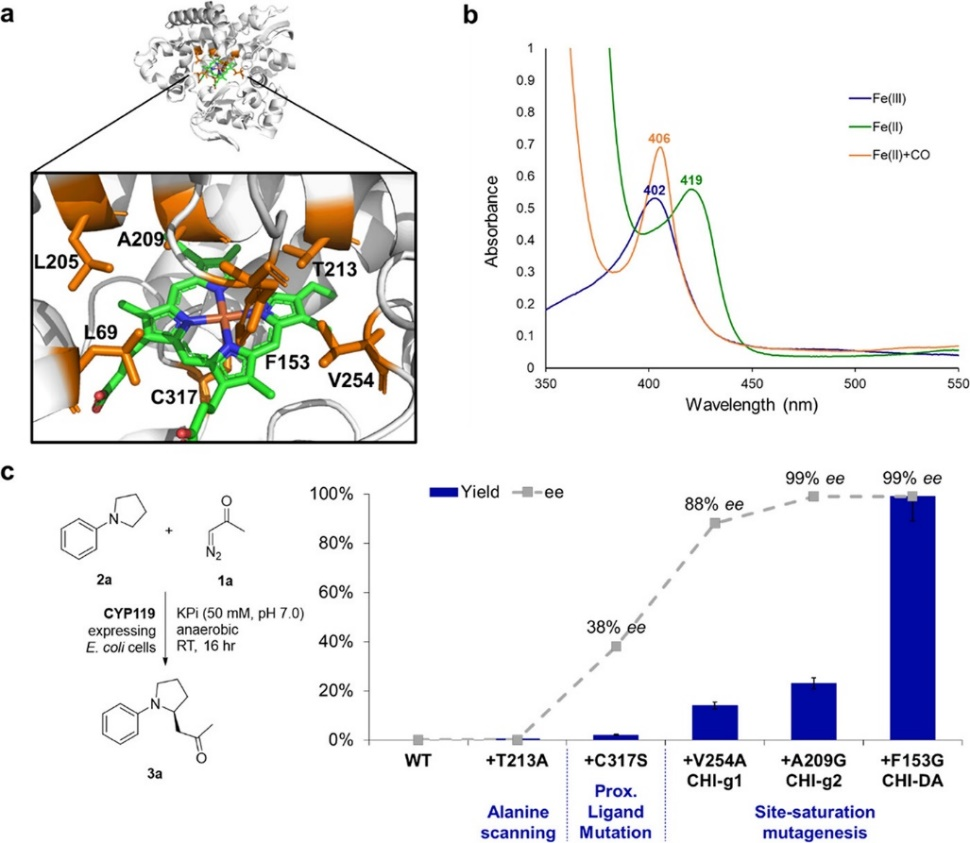
圖3. CYP119催化劑的結構、光譜特性和催化效果(圖片來源:J. Am. Chem. Soc.)
該反應具有良好的底物范圍(圖4)。作者嘗試了不同取代基的N-芳基吡咯烷衍生物(2b-l),對于對位取代的底物,例如2b(p-Me)、2e(p-F)和2f(p-Cl),均可以良好的收率(51-93%)和對映選擇性(86:14-91:9 e.r.)得到相應的產物(圖4)。但是當在鄰位和間位有取代基時,該反應收率及對映選擇性均較低(圖4, 3c, 3h, 3i, 3j),為了解決該底物范圍的限制,作者嘗試了其它較高活性的CHI-g(1-3)系列酶,進而使得鄰位、對位底物(例如2c, 2h, 2i, 2j)以及吡啶類底物(2j)能夠以較高的收率和對映選擇性得到目標產物(圖5)。
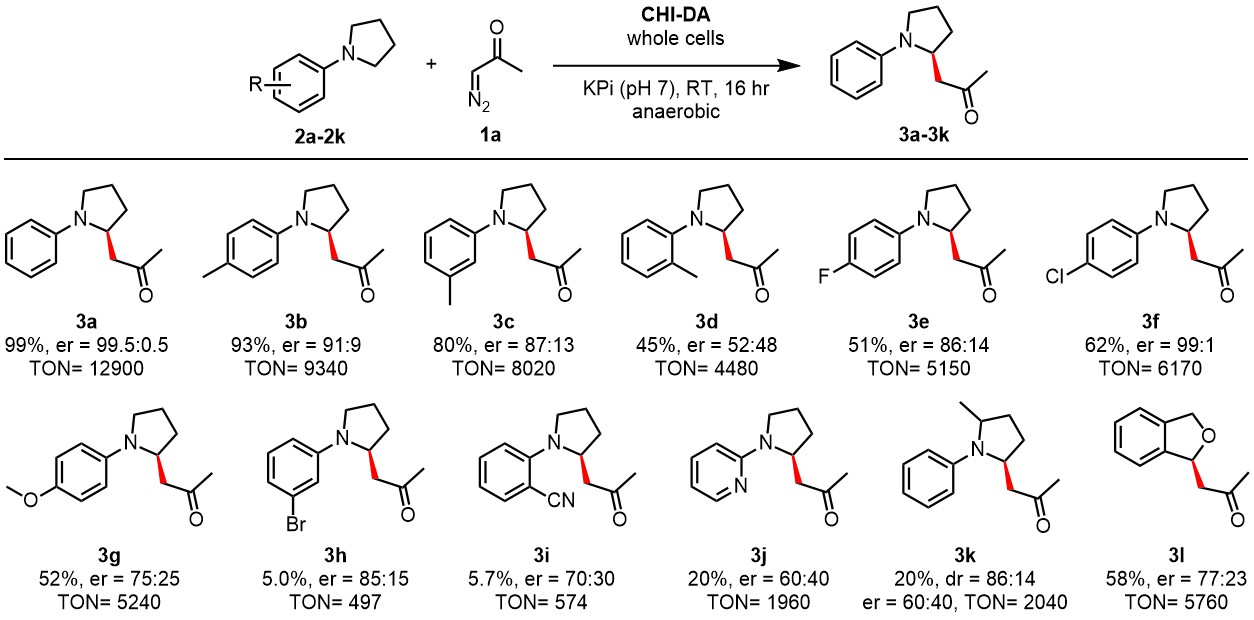
圖4. 底物范圍(圖片來源:J. Am. Chem. Soc.)
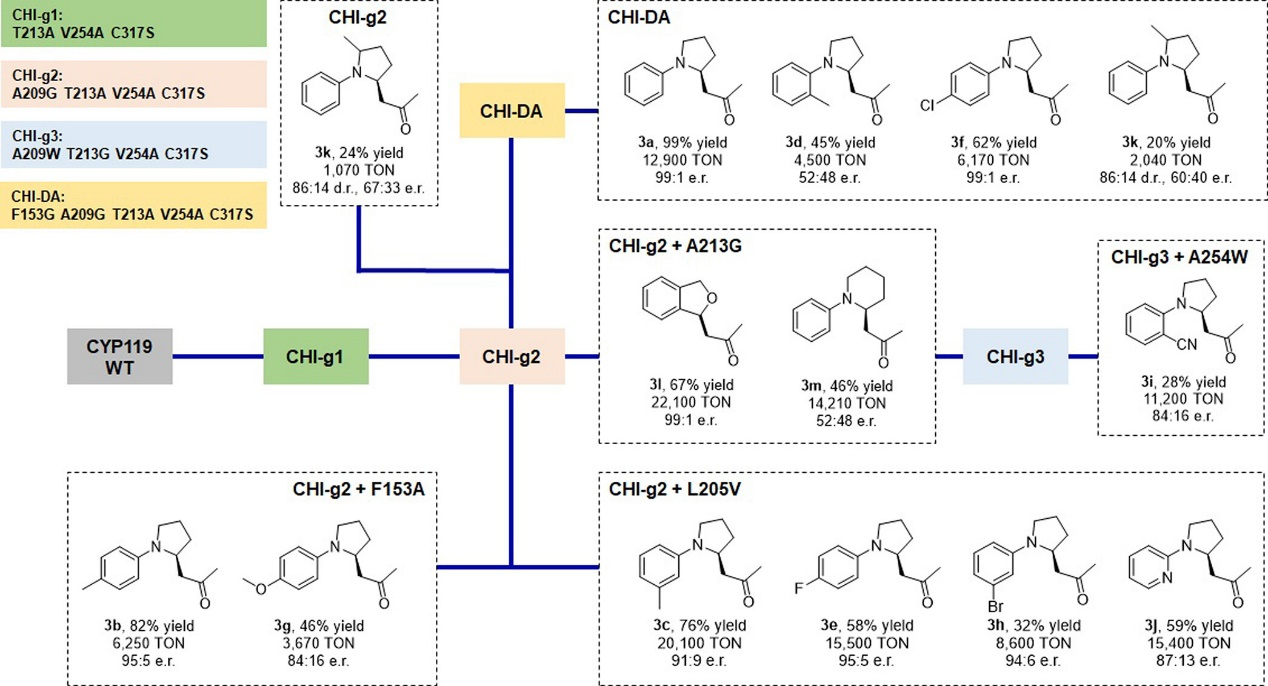
圖5. 基于CYP119的酶催化劑活性及選擇性(圖片來源:J. Am. Chem. Soc.)
此外,作者嘗試了用EDA做底物對N-苯基吡咯烷進行C–H功能化(表2)。相似地,作者首先在全細胞中篩選了基于CYP119活性位點的丙氨酸殘基酶,此時的野生型CYP119和大多數丙氨酸突變體在該反應中表現出了可檢測的活性(entries 1-3);隨后作者將最有利的丙氨酸突變(T213A)與軸向配體突變C317S相結合,有效提高了反應收率、對映選擇性和TON值(entry 4);當作者使用三重突變體CYP119(T213A,V254A,C317S)(即CHI-g1)時,得到了高達99%的收率和er = 79:21的對映選擇性(entry 5)。為了提高該反應的對映選擇性,作者對該催化劑作了進一步地改進,最終在使用四突變體CYP119(F153G, T213A, V254A, C317S)(即CHI-EDA)作為催化劑時得到了89%的收率,er = 87:13的對映選擇性和TON = 8920的催化活性(entry 6)。以純化的酶催化該反應得到了類似的收率和對映選擇性,但是TON大幅降低(entry 7);若使用四突變體CYP119(A209W, T213G, V254A, C317S)催化該反應,則會得到相反的對映選擇性(entry 10)。
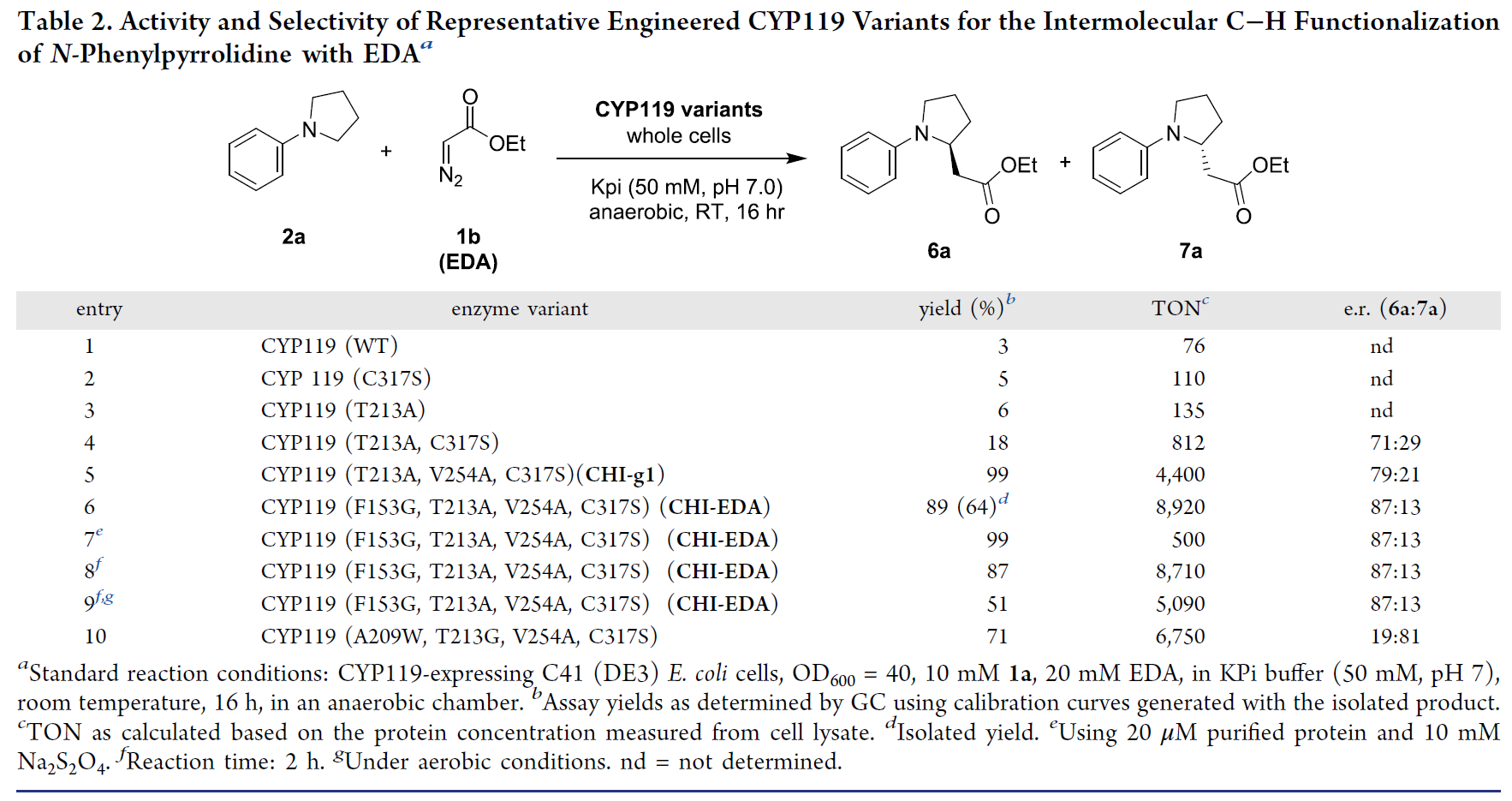
表2. 以EDA為底物的反應條件篩選(圖片來源:J. Am. Chem. Soc.)
作者還探索了重氮丙酮和EDA的立體發散雙C–H功能化。作者在前期篩選工作中,發現某些高活性的變體酶可以使得反應進行雙C–H功能化,進而得到順式和反式的2,5-二取代產物(圖6a);作者還發現不同的CYP119變體酶催化得到的順式和反式異構體產物比例存在明顯差異,這表明雙插入反應的立體選擇性可以通過蛋白質工程來調節。最終,作者通過篩選一系列CYP119酶,成功用一鍋法將兩種不同的重氮試劑進行串聯進而實現立體發散雙C?H功能化,高選擇性地產生三種立體異構產物(圖6b-c),即順式cis-(S,R), 反式trans-(S,S)和trans-(R,R)。
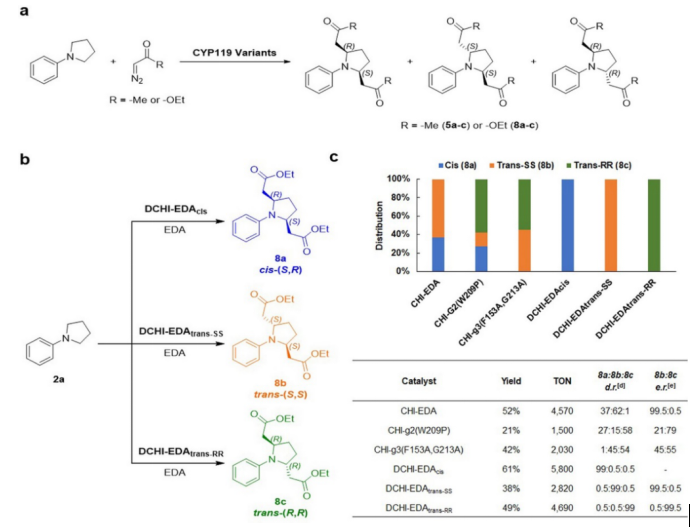
圖6. 立體發散的雙C–H功能化(圖片來源:J. Am. Chem. Soc.)
最后,作者還嘗試了將此C–H功能化應用于高級藥物(例如抗糖尿病藥物sitagliptin)的后期衍生化中(圖7),該分子除了金屬配位基團(三唑)存在外,還具有一個稠合的哌嗪環,多個反應活性相似的a-C?H鍵使得該反應的區域選擇性面臨巨大的挑戰。作者首先嘗試了在EDA的存在下,對MOM保護的化合物11a進行催化劑篩選,發現使用CYP(T213A,C317S)可以成功進行C(sp3)?H功能化,經過脫保護后可以得到33%的總收率和er = 79:21的對映選擇性。值得注意的是,同樣的酶能夠以相近的對映選擇性(er = 74:26)使未保護的中間體11b產生雙N?H/C?H插入產物13以及N?H插入產物14(圖7),證明了生物酶催化的C–H功能化在藥物后期衍生化中具有重要的應用價值。
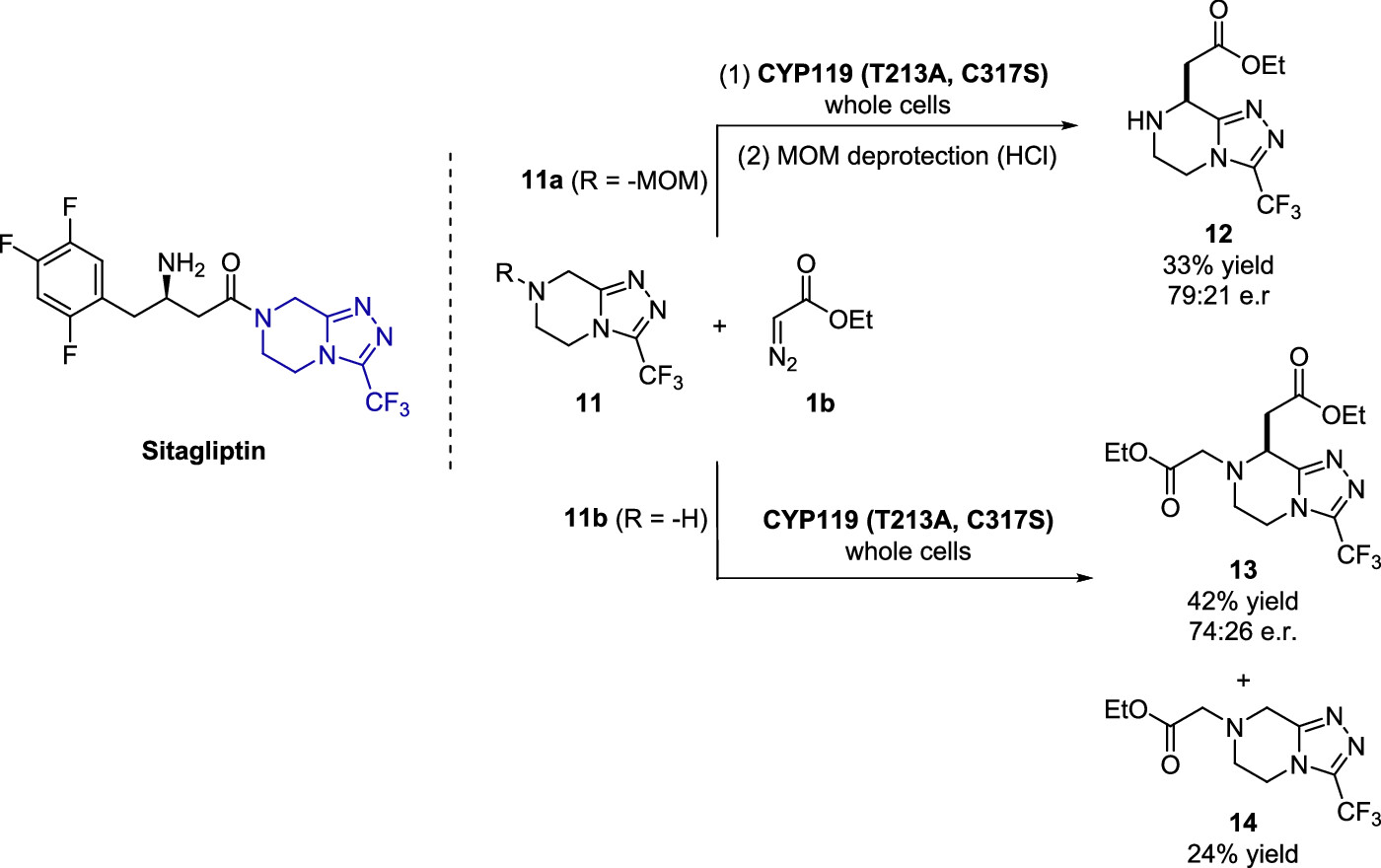
圖7. Sitagliptin母核的后期衍生化(圖片來源:J. Am. Chem. Soc.)
總結
Rudi Fasan教授團隊報道了一系列CYP119衍生的生物催化劑,用以吡咯烷類化合物進行不對稱a-C?H功能化,表現出了高效的催化活性以及高對映選擇性,TON高達22100,同時可以通過一鍋法實現具有非對映和對映選擇性的雙重a-C–H功能化。該項工作為飽和氮雜環的直接不對稱a-C–H功能化提供了一種高效且可調節的方法,為生物活性分子的合成、發現和優化提供了新的機會。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn