

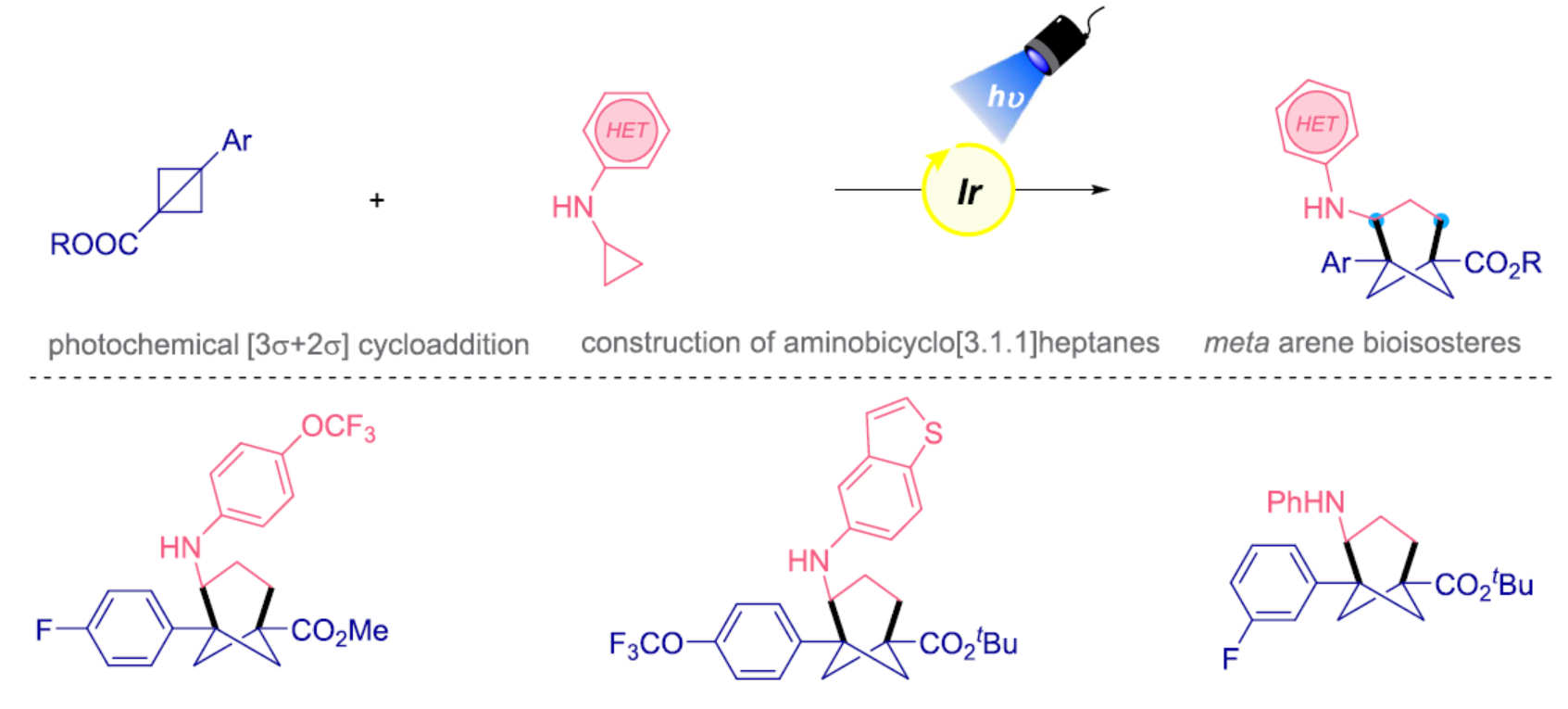
(圖片來源:J. Am. Chem. Soc.)
雙環烴已經證明了在治療分子中取代芳香環的能力,具有更大的溶解度、代謝穩定性以及增強的藥代動力學特性。由于這些特性,這些生物等排體骨架在藥物分子設計中受到了相當大的關注。其中,在小環籠狀烴中研究最多的是一種雙環[1.1.1]戊烷(BCPs),其用作鄰位和對位取代的苯環以及叔丁基的生物等排體取代物。目前,化學家們也開發了幾何互補的間位取代芳烴生物等排體的新型合成方法。然而,此類策略主要使用橋聯取代的BCPs和雙環[2.1.1]己烷用于探索這些骨架,盡管這些骨架并不完全模擬間位取代芳烴中顯示的鍵載體。最近,Brown和Glorius課題組開發了一種有效的[2π+2σ]光環加成策略,用于合成雙環[2.1.1]己烷。從合成的角度來看,制備能夠精確再現間取代芳烴幾何結構的生物等排體一直具有挑戰。最近,通過使用[3.1.1]丙烯作為原料制備雙官能團化的雙環[3.1.1]庚烷研究表明,這些亞結構可作為間位取代芳烴的類似物(Figure 1)。
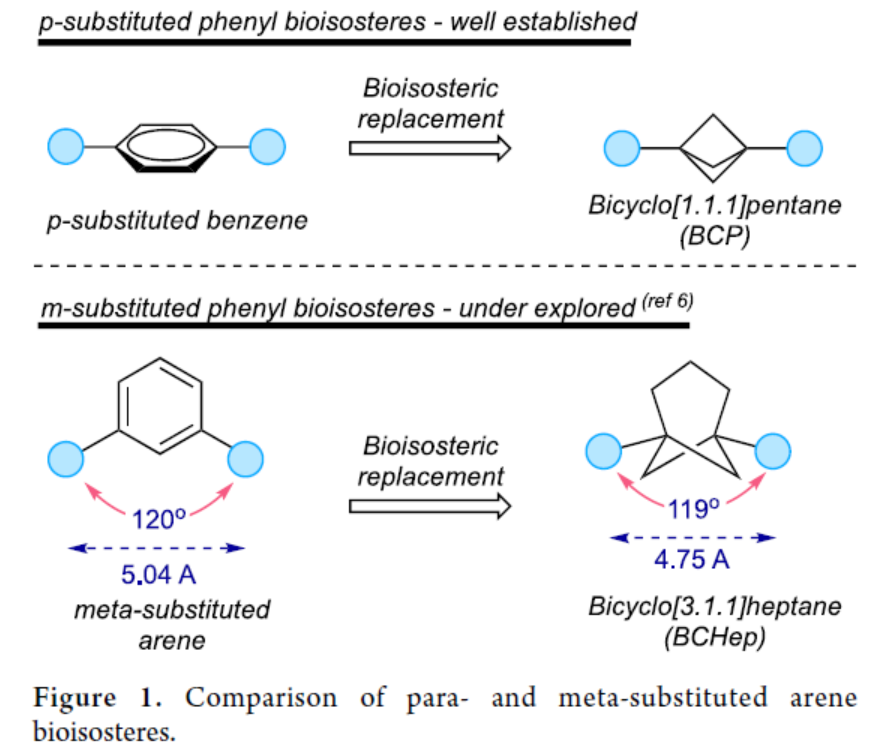
(圖片來源:J. Am. Chem. Soc.)
環丙胺(CPAs)具有多功能性,可作為獲得高價值含氮有機化合物的砌塊。環丙胺與烯烴的[3+2]環化反應可用于構建復雜的環胺。它們作為合成骨架的用途源于最初氧化為氮自由基陽離子時不可逆的開環。1998年,Cha和Iwata團隊報道了含有烯基的N,N-二烷基氨基環丙烷用于構建氨基八氫戊烯。在合成雙環氨基烷烴的光化學[3+2]環加成發展中,使用雙環CPAs通過釕光催化分子間的方式進行反應。后來,化學家們還報道了氨基/亞氨基環丙烷和烯烴的分子內和分子間環加成反應(Figure 2)。近日,美國賓夕法尼亞大學Gary A. Molander課題組首次報道了一種光誘導雙環[1.1.0]丁烷和環丙胺的[3σ+2σ]環加成反應,合成了一系列三取代雙環[3.1.1]庚烷衍生物。
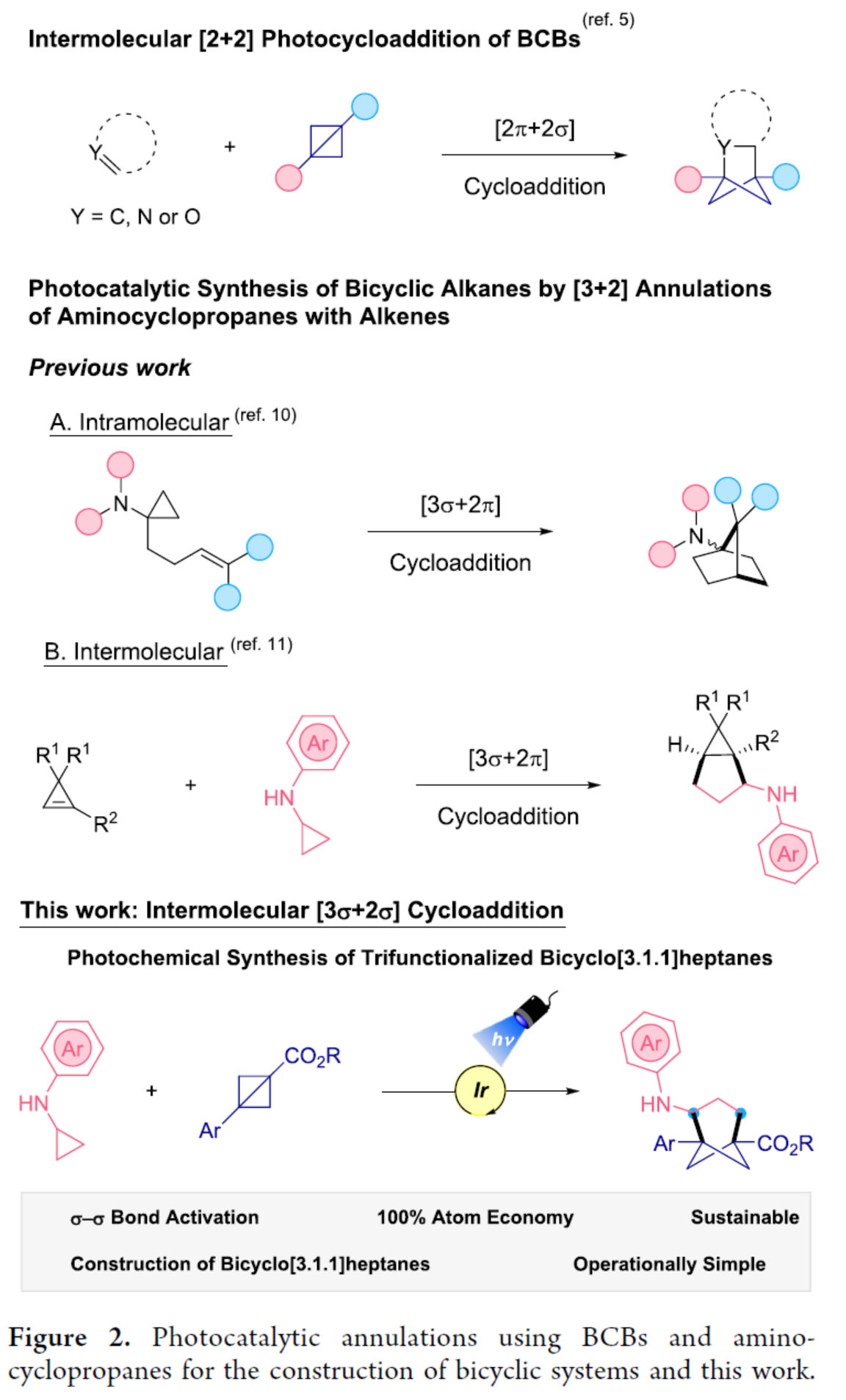
(圖片來源:J. Am. Chem. Soc.)
首先,作者以BCB 1a與CPA 2a作為模型底物,進行了相關環加成反應條件的篩選(Table 1)。當以Ir[dF(CF3)ppy]2(dtbpy)PF6作為光催化劑,427 nm Kessil Lamp作為光源,在DMSO溶劑中室溫下反應36 h,可以70%的收率得到雙環[3.1.1]庚烷產物3。
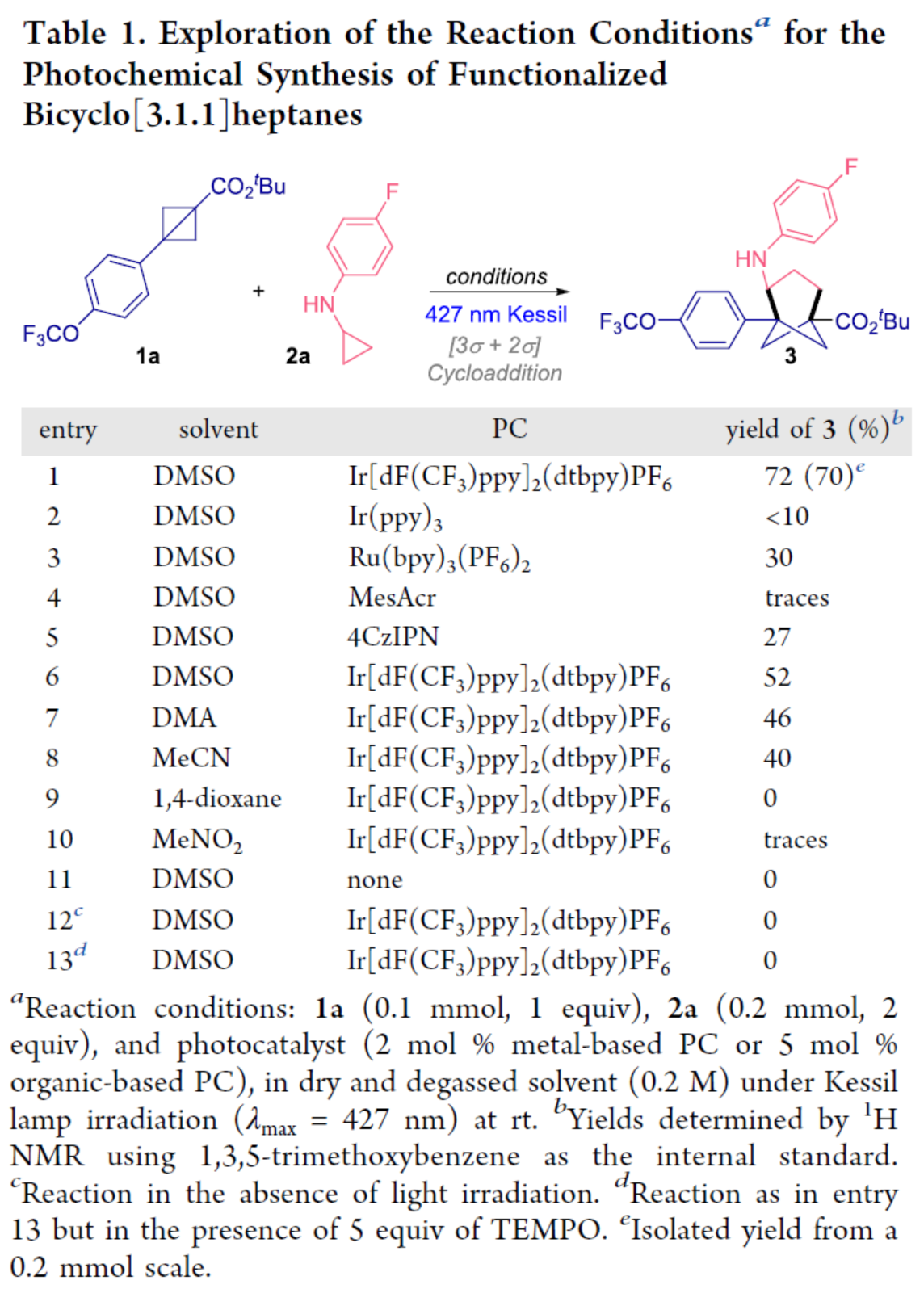
(圖片來源:J. Am. Chem. Soc.)
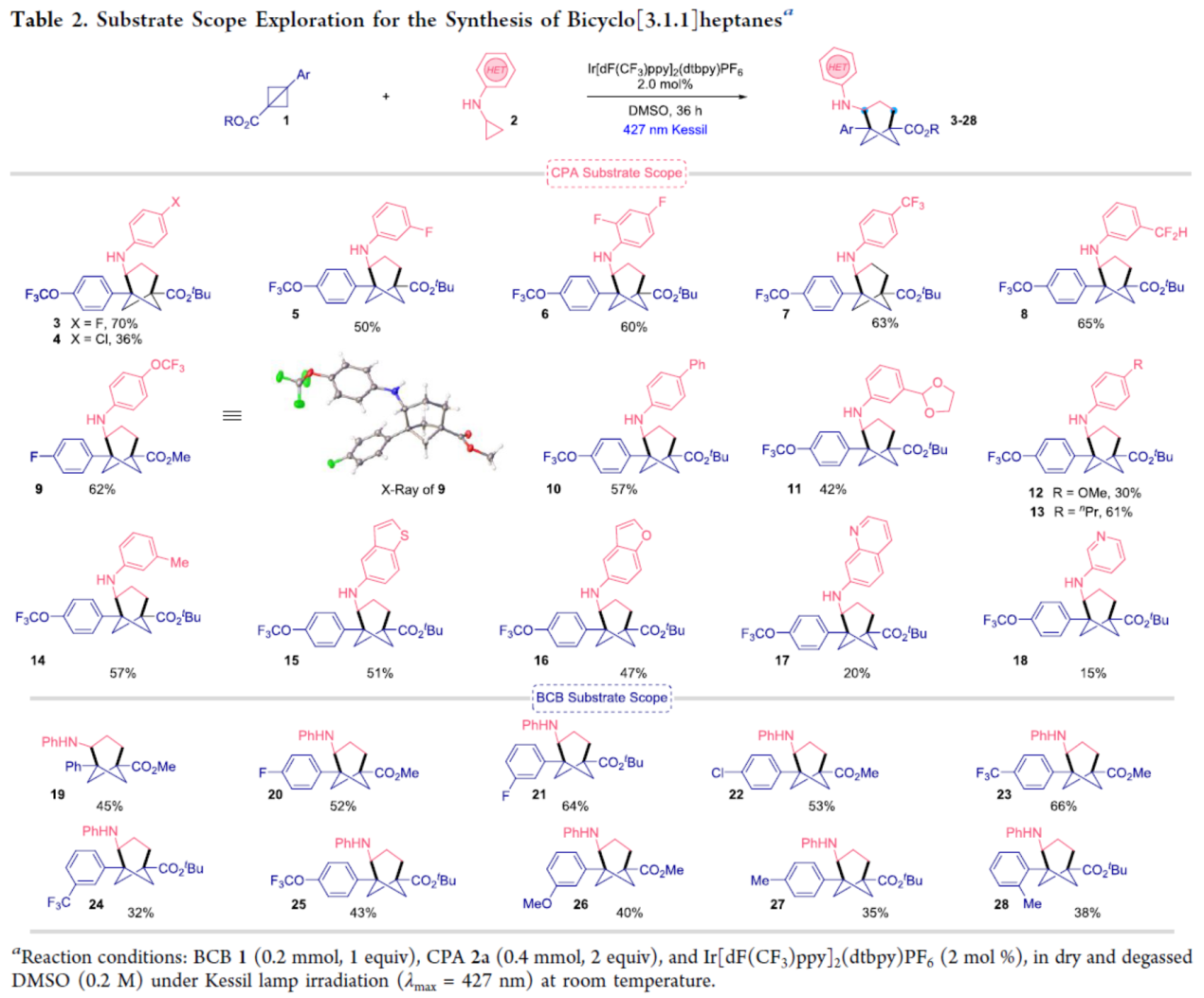
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Table 2)。首先,當底物1中含有不同電性取代的芳基時,均可順利反應,獲得相應的產物3-14,收率為30-70%。同時,當底物1中含有苯并噻吩和苯并呋喃基時,也與體系兼容,獲得相應的產物15-16,收率為47-51%。當底物1中含有喹啉和吡啶基時,反應性較差,獲得相應的產物17-18,收率為15-20%。其次,當底物2中含有不同電性取代的芳基時,也能夠順利反應,獲得相應的產物19-28,收率為32-66%。
(圖片來源:J. Am. Chem. Soc.)
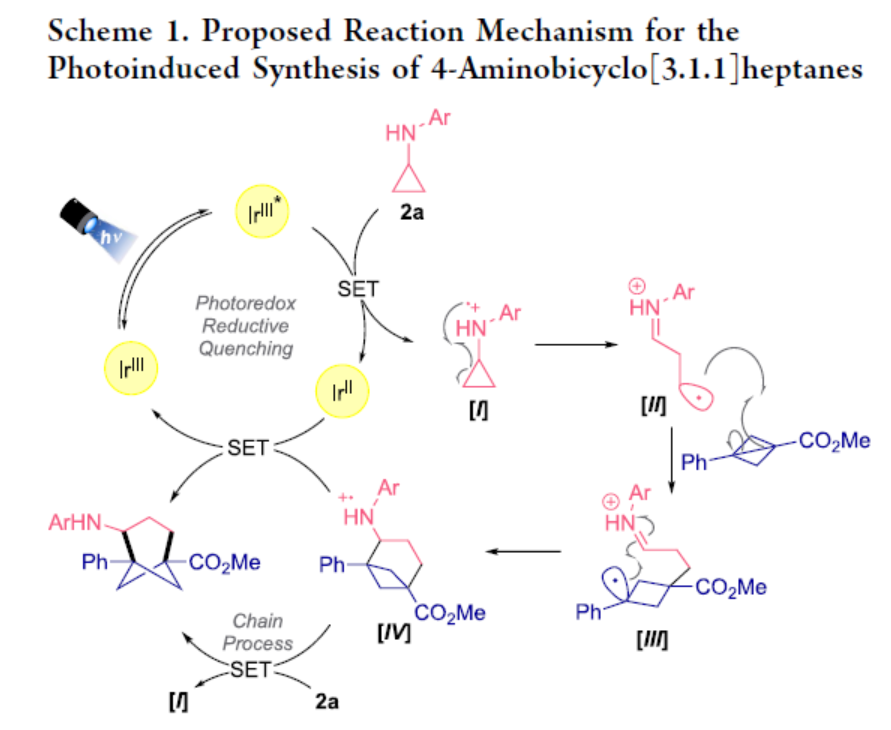
基于前期相關文獻的查閱,作者提出了一種可能的催化循環過程(Scheme 1)。首先,IrIII光催化劑通過紫外光照射進行光激發之后,可生成光激發態(IrIII*)。環丙基苯胺(2)的單電子轉移可誘導自由基陽離子配合物I的形成,然后通過β-斷裂開環生成雙離子自由基陽離子(II)。其次,將該反應性的中間體添加到BCB 1中,可生成另一種相對穩定的雙離子自由基陽離子,其中自由基位于二級芐基位(III)。隨后,配合物(III)經環化后可生成自由基陽離子IV。最后,在還原淬滅光還原循環中,IV可被還原生成IrII配合物。或者,在存在環丙基苯胺2a條件下IV進行還原,從而獲得目標產物。此外,通過對這兩種反應過程的光化學量子產率研究表明,鏈傳遞過程是一個更有可能的機理途徑,因為IV還原2a是一個焓驅動的步驟。
(圖片來源:J. Am. Chem. Soc.)
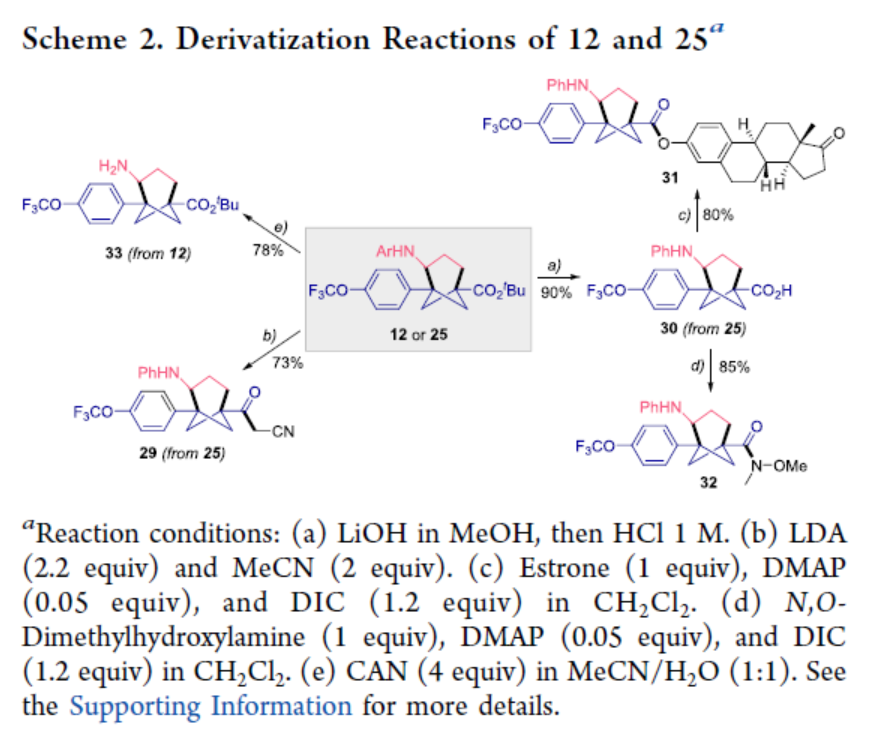
最后,作者對反應的實用性進行了研究(Scheme 2)。首先,25在LDA/MeCN條件下進行官能團化反應,可以73%的收率得到3-氧代丁烷腈29。該官能團單元含有α-亞甲基活性質子,為后期官能團化提供了進一步的機會。其次,25在LiOH/MeOH/HCl條件下進行水解,可以90%的收率得到相應的羧酸化合物30。30與雌酮在DMAP/DIC條件下進行偶聯,可以80%的收率得到化合物31。30與N,O-二甲基羥胺在DMAP/DIC條件下進行反應,可以85%的收率得到Weinreb酰胺化合物32,作為合成酮、醛或醇的羰基的前體。因此,游離羧酸30的使用為制備其它生物等排體化合物提供了進一步的機會。最后,12在CAN/MeCN/H2O條件下進行脫保護,可以78%的收率得到氨基化合物33,可作為有趣的氨基酸砌塊用于進一步衍生化。
(圖片來源:J. Am. Chem. Soc.)
總結
Gary A. Molander課題組開發了一種用于構建4-氨基雙環[3.1.1]庚烷的溫和、通用且高度實用性的方法。其中,以雙環[1.1.0]丁烷和環丙胺為底物,經光誘導的[3σ+2σ]環加成反應,合成了一系列官能團化的新型雙環[3.1.1]庚烷衍生物。通過后期的衍生化實驗,進一步證明了反應的實用性。總體來說,本文通過光化學[3σ+2σ]環化成反應,能夠獲得前所未有的由BCBs和CPAs構建的4-氨基雙環[3.1.1]庚烷。這些骨架可以作為藥物發現和相關領域中有用的間位二取代芳烴生物等排體。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn