



C18-和C19-二萜生物堿是一類(lèi)結(jié)構(gòu)復(fù)雜的天然產(chǎn)物,主要存在于烏頭屬和翠雀屬植物中。近年來(lái)隨著人們對(duì)這類(lèi)植物中具有藥物活性天然產(chǎn)物的研究逐漸深入,有超過(guò)700種C18-和C19-生物堿得到分離和鑒定(圖1)。這類(lèi)生物堿通常表現(xiàn)出廣泛的生物活性,包括抗炎、鎮(zhèn)痛、抗心律失常、降壓和心動(dòng)過(guò)緩等。大多數(shù)C18-和C19-二萜生物堿都具有共同的6/7/5/6/6/5元ABCDEF環(huán)骨架。其結(jié)構(gòu)區(qū)別和不同的生物活性主要取決于氮雜六元環(huán)上含氧基團(tuán)的數(shù)目和位置。
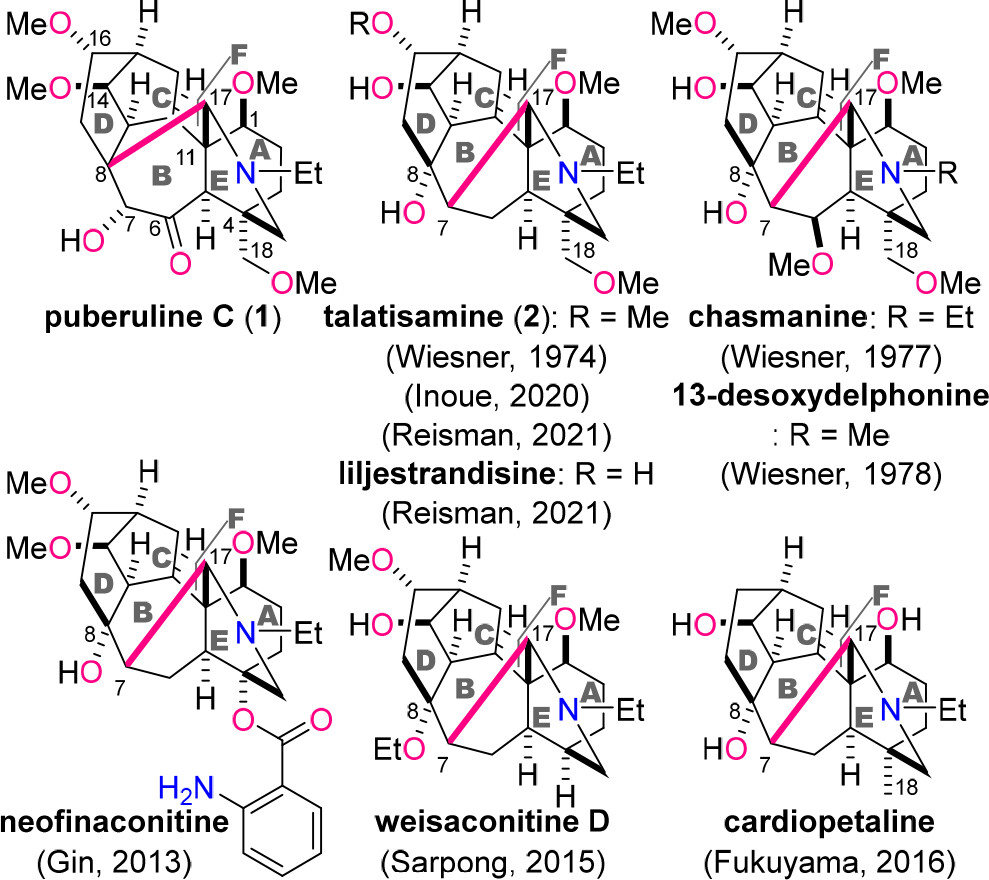
圖1. C18-和C19-二萜生物堿的結(jié)構(gòu)(圖片來(lái)源: J. Am. Chem. Soc.)
Puberuline C (1) 是最近被分離得到的一種罕見(jiàn)的C19-二萜生物堿,其C8-C17鍵構(gòu)成六元環(huán)而非五元環(huán),因此1具有6/7/5/6/6/6元ABCDEF環(huán)系統(tǒng)。1中除C4和C11外,還包括C8位的季碳,具有更為擁擠的分子骨架。1的氮雜六元環(huán)還被六個(gè)含氧官能團(tuán)(C1、C6、C7、C14、C16和C18)修飾。但由于天然來(lái)源供應(yīng)不足,該生物堿的詳細(xì)生物活性尚未闡明。
C18-和C19-二萜生物堿的重要生物活性及其異常復(fù)雜的結(jié)構(gòu)長(zhǎng)期以來(lái)一直激發(fā)著合成化學(xué)家的興趣,因此近年來(lái)已有眾多相關(guān)分子的合成被報(bào)道。然而此前的研究主要集中在Talatisamine (2)或具有類(lèi)似6/7/5/6/6/5 ABCDEF環(huán)的相關(guān)結(jié)構(gòu)上。作者于2020年利用環(huán)重組和氧化環(huán)化策略作為關(guān)鍵步驟,成功以33步完成了2的全合成。截至目前,仍然沒(méi)有合成Puberuline C (1)的相關(guān)報(bào)道。
作者首先對(duì)Puberuline C (1)進(jìn)行了詳細(xì)的逆合成分析(圖2)。該分子含有十二個(gè)立體中心和三個(gè)季碳中心,作者期望以叔氯化合物5為關(guān)鍵中間體,經(jīng)歷C11-Cl鍵斷裂產(chǎn)生C11橋頭自由基,進(jìn)而完成七元環(huán)B和六元環(huán)F的構(gòu)建并引入其中五個(gè)立體中心(C8、C9、C10、C11和C17)。隨后,化合物4的C16-二芐基縮醛和C14-酮的分子內(nèi)Mukaiyama羥醛反應(yīng)將在C13和C16處引入兩個(gè)三取代碳中心,形成3的D環(huán)。最后調(diào)整化合物3中BCD環(huán)C6、C7、C14和C16處的含氧取代基以完成1的全合成。
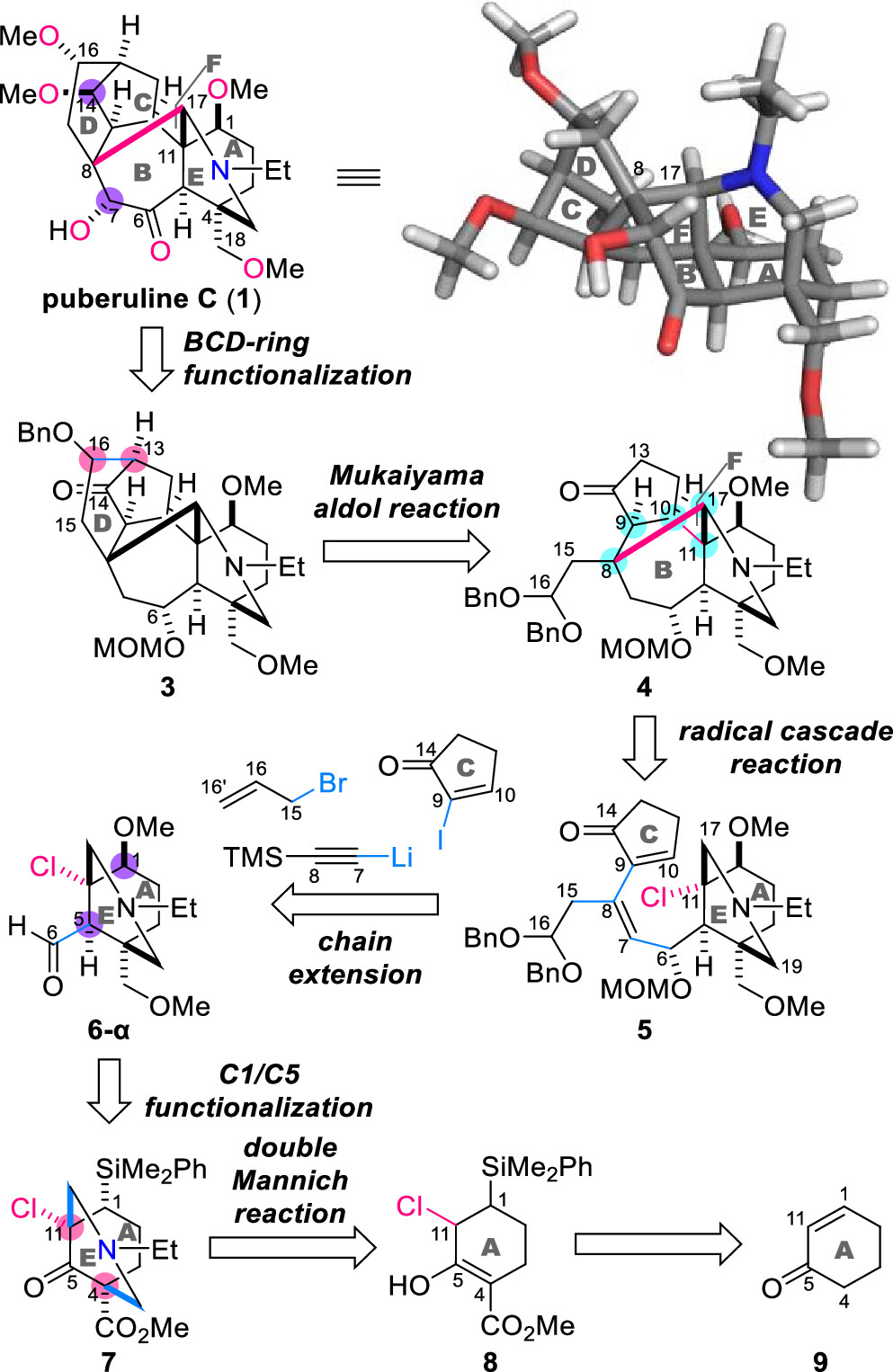
圖2. Puberuline C (1)的逆合成分析(圖片來(lái)源: J. Am. Chem. Soc.)
隨后,作者使用2-環(huán)己烯酮(9)為起始原料,由20步反應(yīng)成功完成了自由基串聯(lián)反應(yīng)底物5的合成(圖3)。具體步驟如下:首先使用LDA和氯甲酸甲酯與9發(fā)生酰基化得到化合物10,隨后在TMSCl存在下使用Me2PhSiLi和Et2Zn處理烯酮10,生成烯醇硅醚11。將得到的11與N-氯代糖精反應(yīng)以引入所需的C11-氯代物,生成烯醇形式產(chǎn)物8,其通過(guò)在大位阻C1-SiMe2Ph基團(tuán)的異面進(jìn)行雙Mannich反應(yīng),從而以C4/C11立體選擇性方式形成7的N-乙基哌啶環(huán)部分。使用HBF4·OEt2將7的苯基替換為12中的氟原子后,再進(jìn)行Fleming-Tamao氧化將其轉(zhuǎn)化為相應(yīng)的銨鹽,然后在AcOH中用AcOOH處理,得到醇13-α,同時(shí)保持C1的立體化學(xué)。將13-α在DBU存在下于甲苯中反應(yīng),通過(guò)逆羥醛/羥醛縮合過(guò)程完成立體化學(xué)反轉(zhuǎn),得到熱力學(xué)有利的醇13-β作為主要差向異構(gòu)體的混合物(13-β/13-α = 2.2:1),將13-β位阻較小的C1-羥基選擇性保護(hù)為TBS醚14。
中間體14的C5-酮由于相鄰的C11-叔氯和季碳中心C4而被空間效應(yīng)屏蔽,一般的親核試劑難以與其反應(yīng),因此可以在中性條件下使用空間位阻小、反應(yīng)性高且穩(wěn)定的Wittig試劑來(lái)延長(zhǎng)碳鏈。作者在130 °C下用氰基亞甲基(三甲基)膦處理14,分別以62%和34%的產(chǎn)率生成不飽和腈15-Z和15-E,同時(shí)不會(huì)影響C1-OTBS、C11-Cl和C4-甲氧羰基。隨后,15-Z 的C5 ═ C6雙鍵和C4-甲酯可被LiBH4同時(shí)還原,以88%的收率生成16 (16-β/16-α=1:1)。隨后,使用n-Bu4NF脫除16-β/16-α的TBS基團(tuán),并用MeI完成C1-和C18-羥基的雙甲基化生成17 (17-β/17-α=9.8:1)。17-β/17-α的C6位在THF/HMPA中被LDA去質(zhì)子化,并在-100 °C下使用反式-2-(苯基磺酰基)-3-苯基氧雜嗪進(jìn)行氧化,隨后加入Me2S和Na2CO3水溶液,能以67%的收率生成醛6-β。最后利用TsOH·H2O完成6-β上C5的立體化學(xué)完全差向異構(gòu)化,得到所需的熱力學(xué)有利產(chǎn)物6-α。最后,AE環(huán)片段6-α依次經(jīng)歷炔基化、Sonogashira偶聯(lián)、炔烴氫-錫化、Stille偶聯(lián)以及催化雙羥基化等步驟成功得到雙芐基縮醛5,從而完成后續(xù)自由基反應(yīng)底物的制備。值得注意的是,該合成路線也實(shí)現(xiàn)了用于后續(xù)Mukaiyama羥醛反應(yīng)的C16-縮醛結(jié)構(gòu)的引入。
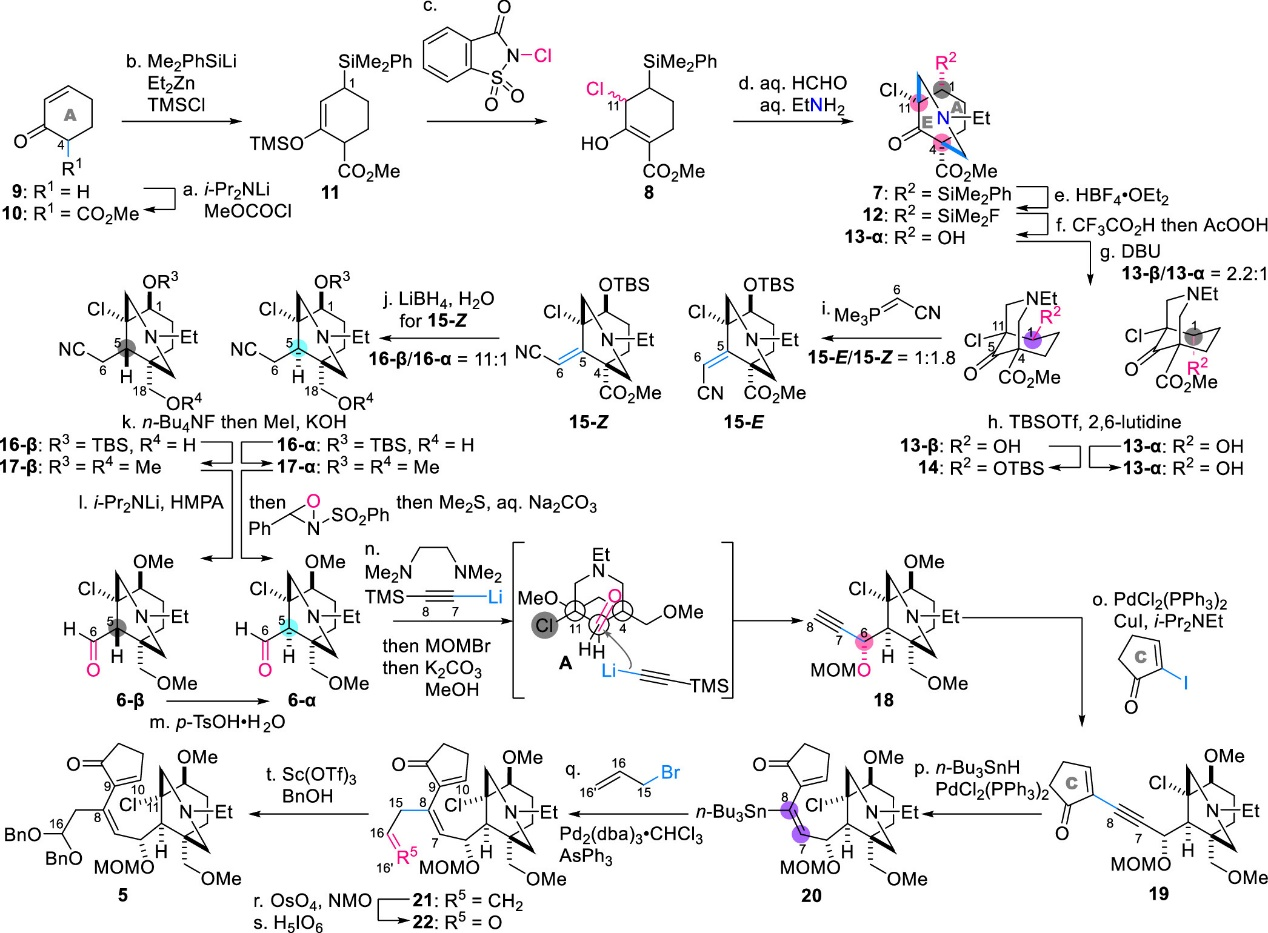
圖3. 自由基反應(yīng)底物5的合成(圖片來(lái)源: J. Am. Chem. Soc.)
底物5用于自由基串聯(lián)反應(yīng)必須首先誘導(dǎo)其C-Cl鍵發(fā)生均裂。然而,相對(duì)于烷基溴化物,烷基氯代物由于其反應(yīng)性低,很少用作天然產(chǎn)物合成中的自由基前體。但作者發(fā)現(xiàn),叔溴代物中間體表現(xiàn)出獨(dú)特的不穩(wěn)定性,即當(dāng)溴代中間體23在100 °C下用MOMCl和i-Pr2Net對(duì)羥基進(jìn)行保護(hù)時(shí),23的橋頭溴原子會(huì)完全發(fā)生氯溴交換得到化合物18(圖4)。
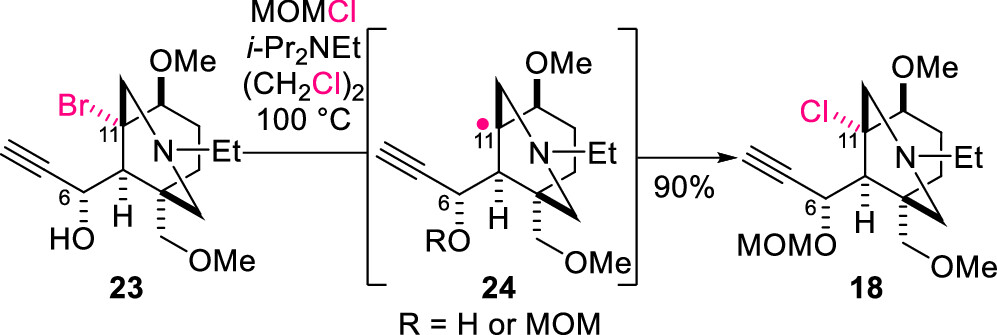
圖4. 中間體23脫溴氯化反應(yīng)(圖片來(lái)源: J. Am. Chem. Soc.)
隨后作者使用氯代底物5為自由基前體化合物,探索了自由基串聯(lián)環(huán)化的反應(yīng)條件(圖5)。作者使用微波反應(yīng)器作為加熱裝置以精確控制溫度,并使用1,3-雙三氟甲苯作為極性溶劑以增強(qiáng)微波能量的吸收。首先,在n-Bu3SnH和自由基引發(fā)劑VAm-110的存在下,將5加熱至180 °C,僅能以1.9%的收率獲得目標(biāo)環(huán)化產(chǎn)物4。反應(yīng)后大量回收的底物5表明即使在高溫下,C-Cl鍵均裂的效率也很低。隨后作者嘗試在160 °C下將Ph3SnH與VAm-110結(jié)合,產(chǎn)率提升至22%。進(jìn)一步使用更富電子的(c-Hex)3SnH時(shí),產(chǎn)率得到了更大提升。為了避免底物分解和相關(guān)副反應(yīng),作者降低了反應(yīng)溫度以及還原劑和自由基引發(fā)劑的當(dāng)量。最終,確定了在110 °C下使用3當(dāng)量(c-Hex)3SnH和1當(dāng)量V-40為最佳反應(yīng)條件。值得注意的是,該自由基串聯(lián)反應(yīng)一步即構(gòu)建了五個(gè)相鄰的立體中心(C8、C9、C10、C11和C17),包括季碳C8和C11,顯著增加了分子復(fù)雜性。
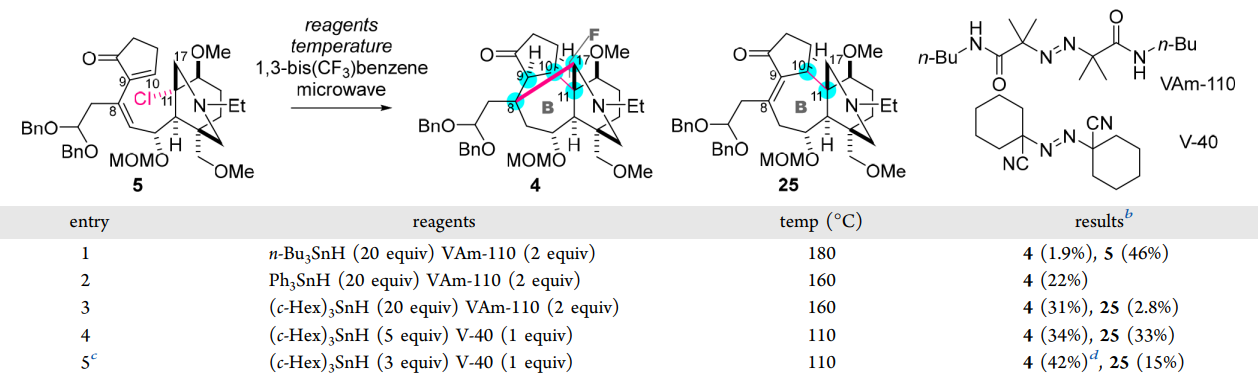
圖5. 自由基串聯(lián)反應(yīng)條件優(yōu)化(圖片來(lái)源: J. Am. Chem. Soc.)
作者同時(shí)對(duì)該自由基串聯(lián)過(guò)程進(jìn)行了機(jī)理討論(圖6)。該反應(yīng)包括五個(gè)基本歷程:(1) 通過(guò)C-Cl鍵均裂形成C11自由基;(2) 在C10和C11處形成七元環(huán)B;(3) 從C17到C7的1, 5-氫遷移;(4) 在C17和C8處形成六元環(huán)F;(5) C9處自由基與(c-Hex)3SnH間的HAT過(guò)程。由于自由基和反應(yīng)位點(diǎn)之間的良好軌道相互作用,該五步反應(yīng)具有優(yōu)異的化學(xué)選擇性,同時(shí)立體選擇性可由自由基中間體的空間結(jié)構(gòu)決定。
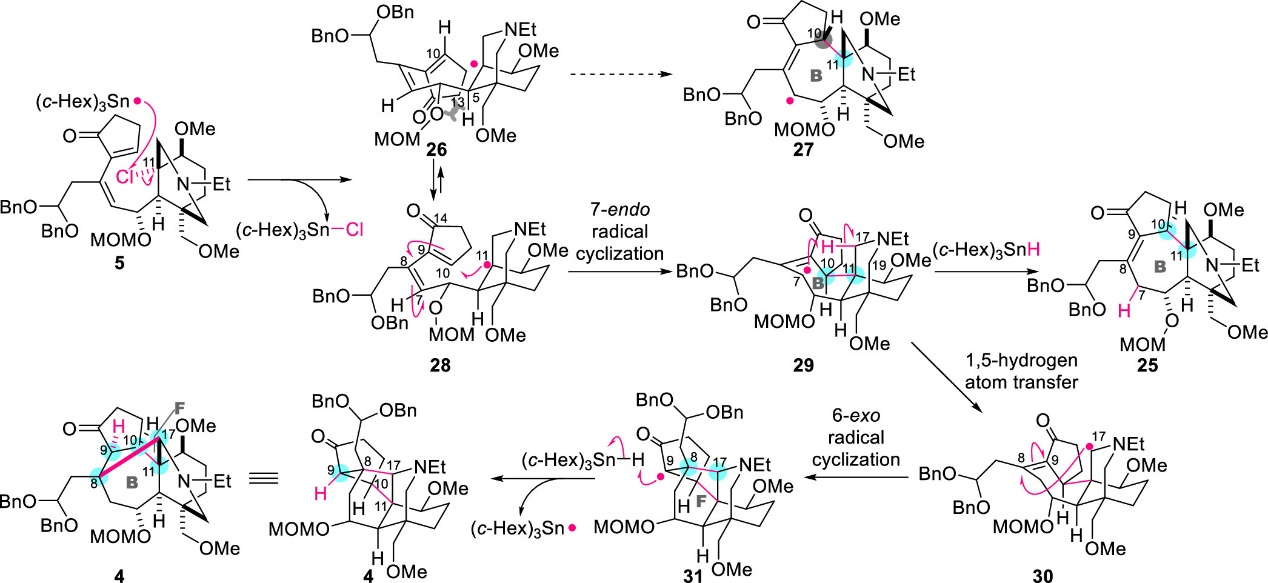
圖6. 自由基串聯(lián)反應(yīng)的機(jī)理推測(cè)(圖片來(lái)源: J. Am. Chem. Soc.)
含ABCEF環(huán)的中間體4通過(guò)分子內(nèi)Mukaiyama羥醛反應(yīng)即可構(gòu)建最后剩余的六元環(huán)D (圖7)。首先將4的C14-酮羰基通過(guò)TBSOTf和Et3N轉(zhuǎn)化為相應(yīng)的TBS烯醇醚34。然而,在-20 °C下用SnCl4處理34,僅以7.1%的產(chǎn)率得到縮合產(chǎn)物3-β,主要副產(chǎn)物為醛35。作者利用DFT計(jì)算證實(shí)了底物與產(chǎn)物相比具有更高的熱穩(wěn)定性,同時(shí)32的C16-縮醛位置比C13更接近C14-O。因此,C14-氧原子對(duì)C16的親核進(jìn)攻會(huì)與C13-C16成鍵過(guò)程競(jìng)爭(zhēng)。這一結(jié)果揭示了D環(huán)的形成在熱力學(xué)和動(dòng)力學(xué)上都非常具有挑戰(zhàn)性(圖8)。
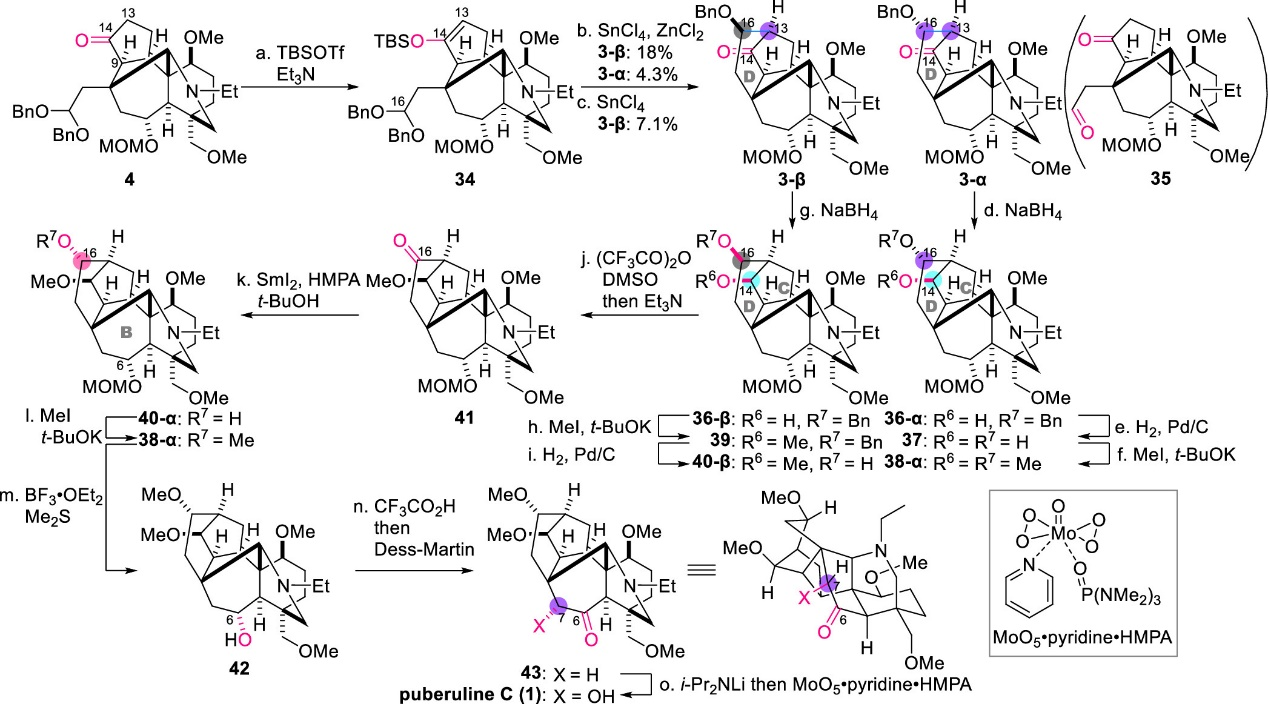
圖7. Puberuline C (1)的最終全合成(圖片來(lái)源: J. Am. Chem. Soc.)

圖8. 32和33的結(jié)構(gòu)與吉布斯自由能(圖片來(lái)源: J. Am. Chem. Soc.)
最后作者通過(guò)對(duì)該Mukaiyama羥醛反應(yīng)中路易斯酸、溶劑和反應(yīng)溫度進(jìn)行了廣泛篩選,發(fā)現(xiàn)添加等量的SnCl4和ZnCl2,同時(shí)加入4 A分子篩,能分別以18%和4.3%的產(chǎn)率得到3-β和差向異構(gòu)體3-α。該反應(yīng)成功連接了長(zhǎng)空間距離的C13和C16,并建立了正確的C13-立體中心。在構(gòu)建了整個(gè)ABCDEF六環(huán)結(jié)構(gòu)后,作者順利完成了后續(xù)含氧官能團(tuán)的轉(zhuǎn)化,包括C14-酮的立體選擇性還原、Pd/C催化芐基醚氫解以及二醇37的雙甲基化,得到化合物38-α。最后,利用BF3·OEt2和Me2S脫除MOM保護(hù)基并用Dess-Martin試劑將其氧化為酮43,再進(jìn)行C7-H鍵的氧化羥基化即可獲得最終產(chǎn)物Puberuline C (1),其譜圖數(shù)據(jù)與文獻(xiàn)一致。
總結(jié)
Masayuki Inoue教授課題組首次完成了C19-二萜生物堿Puberuline C (1)的全合成。該合成路線中的關(guān)鍵步驟在于微波促進(jìn)的自由基串聯(lián)反應(yīng)和SnCl4/ZnCl2 催化Mukaiyama羥醛反應(yīng),其中自由基反應(yīng)的前體化合物5可從2-環(huán)己烯酮經(jīng)歷20步獲得。此外,這種全新的合成策略將極大地促進(jìn)其它C18-和C19-二萜生物堿的合成研究,并為相關(guān)化合物的藥理學(xué)研究提供支撐。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn