

細菌視紫紅質Bacteriorhodopsin(bR)是嗜鹽桿菌細胞膜上充當能量轉換開關的跨膜蛋白,通過其質子泵功能可實現從光能到化學能的轉換。自1975年首次獲得晶體結構以來,隨著技術的發展,bR的結構解析越來越精細。但由于測量方法的不同,bR的結構,特別是其在非螺旋區的結構,不同方法存在很大不同。此外,bR的細胞質側和細胞外側表面結構動力學對光循環中質子的釋放和攝取至關重要。傳統的生物物理學手段,包括電子和X射線晶體學,對剛性的膜蛋白結構比較敏感,對于超快的結構過程,這兩者都缺乏足夠的時間分辨率。此外,實驗上很難實現在合理的時間和空間分辨率下直接探測構象的快速動態轉換。二維紅外光譜方法由于具有亞皮秒的時間分辨率和化學鍵結構分辨率,可以揭示分子的動態結構分布及其動力學。因此,發展基于二維紅外光譜的新方法有望解決bR結構領域的這些挑戰性問題。
在國家自然科學基金委的大力支持下,化學所分子反應動力學實驗室王建平課題組與華東師范大學大學的合作者通過生物合成的方法對bR上的賴氨酸進行了13C,15N同位素標記,創建了一個位點特異性的酰胺-I波段振動特征(骨架羰基的振動)網絡來識別標記殘基對酰胺-I帶的激子能帶結構的頻率貢獻,指認了紅外差譜中酰胺-I帶高頻1693 cm–1的吸收為來自賴氨酸K159的骨架羰基,并通過局部結構和動力學的分析,確認了K159位于一段溶劑暴露程度較高的轉角結構上,該指認得到了二維核磁的支持,并且與天然紫膜中得到的電子衍射局部結構一致。從這項工作中得出的K159的局部結構特性可以用來很好地認識電子晶體學、X射線晶體學以及核磁共振所觀察到的結構差異。同時,該研究強調了轉角的存在有助于穩定bR中E-F螺旋之間的環帶結構,從而協助E161在光循環的質子攝取過程中發揮重要作用。該研究提出了一種利用同位素標記的探針在天然狀態下檢測蛋白質局部結構的研究方法,為跨膜螺旋蛋白結構與功能的研究提供了新思路。相關研究成果近期發表在J. Am. Chem. Soc. (2022, 144, 22083–22092)上,第一作者為博士研究生胡溶,通訊作者為化學所王建平研究員和華東師范大學趙欣教授。
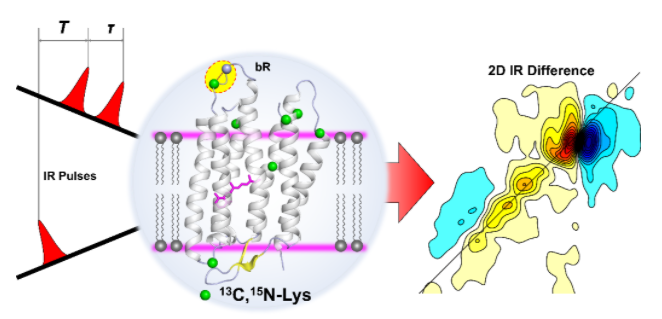
圖. 超快二維紅外光譜探測同位素標記的bR的位點特異性結構和動力學
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn