



CRISPR/Cas9是源自細菌獲得性免疫系統(tǒng)的新一代基因編輯技術(shù),在化學生物學、生物醫(yī)學及基因治療中具有潛在應用前景。CRISPR/Cas9技術(shù)使用引導RNA(single-guide RNA,sgRNA)識別靶標基因,并招募Cas9核酸酶對基因組進行切割、編輯等操作。然而,由于sgRNA識別基因組存在非特異性結(jié)合作用,現(xiàn)有CRISPR/Cas9技術(shù)應用于基因編輯時存在一定的脫靶效應,且缺乏對疾病細胞的選擇性,限制了其在化學生物學領(lǐng)域的應用。
在科技部、基金委和中國科學院的支持下,化學所活體分析化學院重點實驗室汪銘課題組圍繞可控及細胞選擇性CRISPR/Cas9技術(shù)開展研究,發(fā)展了酶誘導的CRISPR系統(tǒng)(enzyme-inducible CRISPR, eiCRISPR),實現(xiàn)了細胞選擇性基因編輯。eiCRISPR由三部分組成,包括Cas9核酸酶、自封閉失活的引導RNA(bsgRNA)以及化學修飾的脫氧核酶DNAzyme,其中DNAzyme可特異性降解bsgRNA的自封閉區(qū)進而激活CRISPR系統(tǒng)。為了實現(xiàn)可控及細胞選擇性基因編輯,他們通過設(shè)計優(yōu)化DNAzyme磷酸骨架的化學修飾,抑制了其降解bsgRNA自封閉區(qū)的能力。而外源性光信號、內(nèi)源性化學微環(huán)境(如細胞內(nèi)活性氧、NQO1酶)等可選擇性觸發(fā)化學修飾DNAzyme的脫籠反應,激活DNAzyme并降解bsgRNA的自封閉區(qū),進而激活eiCRISPR系統(tǒng)。進一步,研究人員利用課題組發(fā)展的可降解脂質(zhì)納米顆粒(LNP)遞送系統(tǒng),實現(xiàn)了細胞及活體層次eiCRISPR的高效遞送和在體激活。研究發(fā)現(xiàn),eiCRISPR可在腫瘤組織中選擇性激活,并編輯、敲低人乳頭瘤病毒18(HPV18)E6基因,從而用于潛在的腫瘤治療。該方法為解決CRISPR/Cas9技術(shù)中面臨的基因編輯脫靶效應以及缺乏疾病靶向性等挑戰(zhàn)提供了新策略。該研究工作近期發(fā)表于J. Am. Chem. Soc. (2022, 144, 22272-22280),論文第一作者為博士研究生蔡瑋琦,通訊作者為汪銘研究員。
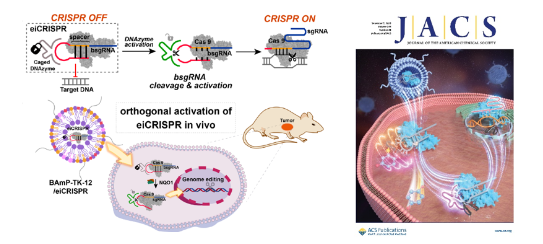
圖. 酶促反應激活的細胞選擇性CRISPR/Cas9基因編輯系統(tǒng)
參考資料:http://www.iccas.ac.cn/xwzx/kyjz/202212/t20221226_6589621.html
聲明:化學加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn