- 首頁
- 資訊
Angew:上海交大夏小霞課題組在活細胞內限域生物合成方面取得新進展
來源:上海交通大學 2022-12-08
導讀:近日,上海交通大學生命科學技術學院、微生物代謝國家重點實驗室夏小霞課題組在模式原核生物細胞內成功實現了量子點的區室化限域合成,相關研究成果“Spatially Directed Biosynthesis of Quantum Dots via Spidroin Templating in Escherichia coli”作為“熱點論文”發表在《德國應用化學》期刊。上海交通大學碩士生陳夢婷、博士后胡春飛為共同第一作者,錢志剛副研究員和夏小霞教授為共同通訊作者。
生物合成量子點具有反應條件溫和、綠色可持續、產物穩定性好等優勢,因而是一種極具潛力的合成策略。目前能合成量子點的宿主多為細菌、真菌等微生物,由于參與合成的模板、離子等前體物質在宿主內呈分散狀態存在,而且合成機理尚不清晰,因此難以實現亞細胞水平的限域合成,造成對宿主細胞毒性大、合成效率低下等不足。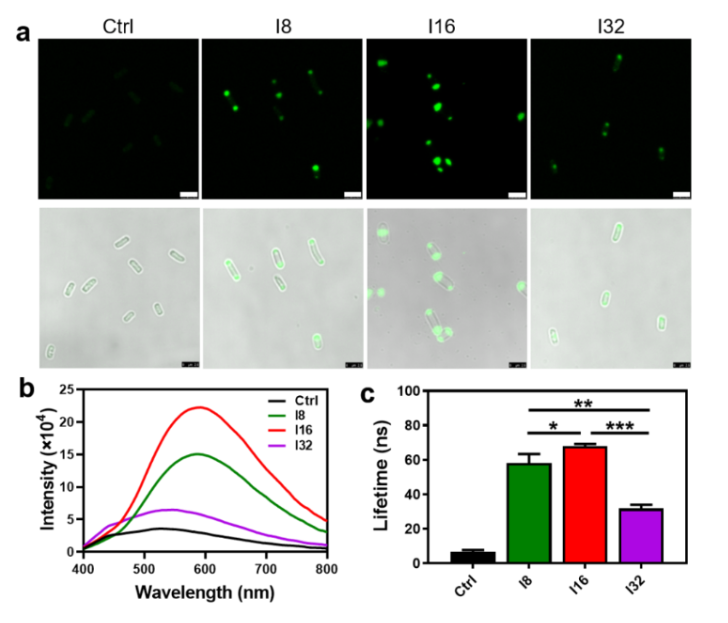
圖1 量子點在模式原核生物大腸桿菌細胞內的限域合成夏小霞課題組在前期研究中發現,異源表達的蜘蛛絲等結構蛋白通過液-液相分離在大腸桿菌胞內形成“液滴樣”的無膜區室(Nat. Chem. Biol. 2020, 16: 1143-1148),進而推測蛋白質有序凝聚的特性可能有利于量子點的成核、生長及成熟。以CdSexS1-x為模式量子點,研究表明蛛絲蛋白能支持量子點在大腸桿菌細胞兩極的生物合成(以“點亮”細胞的熒光進行表征),而且特定的β-折疊形成能力對于蛛絲蛋白發揮模板作用極為關鍵。進一步的機理研究表明,轉運至細胞內的前體鎘離子可與蛛絲蛋白結合,誘導蛛絲蛋白從無規卷曲向β-折疊二級結構的轉變,進而招募含硫還原劑并通過氧化還原反應在區室內合成量子點。這不僅巧妙地“隔離”量子點合成過程減少了對宿主細胞的毒性,而且顯著提升了目標量子點的合成效率和熒光壽命,體現了活細胞內限域合成的獨特優勢。
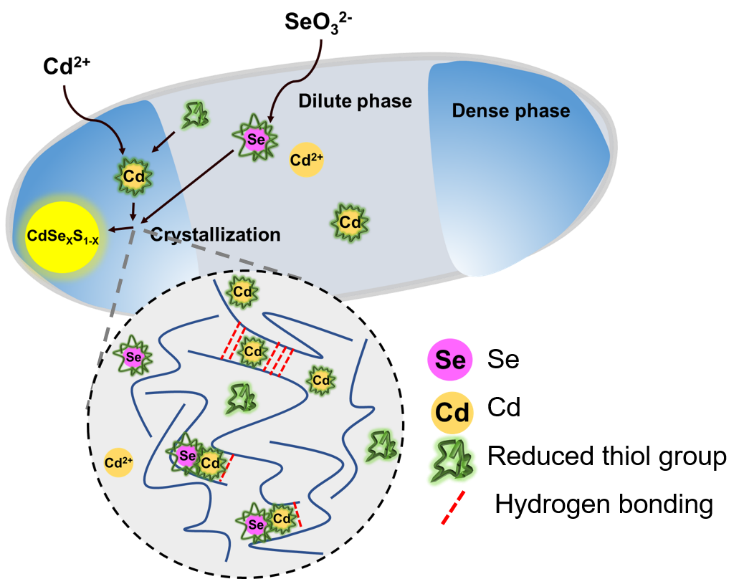
該論文成果成功建立了在活細胞內通過區室化的蛋白質模板限域合成量子點的方法,不僅為量子點的生物合成提供了一種“限域合成”的新視角,而且可為亞細胞原位成像、生物修復、有機-無機復合催化等領域的應用提供機遇。該研究獲得科技部國家重點研發計劃(2021YFA0909502)和國家自然科學基金(32071414)等研究項目的資助。參考資料:https://news.sjtu.edu.cn/jdzh/20221202/177246.html
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn



