

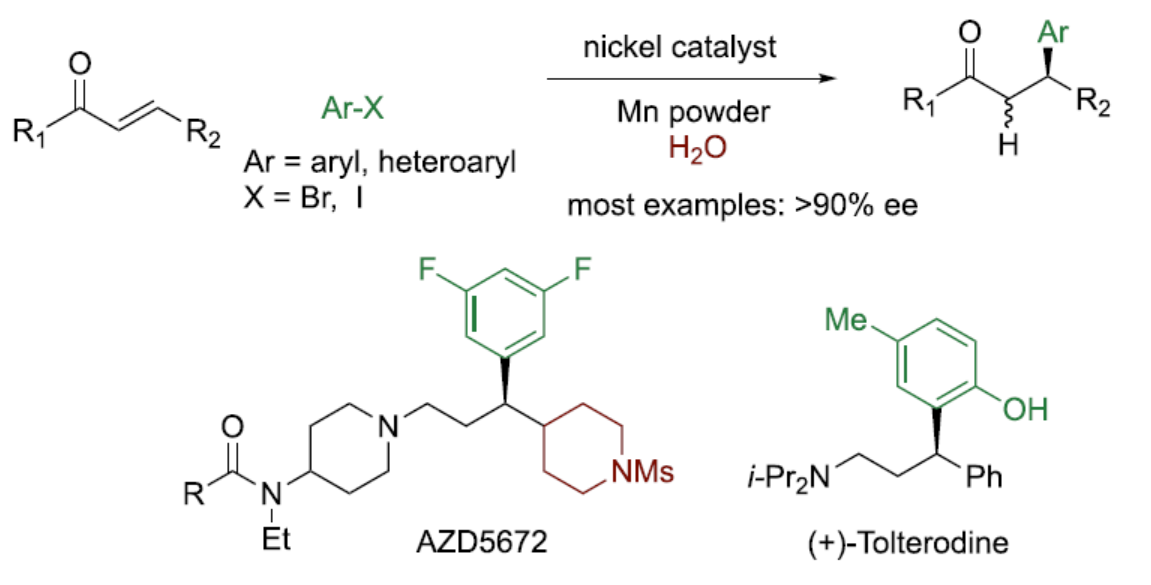
(圖片來源:J. Am. Chem. Soc.)
金屬催化Michael受體的不對稱共軛芳基化是構建C-C鍵的一類重要反應,并廣泛用于天然產物和藥物的全合成。在過去,手性銅催化劑主要用于芳基金屬試劑的不對稱共軛加成反應,如Li、Mg、Al、Zn等(Figure 1a)。然而,對于銅催化芳基非金屬試劑的立體選擇性共軛加成,特別是空氣穩定的芳基硼,卻較少有相關的研究。相比之下,過渡金屬Rh-和Pd-催化烯酮與有機硼試劑的共軛加成,已取得一定的進展(Figure 1b)。對于立體控制和底物多樣性而言,銠催化Hayashi-Miyaura反應已成為不對稱金屬催化領域中最先進的技術之一。同時,芳基鹵是一種常見的親電試劑,可用于多種有機反應中。2013年,Weix課題組首次報道了鎳催化芳基鹵與烯酮的還原加成反應,涉及η3-1-硅氧基烯丙基鎳配合物的形成以及隨后與芳基鹵進行偶聯反應(而不是芳基鎳配合物的基元插入)的過程。然而,對于分子間還原芳基化反應仍具有挑戰。近日,北京大學深圳研究生院周建榮課題組報道了一種鎳催化烯酮與芳基和雜芳基鹵化物的對映選擇性共軛芳基化和雜芳基化反應(Figure 1c)。其中,有機金屬試劑(M = Mn或Zn)不直接參與C-C鍵的形成。
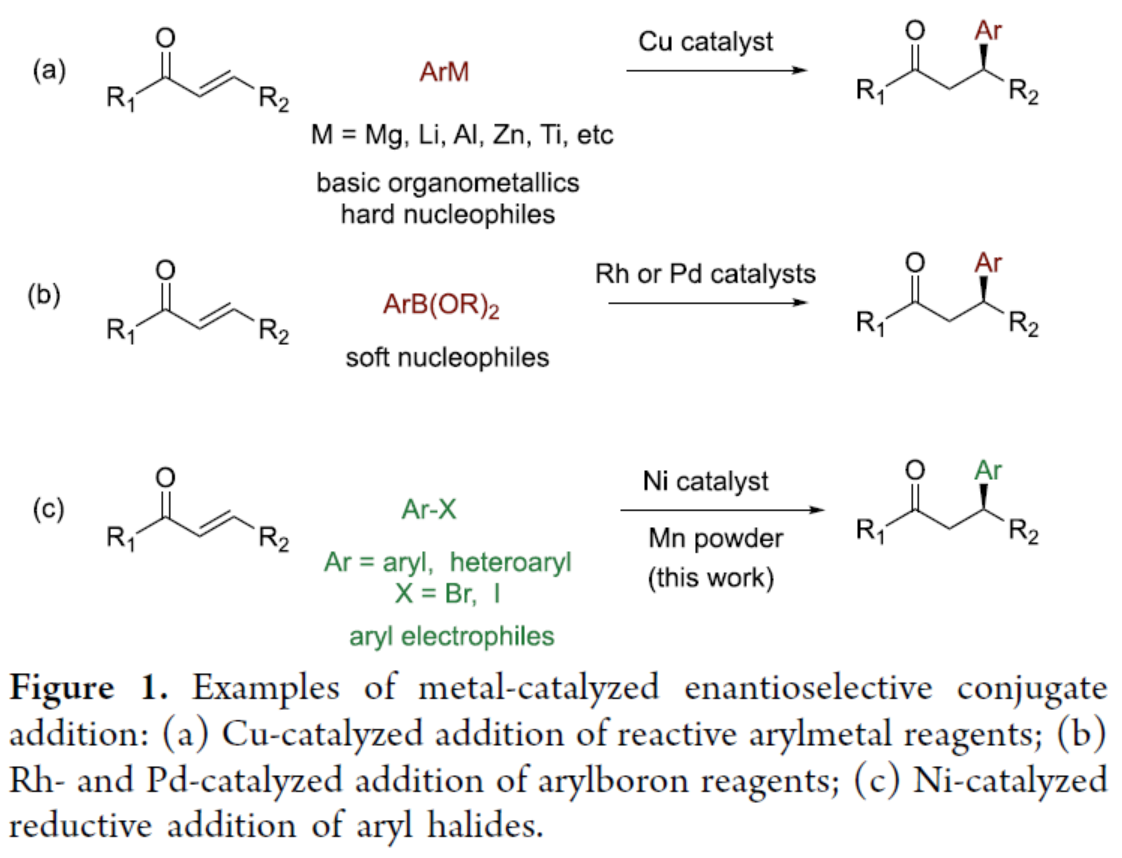
(圖片來源:J. Am. Chem. Soc.)
首先,作者以(E)-查爾酮1a與4-溴苯甲醚2a作為模型底物,進行了相關反應條件的篩選(Table 1)。當以NiBr2(DME)作為催化劑,L1作為配體,Mn作為還原劑,H2O作為添加劑,在DMSO/DMF的混合溶劑中室溫反應24 h,可以86%的收率得到產物3a,ee為92%。
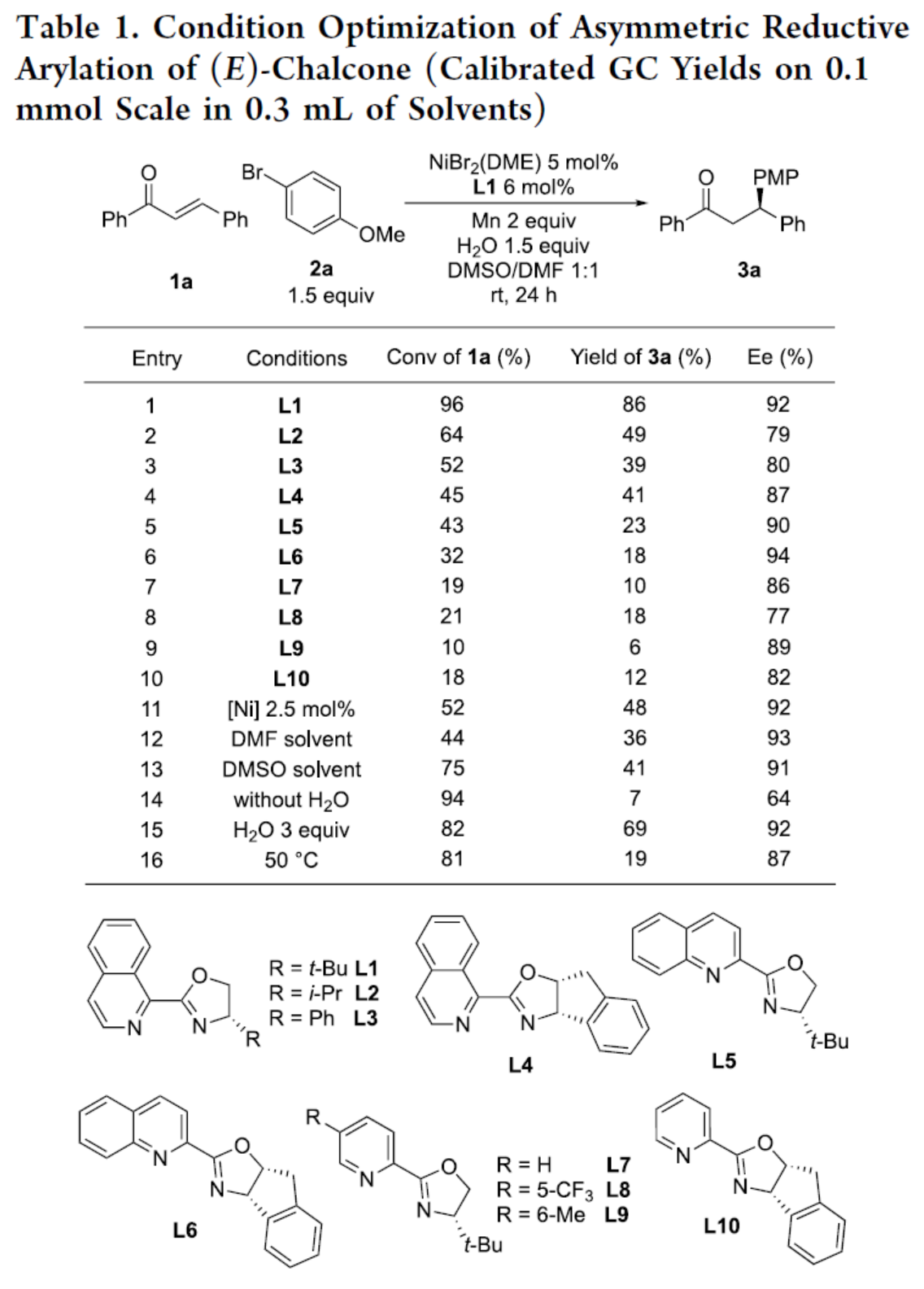
(圖片來源:J. Am. Chem. Soc.)
在獲得上述最佳反應條件后,作者對芳基鹵的底物范圍進行了擴展(Scheme 1)。首先,一系列不同取代的芳基溴以及雜芳基溴,均可與1b順利反應,獲得相應的產物3b-3ai,收率為61-98%,ee為67-96%。其次,當芳基碘的對位含有不同電性的基團時,也能夠順利反應,獲得相應的產物3a、3b、3e、3h、3j、3l和3o,收率為71-94%,ee為87-92%。然而,當芳基碘的鄰位含有異丙基時,僅獲得26%收率的產物3r,ee為70%。值得注意的是,該反應具有出色的官能團兼容性。
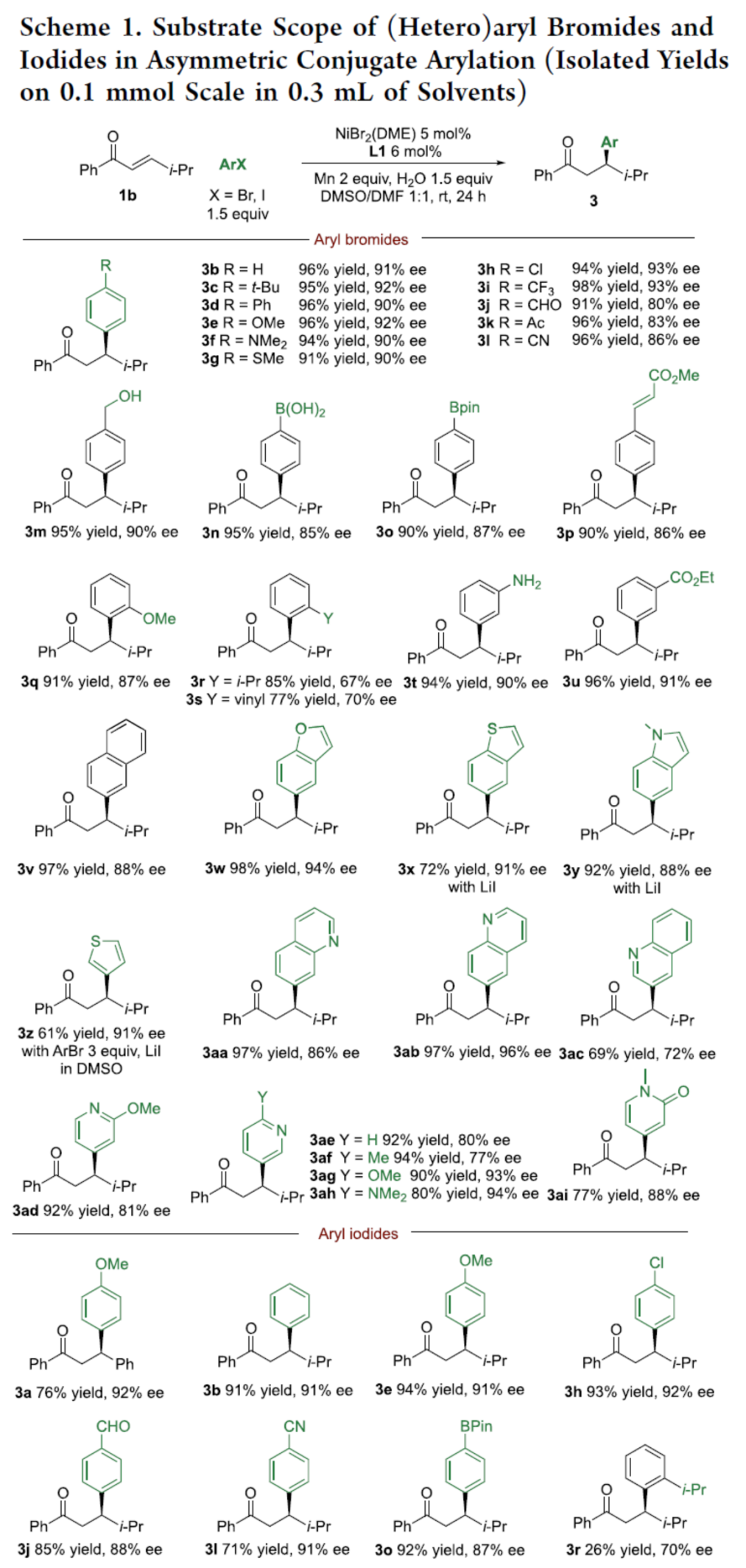
(圖片來源:J. Am. Chem. Soc.)
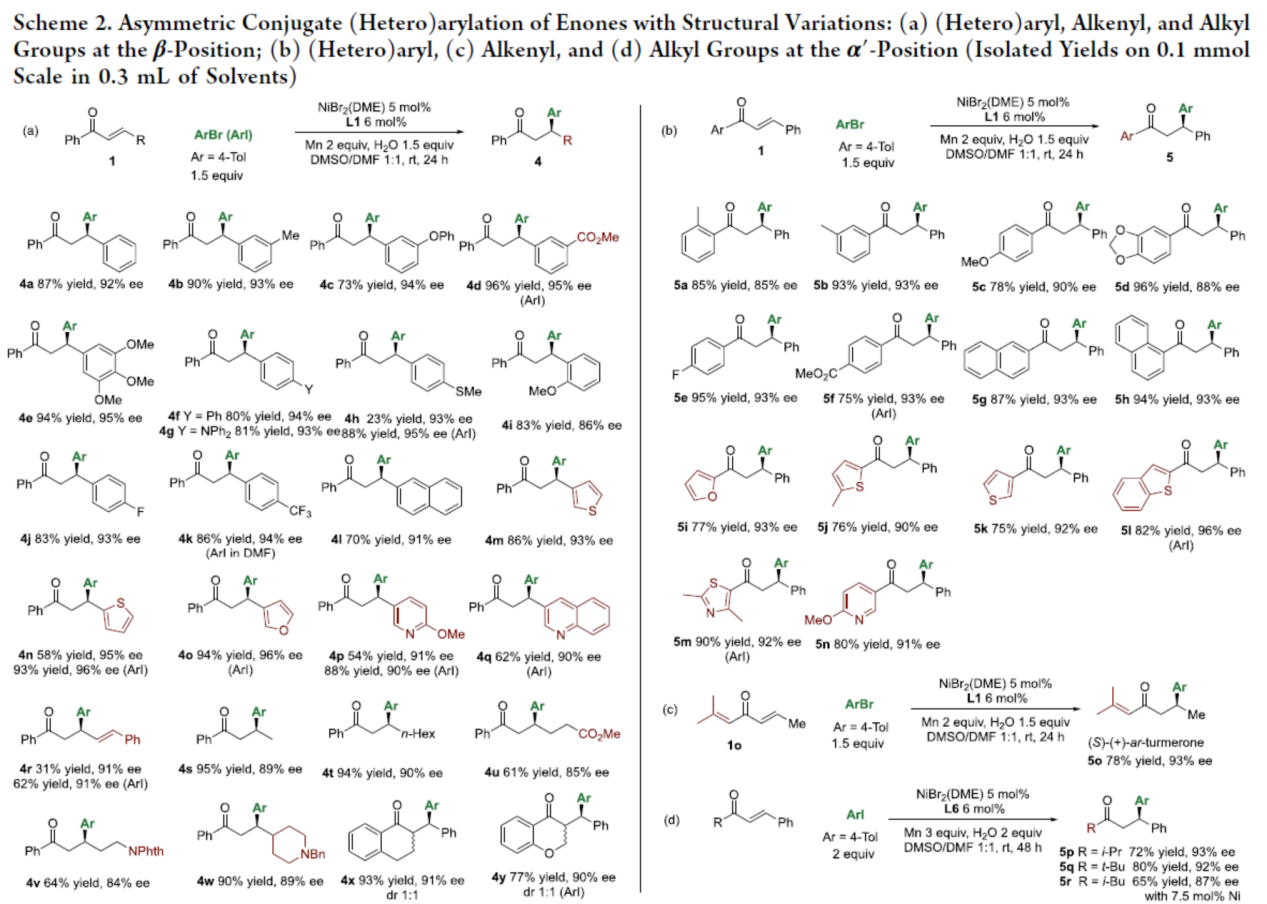
緊接著,作者對烯酮的底物范圍進行了擴展(Scheme 2)。首先,當底物1中的R為一系列不同電性取代的芳基、雜芳基、烷基、環烷基時,均可順利與芳基碘或芳基溴反應,獲得相應的產物4a-4w,收率為61-96%,ee為84-96%。2-苯亞甲基-1-四氫萘酮以及氧代衍生物,也是合適的底物,可獲得相應的產物4x和4y,收率為77-93%,ee為90-91%,dr為1:1(Scheme 2a)。其次,當底物1中的Ar為具有不同電性取代的芳基、萘基、雜芳基時,均可與芳基溴順利反應,獲得相應的產物5a-5n,收率為75-96%,ee為85-96%(Scheme 2b)。此外,以1o為底物,可合成(S)-(+)-ar-芳姜黃酮產物5o,收率為78%,ee為93%(Scheme 2c)。值得注意的是,將配體從L1改為L6時,一系列烯酮可與4-碘甲苯反應,獲得相應的產物5p-5r,收率為65-80%,ee為87-93%(Scheme 2d)。
(圖片來源:J. Am. Chem. Soc.)
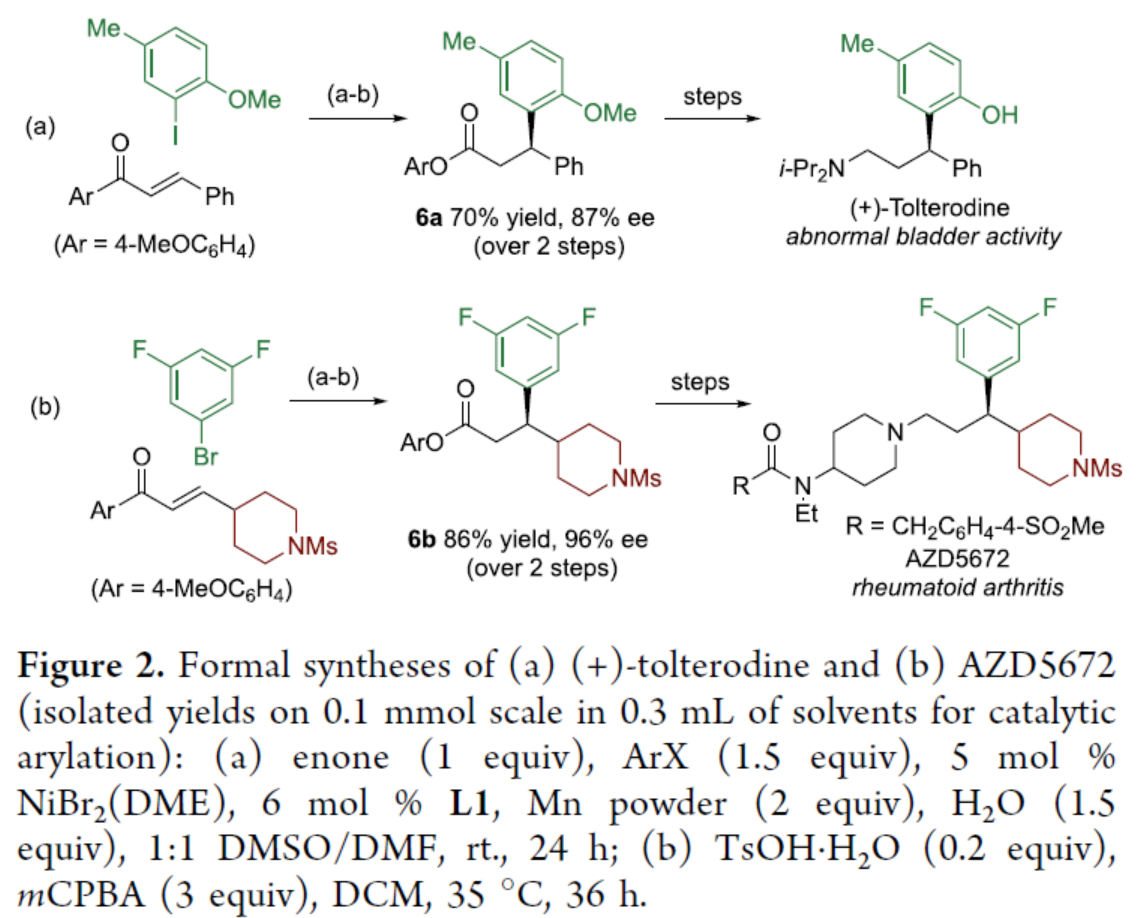
隨后,作者對反應的實用性進行了研究(Figure 2)。4'-甲氧基查耳酮與2-碘-4-甲基苯甲醚經芳基化以及Baeyer-Villiger氧化后,可以兩步70%的總收率得到產物6a,ee為87%,6a是合成(+)-托特羅定的前體。類似地,通過上述兩步反應,可以86%的收率得到產物6b,ee為96%,6b是合成治療類風濕性關節炎的候選藥物AZD5672的關鍵前體。
(圖片來源:J. Am. Chem. Soc.)
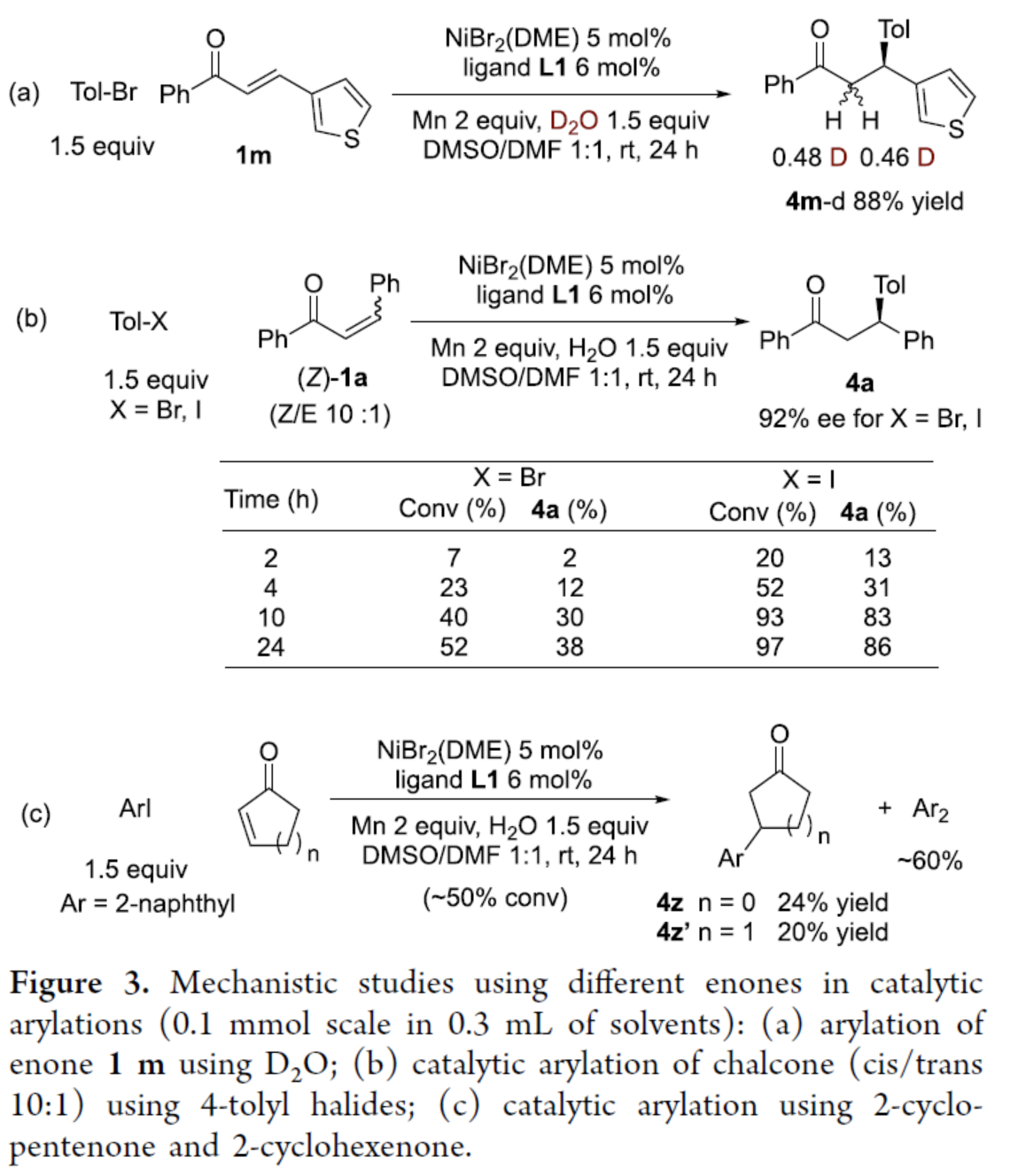
為了進一步了解反應的機理,作者進行了相關的實驗研究(Figure 3)。首先,氘代實驗表明,在1,4-加成后,O-鍵合的烯醇鎳發生了非立體選擇性質子化,生成的氫氧鎳(I)配合物可直接還原或將其轉化為溴化配合物再進行還原(Figure 3a)。其次,動力學研究表明,4-碘甲苯的反應比溴化物快得多。同時,原位形成的MnX2催化(Z)-1a的緩慢Z/E異構化形成低濃度的(E)-1a,(E)-1a是催化芳基化的反應底物(Figure 3b)。此外,環烯酮的催化芳基化導致烯酮的轉化率為50%,外消旋產物4z和4z′的收率很低,且存在大量的雙芳基化副產物(Figure 3c)
(圖片來源:J. Am. Chem. Soc.)
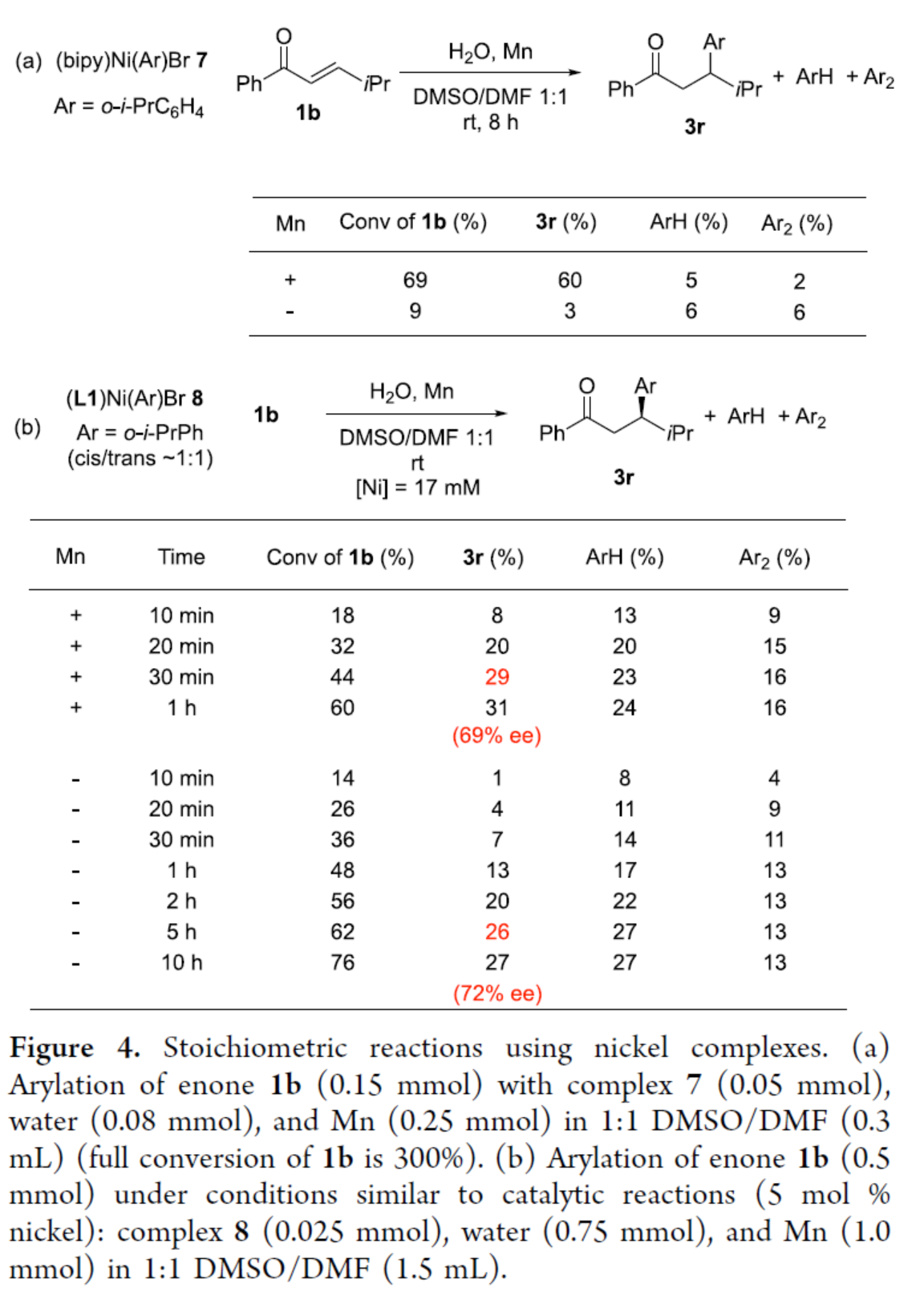
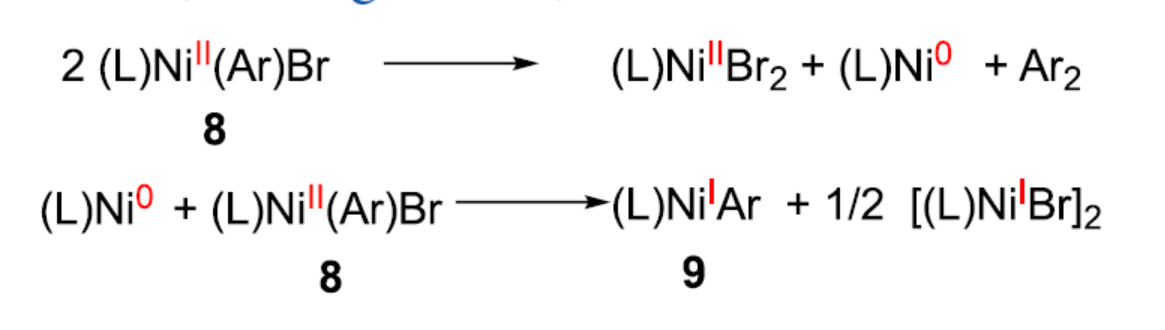
同時,作者還使用鎳配合物進行了相關的化學計量反應(Figure 4)。配合物7與1b的實驗研究表明,Mn粉還原對于芳基轉移是必不可少的。同時,在室溫條件下鎳配合物上的配體交換緩慢以及配合物(L1)MnBr2不參與向烯酮的立體選擇性芳基轉移的過程(Figure 4a)。配合物8與1b的實驗研究表明,在高鎳濃度下可能存在鎳的雙金屬配合物,并導致較少的立體選擇性途徑(Figure 4b)。
(圖片來源:J. Am. Chem. Soc.)
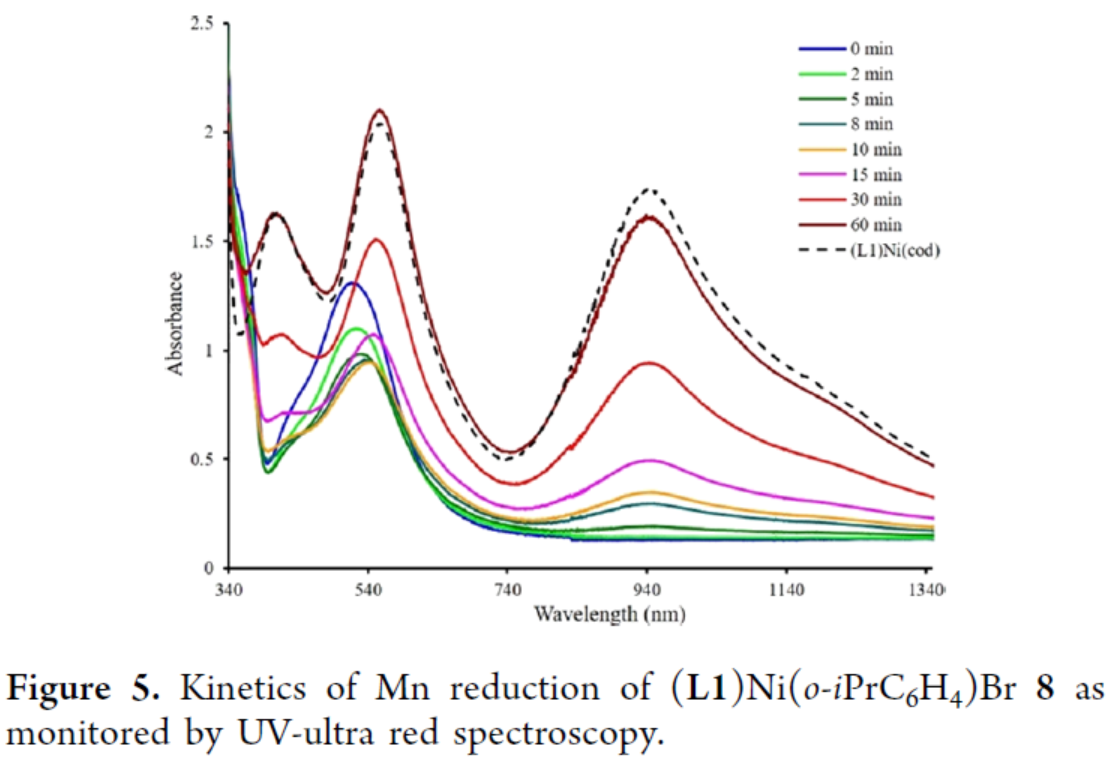
此外,通過紫外-紅外光譜對Mn還原(L1)Ni(o-iPrC6H4)Br(8)的動力學研究表明,在反應2-10 min內可迅速生成(L1)NiI(o-iPrC6H4)(9),其最終轉化為(L1)Ni0。同時,用鋅粉還原比錳粉還原更快,并顯示出類似的動力學曲線(Figure 5)。
(圖片來源:J. Am. Chem. Soc.)
(圖片來源:J. Am. Chem. Soc.)
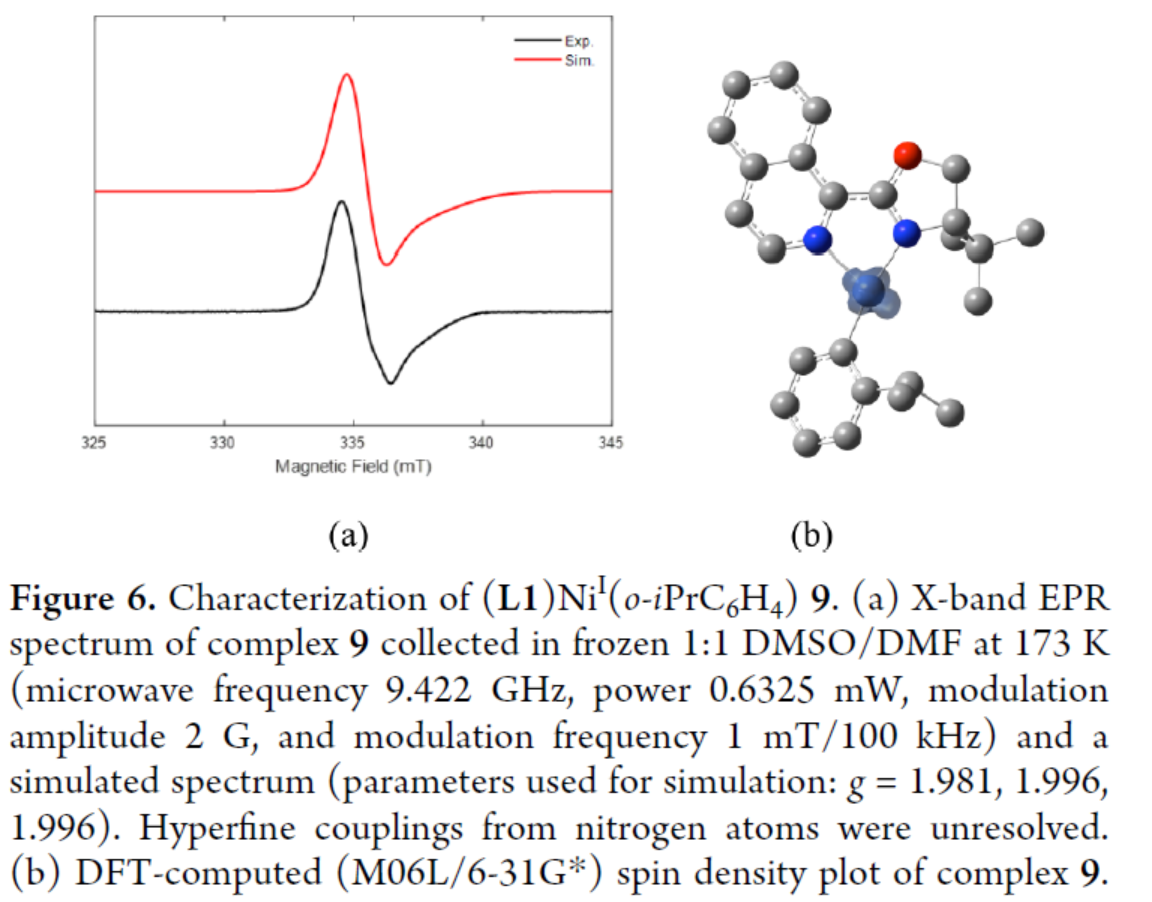
同時,作者通過EPR研究,進一步對(L1)NiI(o-iPrC6H4)(9)的結構信息進行了研究(Figure 6)。
(圖片來源:J. Am. Chem. Soc.)
此外,作者還對(L1)NiI(Ph)(9)與烯酮1b的1,4-加成和1,2-加成進行了相應的過渡態和相對自由能的計算研究(Figure 7)。

(圖片來源:J. Am. Chem. Soc.)
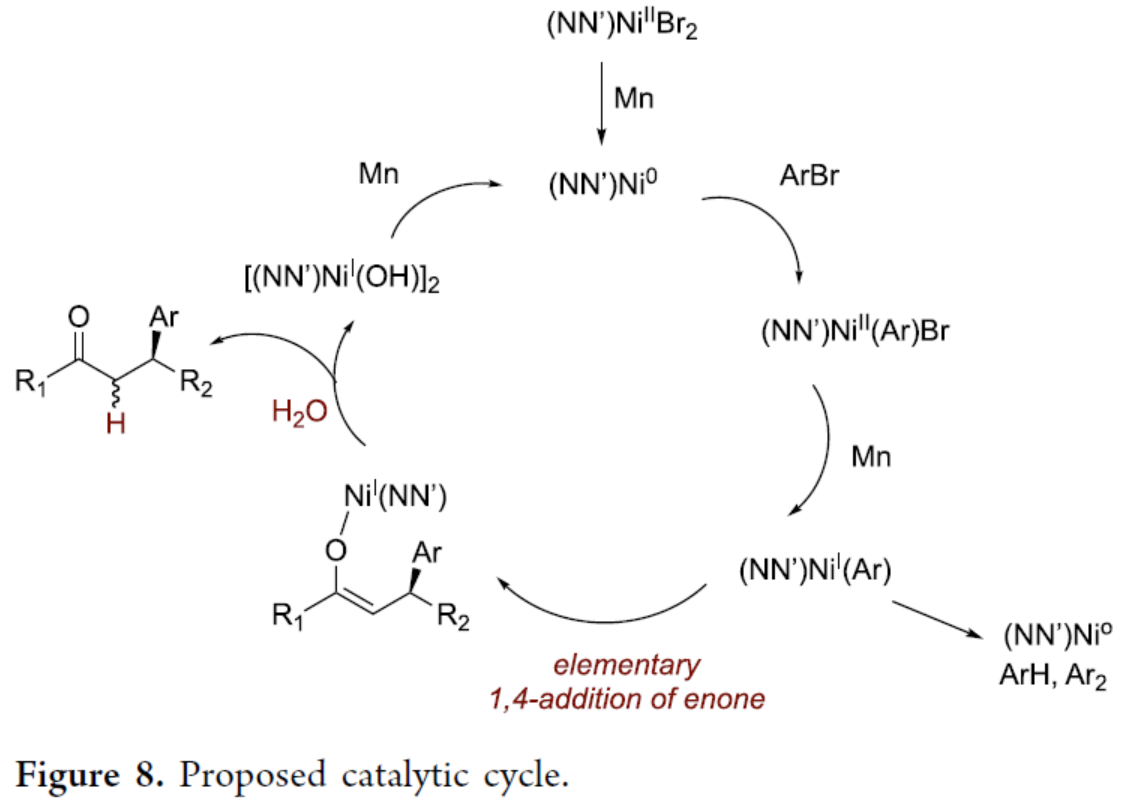
基于上述的研究以及相關文獻的查閱,作者提出了一種合理的催化循環過程(Figure 8)。首先,(NN’)Ni0與ArBr進行氧化加成,生成(NN’)NiII(Ar)Br,其通過Mn粉還原,生成(NN’)NiI(Ar)。其次,(NN’)NiI(Ar)與烯酮經基元1,4-加成,生成O-烯醇鎳配合物,其經水解后,可生成目標產物。同時,(L1)NiI(OH)(或其二聚體)或(L1”NiI(Br)(或其二聚體)在Mn粉還原下可完成催化循環的過程。
(圖片來源:J. Am. Chem. Soc.)
總結
北京大學深圳研究生院周建榮課題組報道了一種鎳催化α,β-不飽和酮的對映選擇性還原(雜)芳基化反應。同時,該策略具有反應條件溫和、底物范圍廣泛、官能團兼容性高、立體選擇性出色等特點。機理研究表明,反應涉及芳基鎳(I)配合物通過1,4-加成環狀過渡態插入烯酮的過程。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn