

在過去的十年中,自由基反應在合成化學中扮演了重要角色,在化學鍵的構建和合成路線的簡化方面有著重大突破。在考慮自由基中間體反應時,作者認為當自由基壽命足夠長時可以作為活化基團,并在遠端位點實現非常規極性反應。許多以雜原子為中心的官能團(如醇、胺、硫醇和膦),當其Hammett取代基常數(σ)為負或接近0.3時被認為是富電子的或電中性的;相反,這些自由基則是缺電子的。因此,作者認為這些親電自由基不僅可以廣泛參與加成、碎裂和官能團轉移反應,還可以作為強吸電子基團活化底物,實現本不可能的反應。在芳烴官能團化的背景下,作者利用芳基X?H鍵的可逆均裂實現了瞬時極性反轉,利用氧自由基中間體實現了富電子鹵酚的芳香親核取代反應(SNAr)。
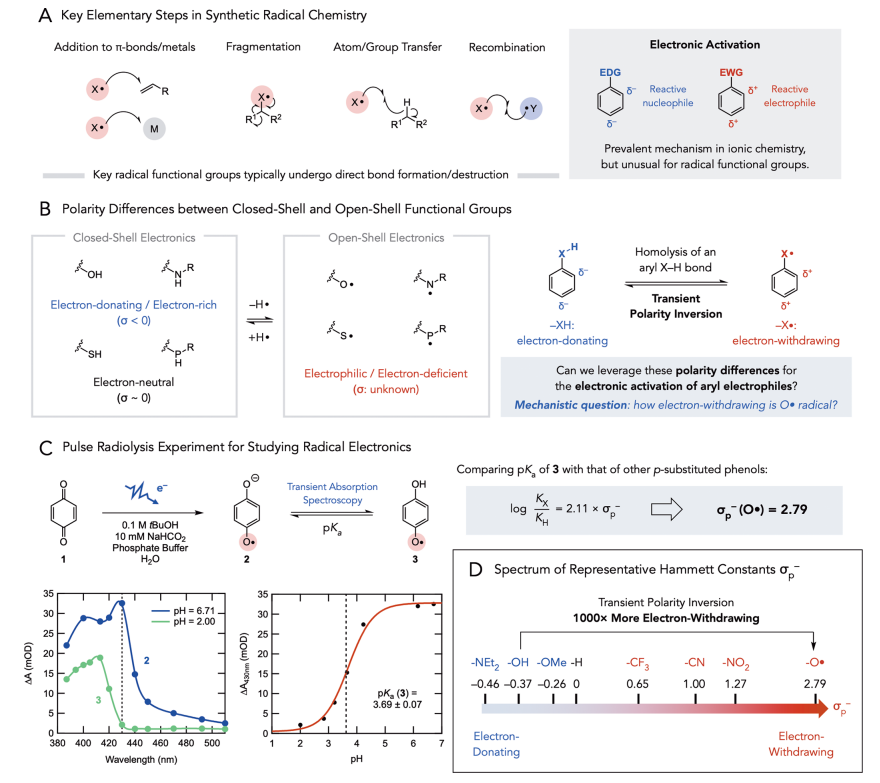
圖1. 研究背景(圖片來源:J. Am. Chem. Soc.)
為了驗證這一假設,作者對自由基的吸電子能力進行量化。Pratt課題組先前的研究提出O?和NH?具有很強的吸電子能力,且分別粗略估計了Hammett常數σp為2和1。為了使數據更精確,作者采用脈沖輻射分解法測量半醌的pKa。半醌自由基相當于一個p-(O?)取代的苯酚,因此它的pKa可以用來計算O?自由基的Hammett常數σp?,先前對半醌自由基的脈沖輻射分解研究表明,其酸性顯著增強。在作者的研究中,半醌自由基可以在含有苯醌1和最小濃度的叔丁醇(0.1 M)和甲酸鈉(10 mM)的水溶液緩沖溶液中生成,在pH=6.71和2.00時可分別觀察到生成的半醌自由基陰離子2和中性半醌自由基3的紫外-可見吸收。通過在不同pH值條件下430 nm處的吸收,作者測定了2和3的相對濃度,隨后用Henderson - Hasselbalch方程擬合滴定曲線,得到3的pKa為3.69(±0.07),說明3的酸性明顯明顯增強,對應于σp?(O?)值為2.79 (vs σp?(NO2) = 1.27),支持了此前的假設。
于是,作者通過上述的假設與驗證實現了氟酚的SNAr。SNAr是有機化學中研究得最好和應用最廣泛的一類反應,然而,由于與脫芳構化相關的高動力學障礙,SNAr通常需要使用缺電子的芳香親電試劑與強親核試劑如醇鹽或硫醇鹽結合。考慮到這一問題,作者著手設計一種體系,使得酚O?H鍵均裂后得到強吸電子基團氧自由基,并暫時性地使芳環親電。芳基氧自由基的相對較長壽命可以適應較慢的親核取代反應。
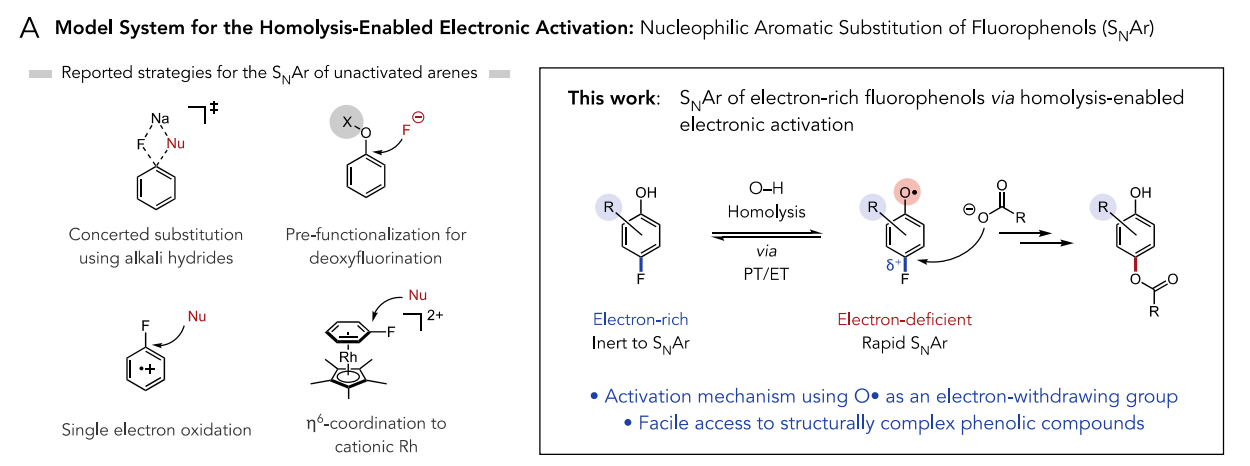
圖2. 反應設計(圖片來源:J. Am. Chem. Soc.)
隨后,作者以2,6-二甲基-4-氟苯酚以模型底物進行條件篩選。在對O?H鍵均裂的多種方法進行篩選后,作者確定最佳條件是80 °C時,苯甲酸(1.5 eq.)和碳酸氫鈉(1.5 eq.)、催化量的氫氧化鈉(20 mol%)和氧化劑鐵氰化鉀(20 mol%)在乙腈水溶液(0.1 M)中反應,可以76%的收率得到目標產物4。
接著,作者在最佳條件下進行了底物拓展。首先是對酚類底物的拓展。不同鄰位取代基的酚(烯丙基、苯基、萘基和芘基 5-9)可以以良好的效率得到目標產物(產率46-61%)。值得注意的是,該反應可以兼容給電子取代基(6,產率61%),與傳統的SNAr相比這是一巨大進步。具有不同電性的苯基取代基的酚同樣可行(10-15, 產率31-90%)。即使有其它氟芳烴和氯芳烴存在,取代也只發生在與O-H的對位。具有缺電子取代基的酚(15和18)反應活性降低,可能是由于這些底物的較高氧化電位和具有吸電子取代基的自由基中間體穩定性有限。為了克服這些限制,三氟化銀是一種相對于鐵氰化鉀更強的氧化劑,可以用來提升反應效率,在硅氧基、酯基和氨基甲酸酯存在時效果極佳(19-21,產率70-95%)。然而,沒有鄰位取代基的氟酚不能得到目標產物,可能是氧自由基的二聚反應的競爭造成的。
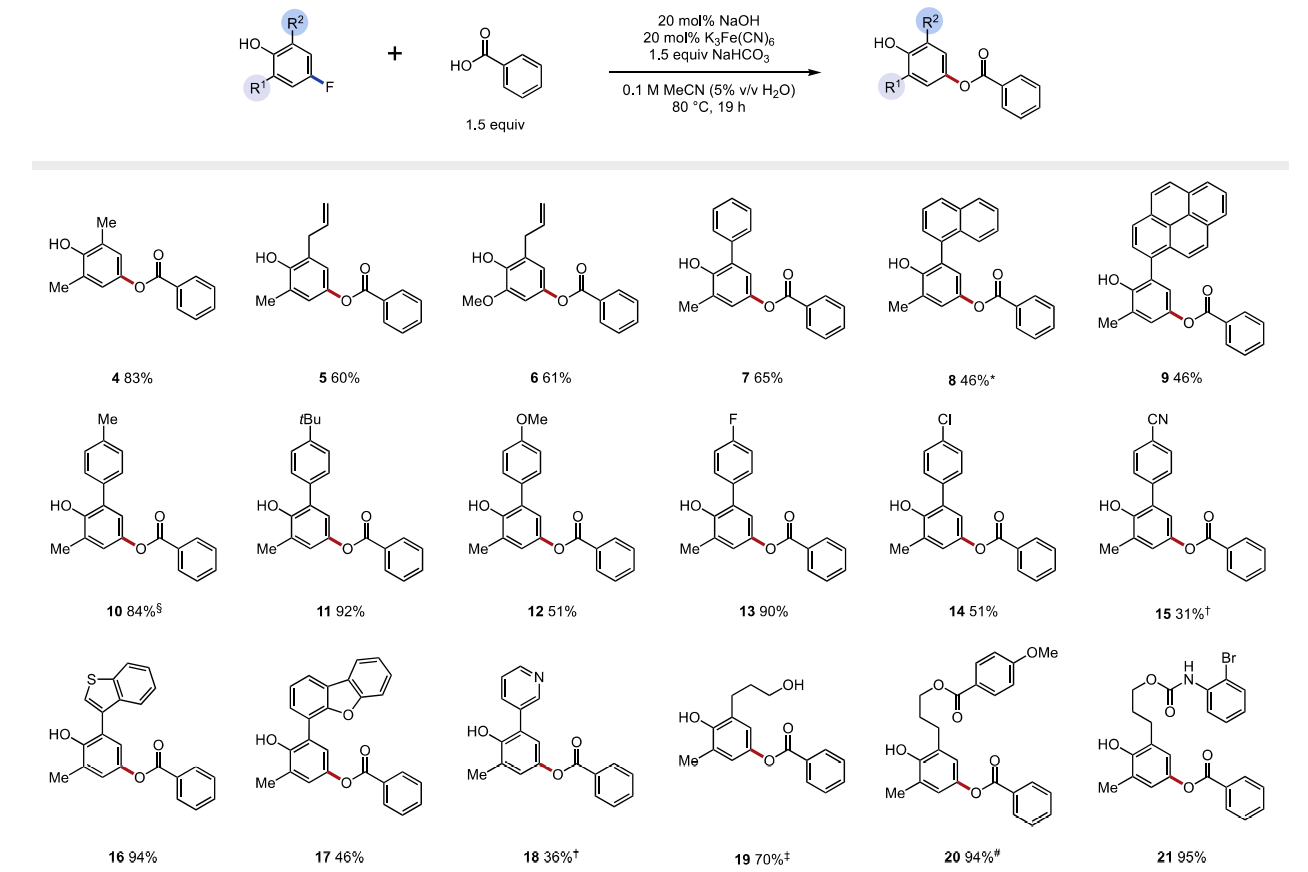
圖3. 底物拓展一(圖片來源:J. Am. Chem. Soc.)
接下來,作者又考察了親核試劑的適用范圍。作者發現富電子(22-24, 產率62-85%)和缺電子(25-28,75-78%產率)的芳基羧酸均能以良好的收率獲得各種苯甲酸衍生物。苯甲酸類親核試劑鄰位、間位和對位的鹵化物取代基在溫和的反應條件下具有良好的耐受性,允許產物的進一步官能團化。該策略也成功地應用于藥物活性化合物貝沙羅素和阿塔盧倫的衍生化(32-33)。除芳基羧酸外,烷基羧酸(34-39)也是反應中適宜的底物。值得注意的是,一系列受保護氨基酸(43-50)在取代反應中兼容,可以在C端選擇性地形成C?O鍵。該方法對游離羧酸基偶聯具有高選擇性,產物無異丙烯化。最后,4-氯代-2,6-二甲基酚也是一種有效的親電試劑,可以與許多芳基和烷基羧酸酯(4,25,32,36和47)發生有效反應,由于氯酚是很容易獲得的底物,這一發現使該方法更具價值。
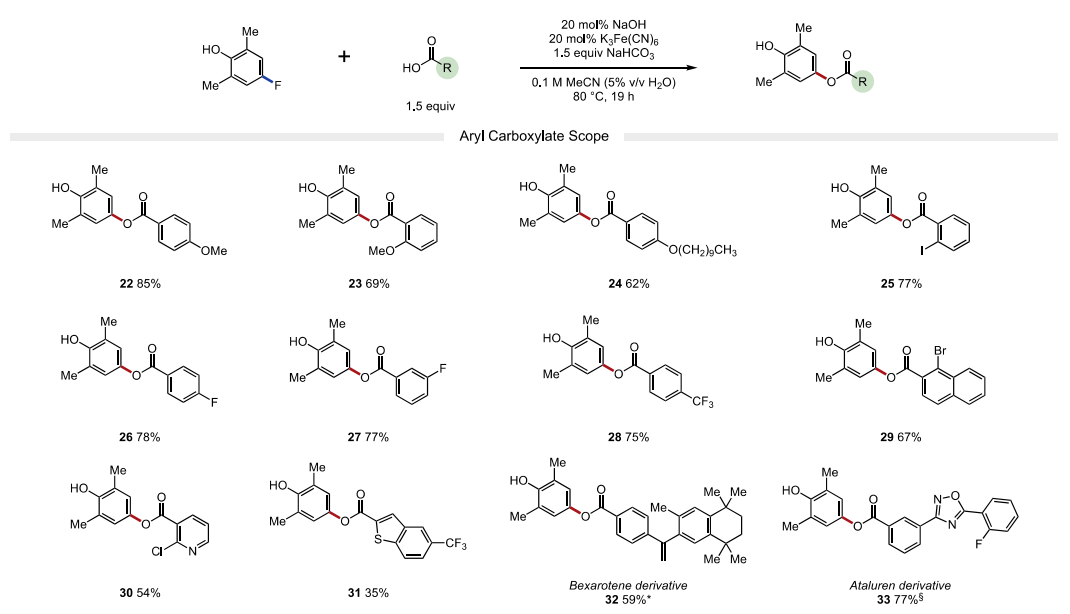
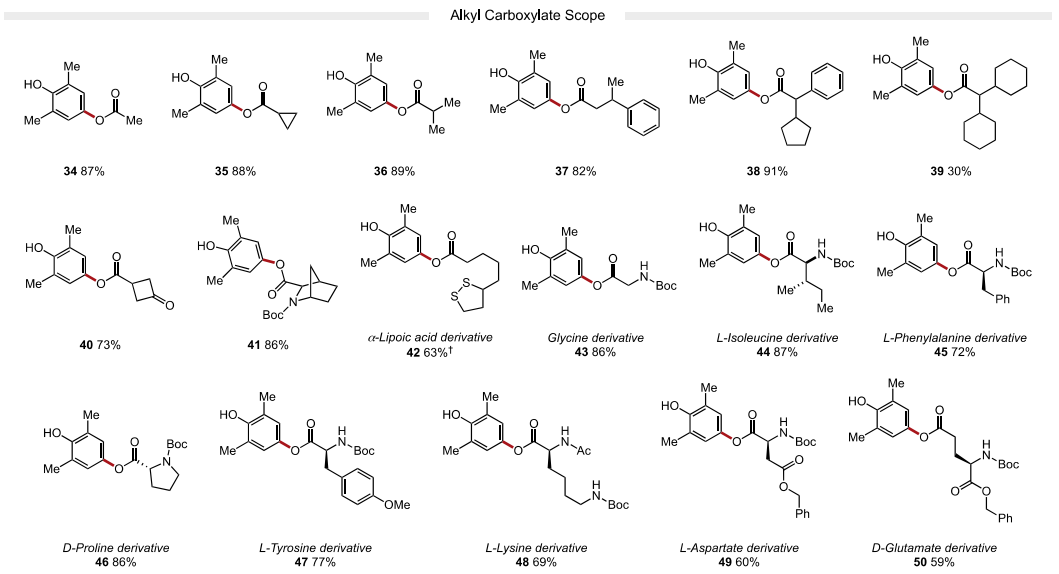
圖4. 底物拓展二(圖片來源:J. Am. Chem. Soc.)
最后,作者對這一反應的機理進行闡述。作者認為該反應通過自由基機理進行,該反應經過堿和鐵(III)氧化劑與底物a的逐步質子轉移/電子轉移(PT/ET)過程后生成關鍵的氧自由基中間體b。瞬態吸收光譜數據顯示,在激光光解實驗中生成的氧自由基確實壽命足夠長,可以進行后續反應(t1/2 = 690 μs)。缺電子的氧自由基中心可以有效激活芳環,與相應酸的原位脫質子形成的親核試劑進行SNAr。生成的中間體c與另一個分子a進行快速的氫原子交換得到目標產物和b,后者繼續參與自由基反應。作者采用多種自由基引發劑進行反應,發現該反應的鏈傳遞并不依賴于鏈引發過程。此外,作者利用低溫(10 K)電子順磁共振(EPR)實驗對關鍵自由基中間體b進行了檢測,反應體系中生成的自由基g-factor為2.0049,與此前報道數值一致,證明反應確實經歷了b這一關鍵中間體。
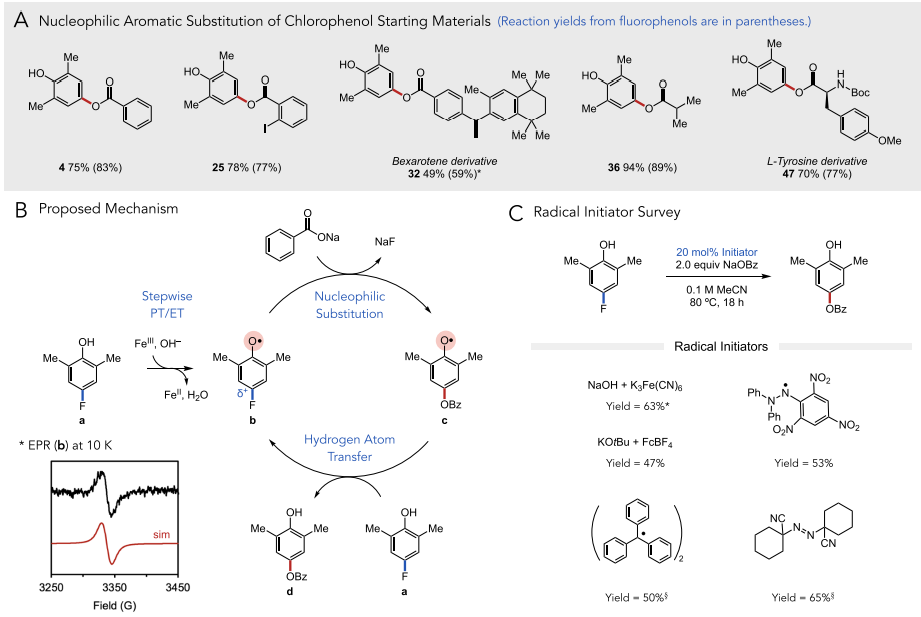
圖5. 反應機理(圖片來源:J. Am. Chem. Soc.)
總結 Robert R. Knowles課題組描述了一種新的自由基反應模式,它利用中性氧自由基作為強吸電子基團,對惰性芳基親電試劑進行活化。通過脈沖輻射分解研究證實了該策略的可行性,并通過開發富電子鹵酚SNAr合成方案驗證了該策略的實用性。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn