

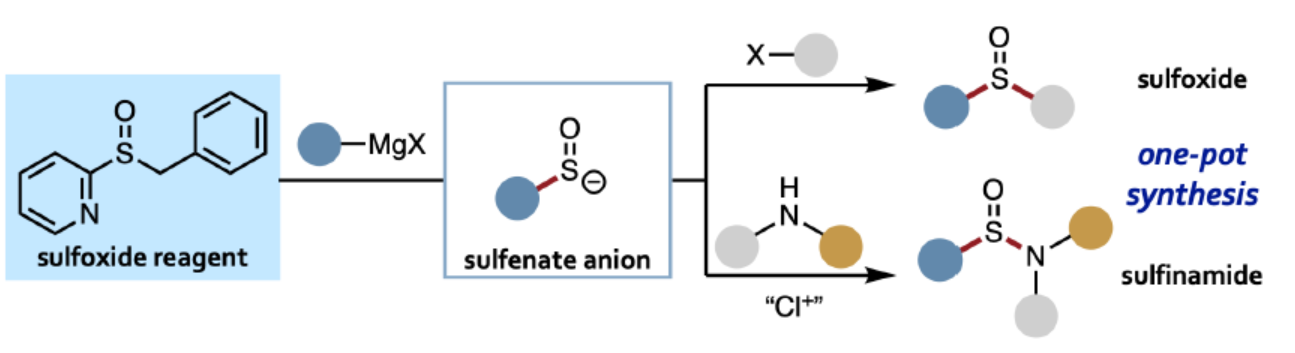
(圖片來源:Angew. Chem. Int. Ed.)
亞砜和亞磺酰胺是一種具有多種用途的含硫單元,可用作過渡金屬催化中的配體、手性助劑以及硫官能團的前體,例如亞砜亞胺(sulfoximines)和磺酰亞胺酰胺(sulfonimidamides)。對于亞砜和亞磺酰胺的合成方法,通常需在底物中預先引入硫官能團。例如,在合成亞磺酰胺的已知底物中,如硫醇、二硫化物、亞硫酸酯、金屬亞硫酸酯等,商業可用性均有限(Figure 1)。此外,這些策略具有有限的結構模塊性,因為在關鍵的C-S或N-S鍵形成步驟中只能引入兩個取代基中的一個。對于快速合成亞砜和亞磺酰胺衍生物的理想方法是三組分偶聯反應,其中兩個取代基可在一步(或一鍋)操作中連接到中心SO單元。在此背景下,Willis課題組報道了一種一鍋三組分合成亞砜和亞磺酰胺衍生物的方法,其中使用DABSO作為SO源。中間體亞磺酸鹽(RSO2–)是合成不同產物的關鍵點。受此啟發,Saito課題組認為使用次磺酸陰離子(RSO–)作為關鍵的中間體,可用于亞砜的合成。雖然次磺酸陰離子可通過一氧化硫與有機金屬試劑加成而形式獲得,但實際上該反應卻不適用,因為一氧化硫在環境條件下是一種不穩定的氣體。此外,已知的次磺酸陰離子前體合成需預先引入碳-硫鍵,從而不適合實現三組分偶聯反應。近日,德國慕尼黑大學Fumito Saito課題組開發了一種通過Grignard試劑合成的穩定的亞砜試劑,并可分別與碳親電試劑和氮親電試劑反應,分別獲得相應的亞砜和亞磺酰胺衍生物。
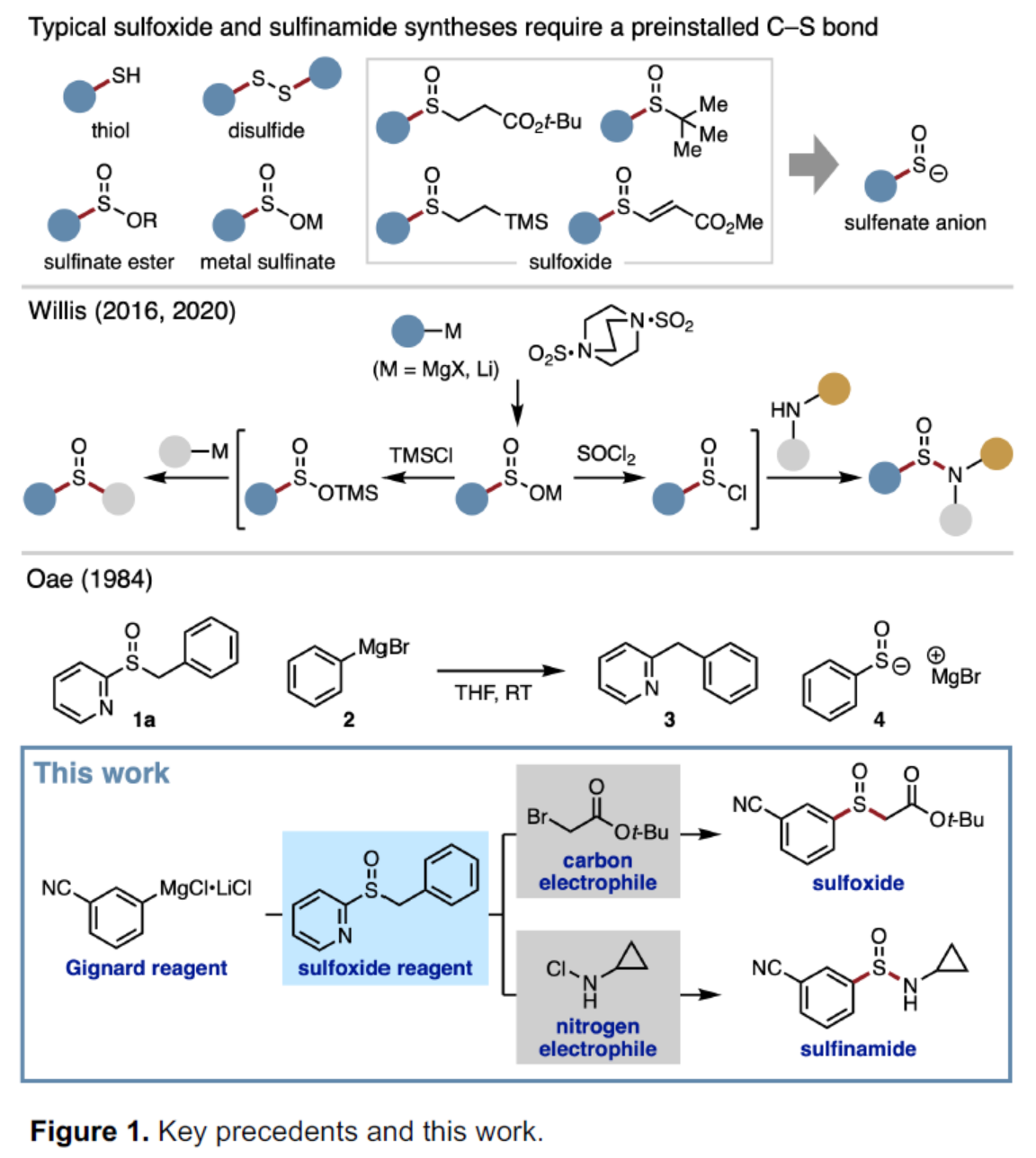
(圖片來源:Angew. Chem. Int. Ed.)
首先,作者對Grignard試劑的底物范圍進行了擴展(Table 1)。一系列具有不同電性取代的芳基、萘基、雜芳基Grignard試劑,均可順利進行反應,獲得相應的產物7-21,收率為43-90%。值得注意的是,通過該策略可合成傳統硫醚氧化方法不易制備的亞砜產物,如10。烷基和烯基Grignard試劑,也能夠順利反應,獲得相應的產物22-25,收率為58-68%。
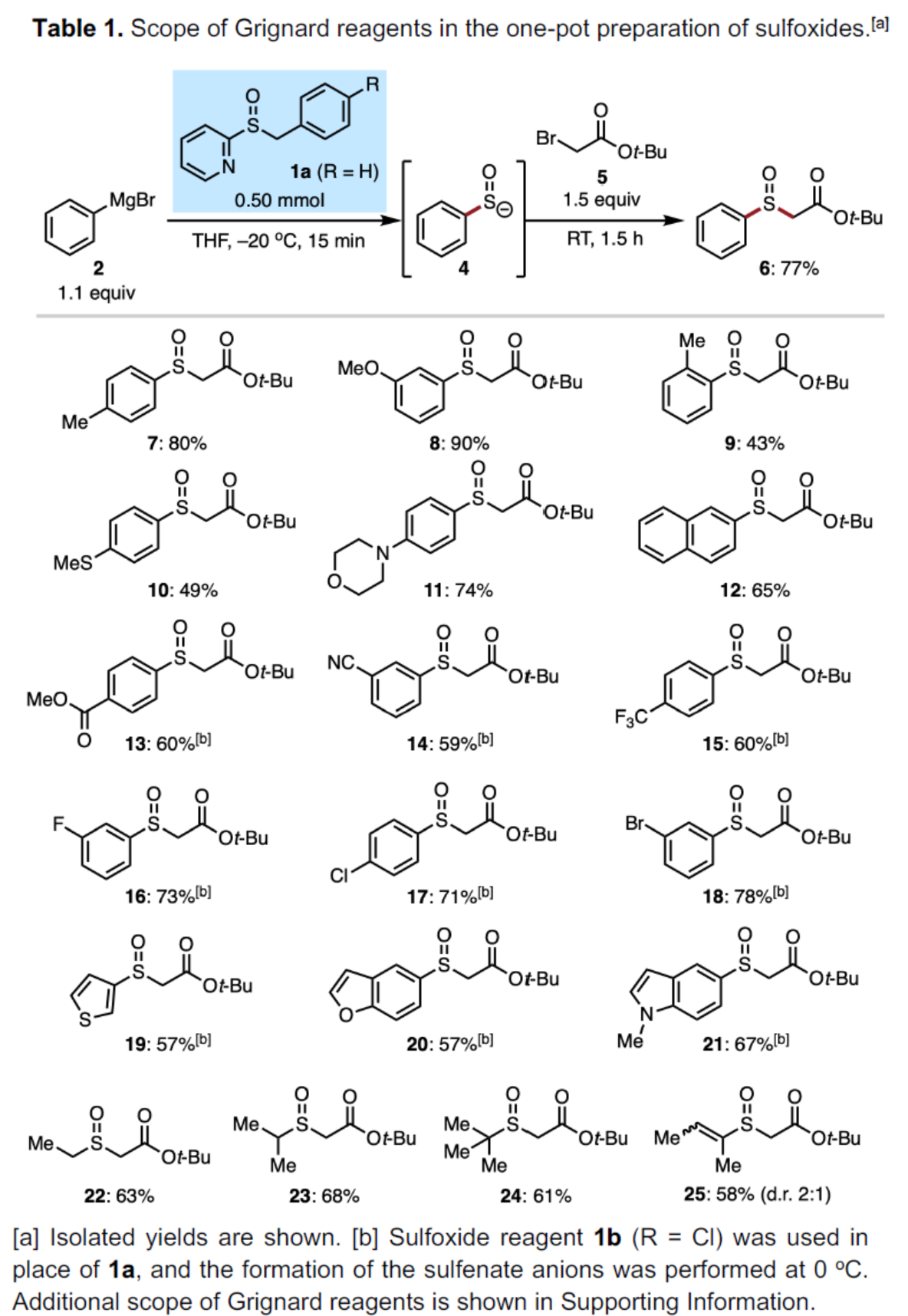
(圖片來源:Angew. Chem. Int. Ed.)
緊接著,作者對碳親電試劑的底物范圍進行了擴展(Table 2)。研究表明,一系列活化的烷基溴、烷基碘以及高價碘試劑,均可順利進行反應,獲得相應的產物26-33,收率為50-84%。同時,一系列活性的基團,如烯基、炔基等,均與體系兼容。
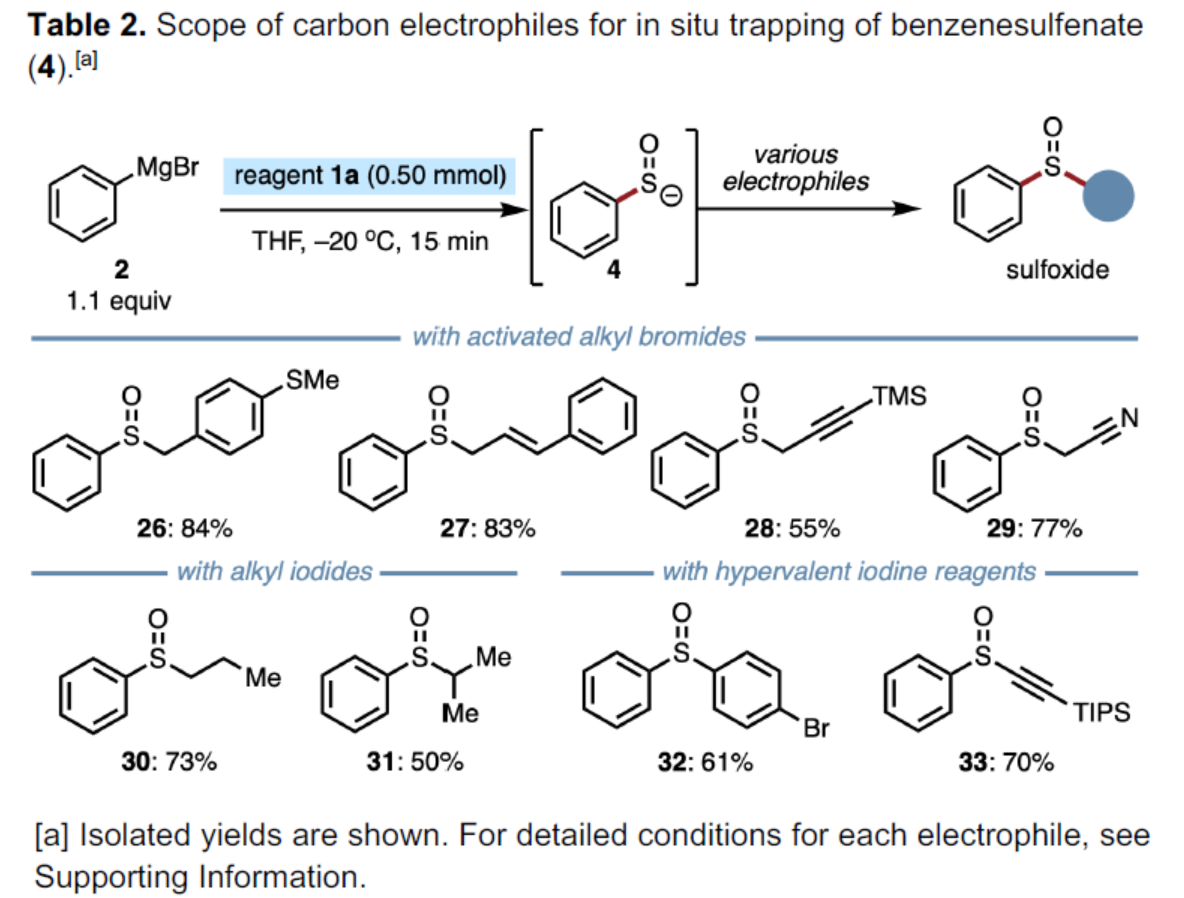
(圖片來源:Angew. Chem. Int. Ed.)
接下來,作者對一鍋法合成亞磺酰胺的反應進行了研究。雖然化學家們已開發多種通過次磺酸合成亞砜的反應,但對于通過次磺酸合成亞磺酰胺的反應僅有一例報道。2018年,張俊良課題組(Adv. Synth. Catal. 2018, 360, 1123.)報道了一種銅催化次磺酸陰離子的親電酰胺化反應,直接合成了亞磺酰胺,但此反應需要使用羥胺衍生物(需要額外的合成步驟),并且僅適用于三級亞磺酰胺的合成。作者認為,次磺酸陰離子可與親電胺發生簡單的取代反應,且無需使用過渡金屬催化劑和特定的胺化試劑。因此,作者對氮親電試劑的底物范圍進行了擴展(Table 3)。首先,一系列環狀和非環狀二級胺(如嗎啉、哌嗪、吡咯烷等),均可順利進行反應,獲得相應的三級亞磺酰胺產物34-48,收率為33-90%。其次,一系列一級胺(如含有芐基、苯乙基、環丙基、環丁基、環己基胺,甚至空間受阻的金剛烷胺),均與體系兼容,獲得相應的二級亞磺酰胺產物49-60,收率為41-77%。同時,苯胺以及其它烷基取代的胺,也是合適的底物,獲得相應的二級亞磺酰胺產物61-64,收率為34-74%。此外,當使用二苯基膦酰羥胺(DPPH)作為胺親電試劑時,可合成一系列一級亞磺酰胺產物65-80,收率為41-77%。
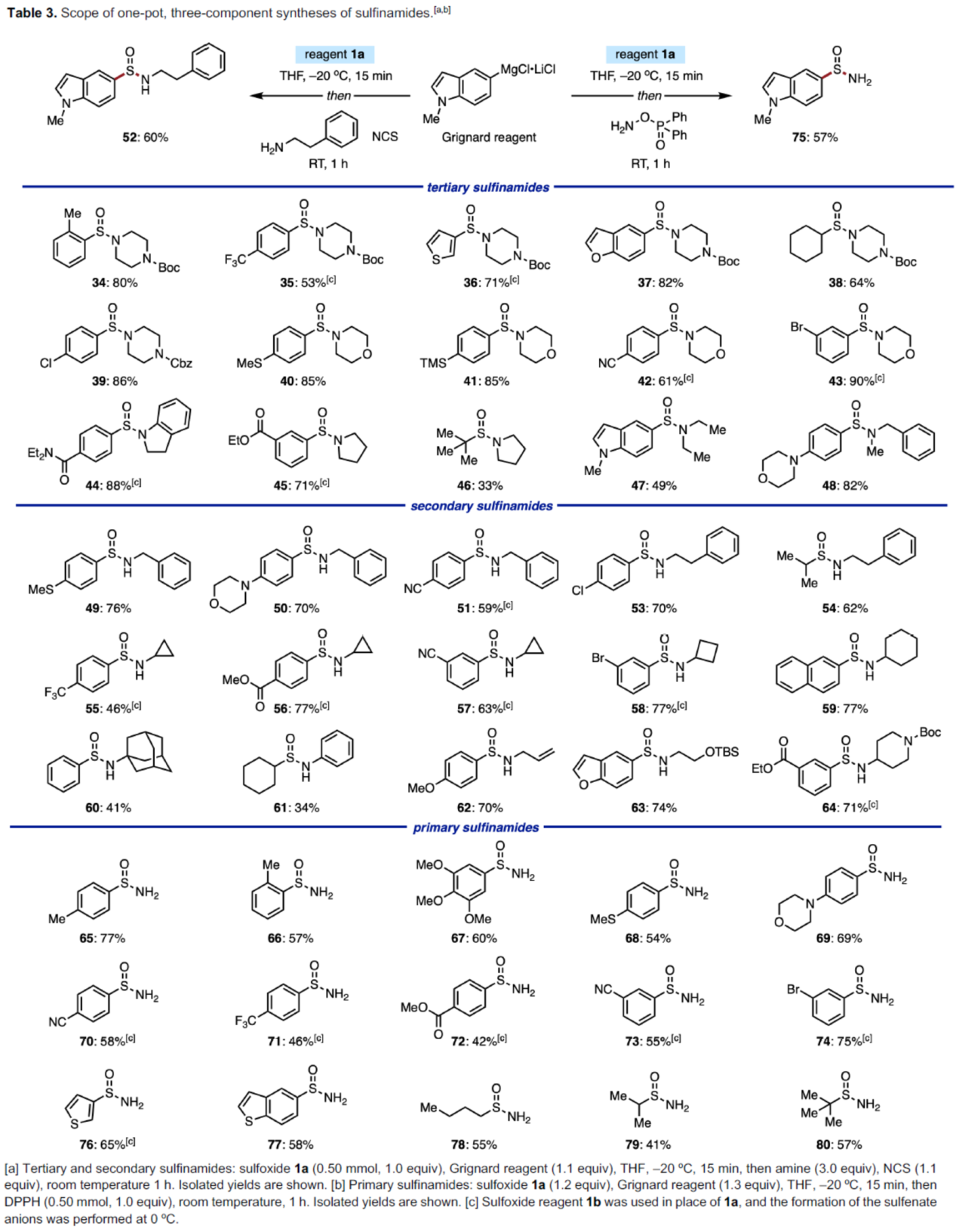
(圖片來源:Angew. Chem. Int. Ed.)
緊接著,作者對反應的實用性進行了研究(Scheme 1)。首先,亞砜試劑1a和3,4,5-三甲氧基苯基溴化鎂(81)反應生成次磺酸陰離子后,再與原位生成的N-氯嗎啉進行取代反應,可以90%的收率獲得產物82,這是鎮靜劑曲美托嗪(Trimetozine)的亞磺酰胺類似物。通過類似的途徑,還可以84%的收率獲得產物83,這是抗抑郁藥Trocimine的亞磺酰胺類似物。其次,84與亞砜試劑1b反應生成次磺酸陰離子后,再進行取代反應,可以85%的收率獲得產物85。85在KOTMS條件下,可將甲酯轉化為羧酸,可以78%的收率得到羧酸產物86,這是用于治療痛風和高尿酸血癥的丙磺舒(Probenecid)的亞磺酰胺類似物。

(圖片來源:Angew. Chem. Int. Ed.)
此外,作者發現,烯丙基溴化鎂(87)、亞砜試劑1a和親電試劑5在標準條件下反應時,可分別以76%的收率得到亞砜化合物88和以69%的收率得到2-烯丙基吡啶89(Scheme 2)。這些產物可通過1a和87之間直接SNAr反應直接形成(path a),或者通過烯丙基和2-吡啶基之間的簡單分子內偶聯(涉及中間體90)形成(path b)。
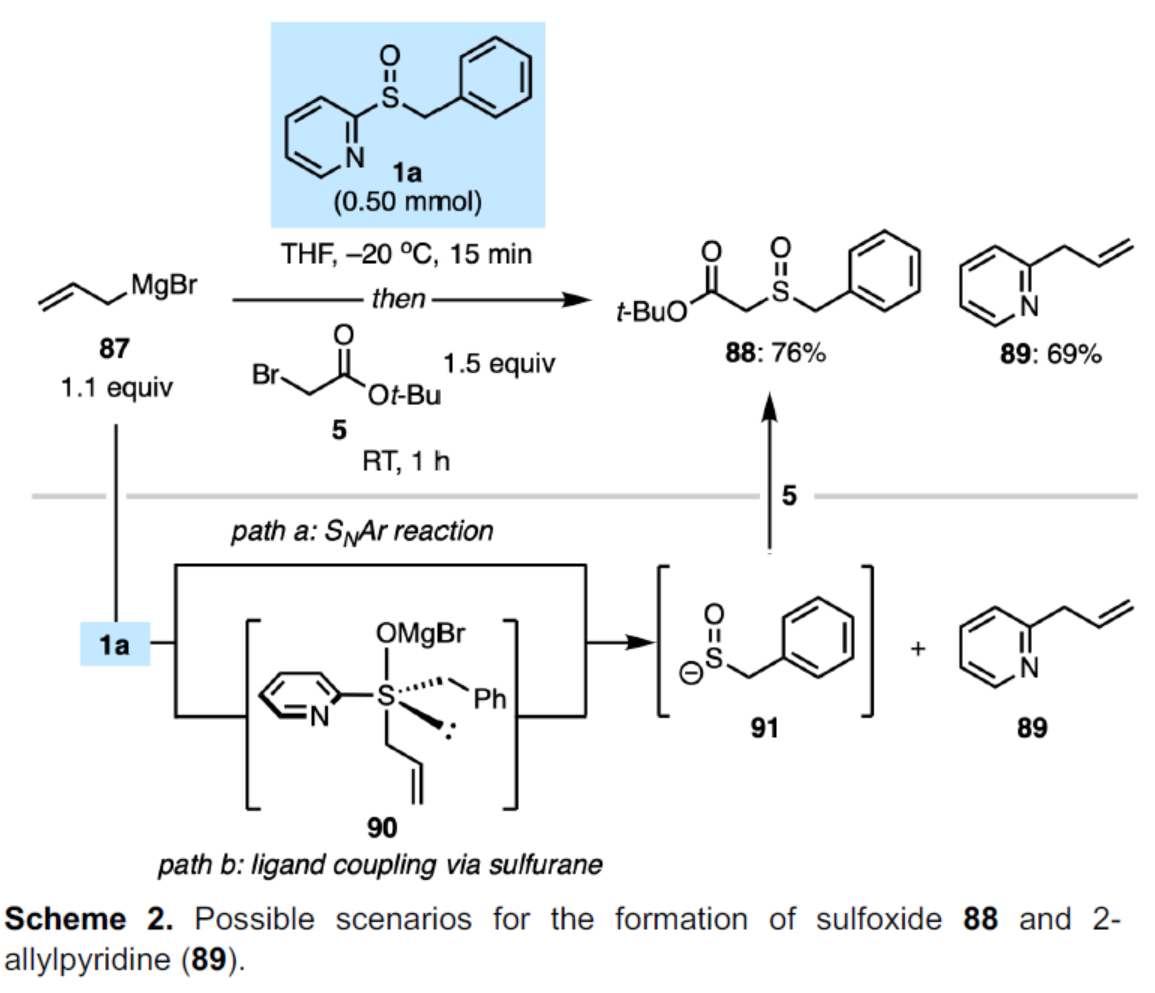
(圖片來源:Angew. Chem. Int. Ed.)
總結 德國慕尼黑大學Fumito Saito課題組報道了一種易于制備且穩定的亞砜試劑,并成功應用于一鍋三組分亞砜和亞磺酰胺的合成中。其中,一系列Grignard試劑可用于生成相應的次磺酸陰離子,可用作合成亞砜的關鍵中間體。次磺酸陰離子還可與多種氮親電試劑發生取代反應,合成了一系列一級、二級和三級亞磺酰胺衍生物。此外,通過對相關藥物分子類似物的合成,進一步證明了反應的實用性。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn