

(圖片來源:J. Am. Chem. Soc.)
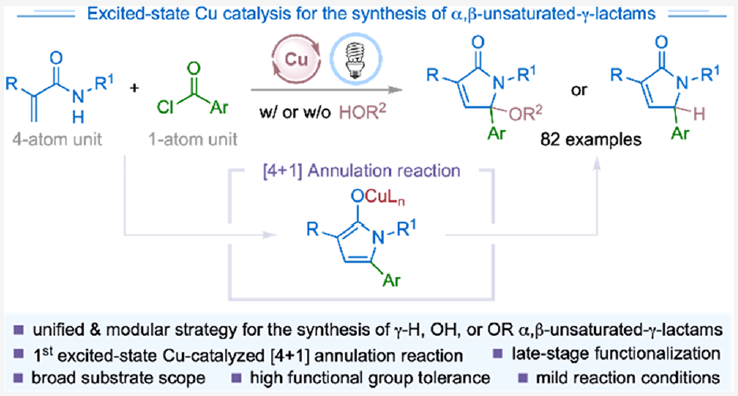
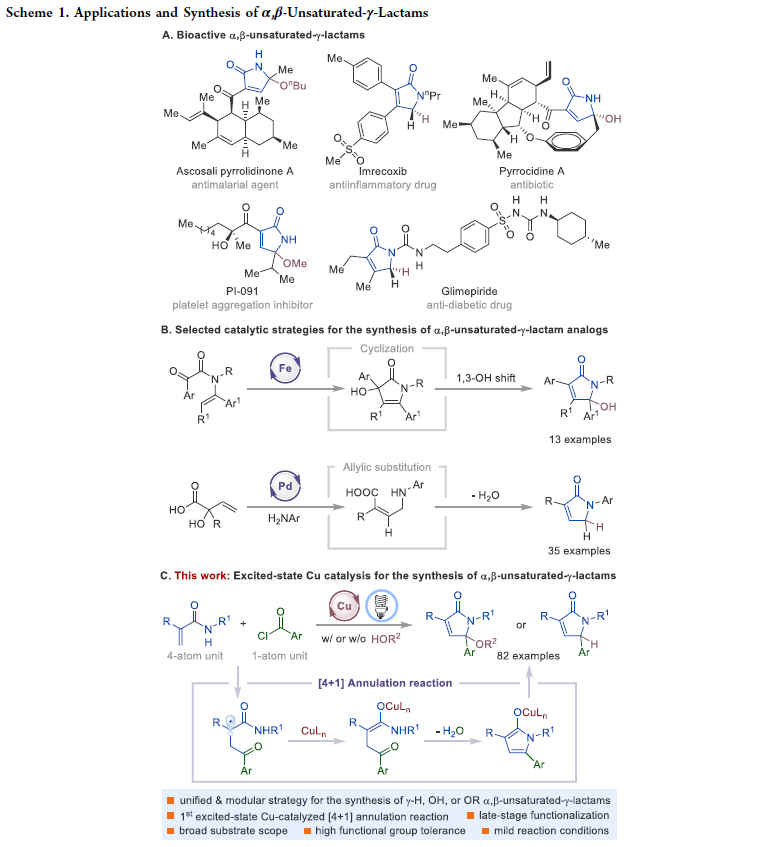
α,β-不飽和-γ-內酰胺是具有重要生物活性的天然產物和合成有機化合物的核心骨架(Scheme 1A)。此外,α,β-不飽和-γ-內酰胺還可以作為重要的合成砌塊實現官能團化γ-內酰胺和吡咯的合成。因此,化學家們發展了許多化學計量以及催化的合成策略實現α,β-不飽和-γ-內酰胺的構建。例如,王梅祥院士課題組報道了鐵催化三級烯酰胺的分子間環化、1,3-羥基遷移過程實現了γ-羥基化α,β-不飽和-γ-內酰胺衍生物的合成(Scheme 1B)。最近,Kleij課題組發展了鈀催化的多米諾反應實現了γ-氫化的α,β-不飽和-γ-內酰胺衍生物的合成。盡管此領域取得了一定的進展,但是利用催化策略實現γ-烷氧基化的α,β-不飽和-γ-內酰胺衍生物的合成卻很少見。因此,發展一種操作簡單的模塊化方法來實現一系列γ-烷氧基化、γ-羥基化以及γ-氫化的α,β-不飽和-γ-內酰胺的合成具有重要意義。
近年來,可見光誘導的激發態催化過程已成為有機合成中的重要工具。最近,使用廉價易得的銅絡合物代替RuII和IrIII絡合物作為光催化劑實現轉化得到了廣泛的關注。基于作者對激發態銅催化、自由基化學以及芳酰基自由基極性反轉合成應用的興趣,最近,美國紐約州立大學Christopher J. Johnson和Ming-Yu Ngai課題組發展了首例激發態銅催化的[4+1]環化反應,高效模塊化合成了一系列γ-官能團化的α,β-不飽和-γ-內酰胺(Scheme 1c)。
(圖片來源:J. Am. Chem. Soc.)
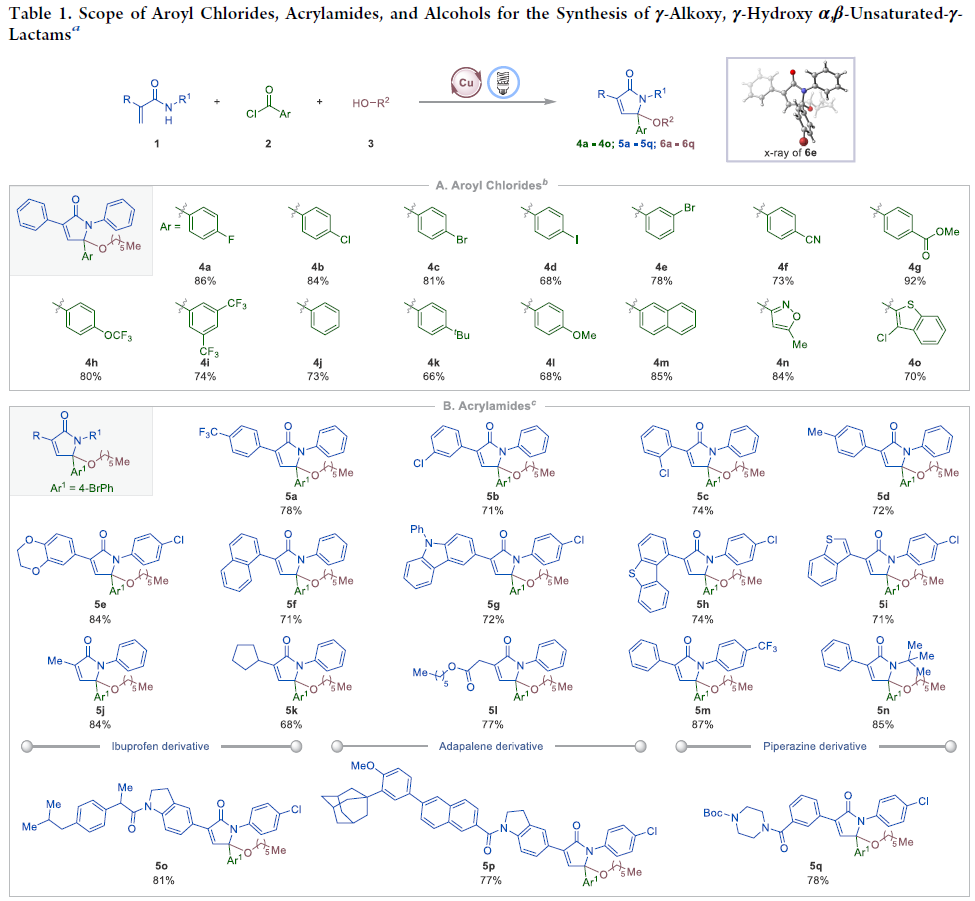
作者首先以N-2-二苯基丙烯酰胺1a、4-氟苯甲酰氯2a以及正己醇3r作為模板底物進行反應探索。通過一系列條件篩選作者發現當使用Cu2O (10.0 mol%), rac-BINAP (20.0 mol%)在對二甲苯/DCE(1:1)(0.1 M)中,100W藍光LED照射下室溫反應22小時可以以98%的核磁產率得到目標γ-己氧基化α,β-不飽和-γ-內酰胺產物4a。控制實驗表明銅催化劑、rac-BINAP配體以及光的照射對反應至關重要,且缺一不可。值得注意的是,當使用Ru或Ir類光催化劑時并沒有得到目標產物,由此表明銅催化基具有的獨特反應活性。
在得到了最優反應條件后,作者分別對(雜)芳酰氯、烯酰胺和醇的底物范圍進行探索(Table 1)。此反應可以適用于一系列不同電性取代的(雜)芳酰氯,以中等至良好的產率得到產物4a-4o。一系列官能團,如鹵素、氰基、酯基、三氟甲基、三氟甲氧基、叔丁基、甲氧基,雜環等均可兼容。遺憾的是,烷基酰氯不能實現此轉化(Table 1A)。此外,此體系還可以兼容不同電性取代的丙烯酰胺衍生物(5a-5n)。值得注意的是,一些具有生物活性的復雜分子(如ibuprofen, adapalene, piperazine等)衍生物也可以實現此轉化,證明了此方法的實用性(Table 1B)。最后,作者發現水、一級醇、二級醇均可參與反應實現γ-羥基化(6a)和γ-烷氧基化(6b-6q)產物的合成。并且體系同樣可以兼容nerol(6p)和(?)-citronellol(6q)等一系列天然醇類(Table 1C)。
(圖片來源:J. Am. Chem. Soc.)
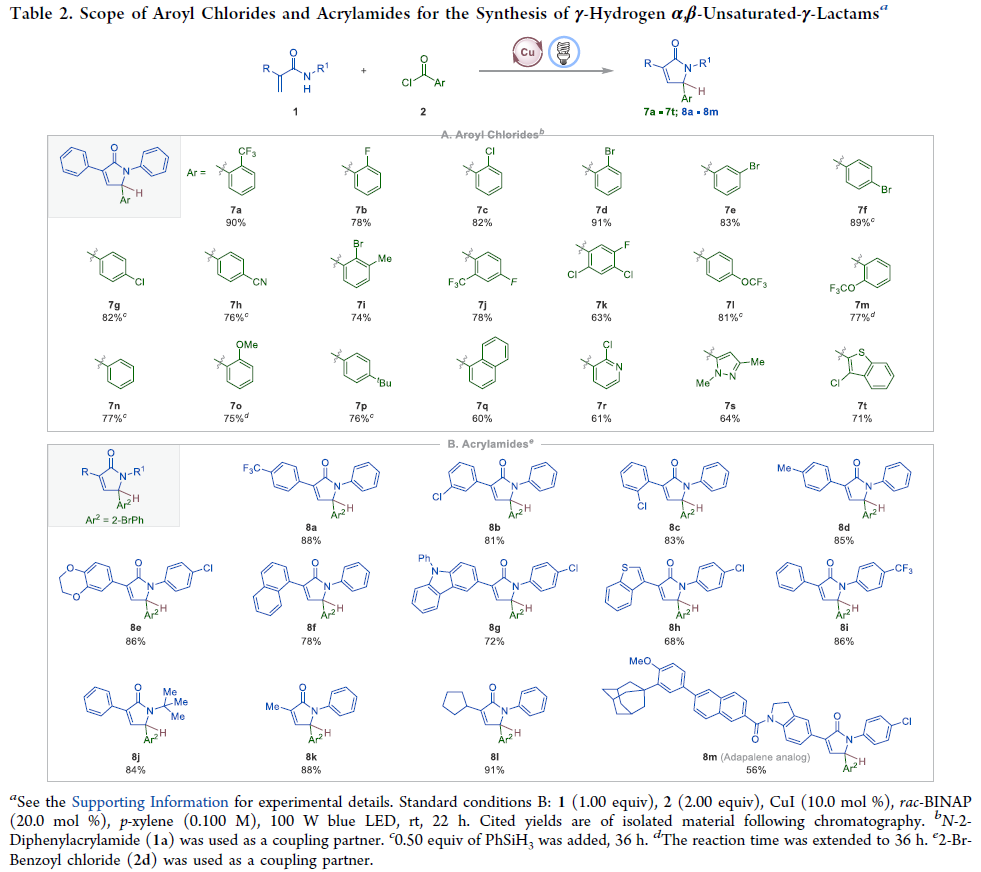
在進行底物拓展時,作者發現當使用2-三氟甲基苯甲酰氯反應時僅以11%的產率得到目標γ-烷氧基化α,β-不飽和-γ-內酰胺產物,且體系中觀察到了γ-氫化α,β-不飽和-γ-內酰胺產物7a的生成。隨后作者在不添加醇的情況下對反應體系進一步優化,可以以91%的產率得到γ-氫化產物7a。且通過對不同取代的芳基酰氯和丙烯酰胺探索,反應同樣展現出良好的底物適應性(7a-7t, 60-91%, 8a-8m, 56-91%)。其中三氟甲基(7a,7j)、三氟甲氧基(7l,7m)、氰基(7h)、鹵素(F:7b,7j,7k; Cl:7c,7g,7k,7r,7t; Br:7d-7f,7i)以及藥物相關的雜芳環(8m)均可兼容,展現出良好的官能團兼容性。值得注意的是,利用此轉化合成出的82種產物中有80種是新化合物,這為新的藥物、農藥以及功能材料的探索提供了新的化學空間(Table 2)。
(圖片來源:J. Am. Chem. Soc.)
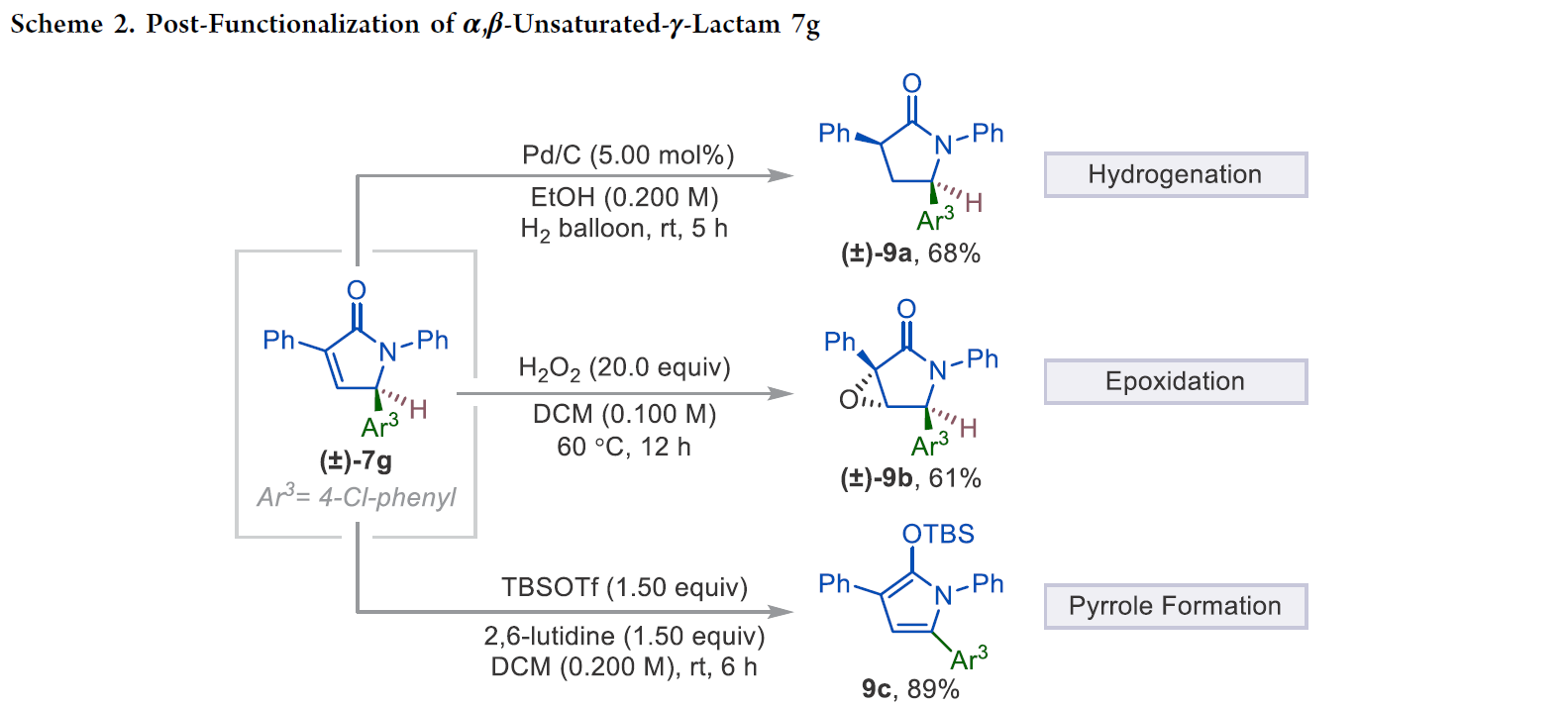
接下來,為了證明α,β-不飽和-γ-內酰胺產物的應用性,作者進行了一系列合成轉化(Scheme 2)。首先,作者利用產物7g在Pd/C,H2 (1 atm)存在的條件下以68%的產率,>20:1的非對映選擇性得到相應的γ-內酰胺產物9a。此外,產物7g還可以與過氧化氫反應以61%的產率得到環氧產物9b。值得注意的是,7g還可以在室溫下與TBSOTf反應,以89%的產率實現TBS保護的吡咯產物9c。
(圖片來源:J. Am. Chem. Soc.)
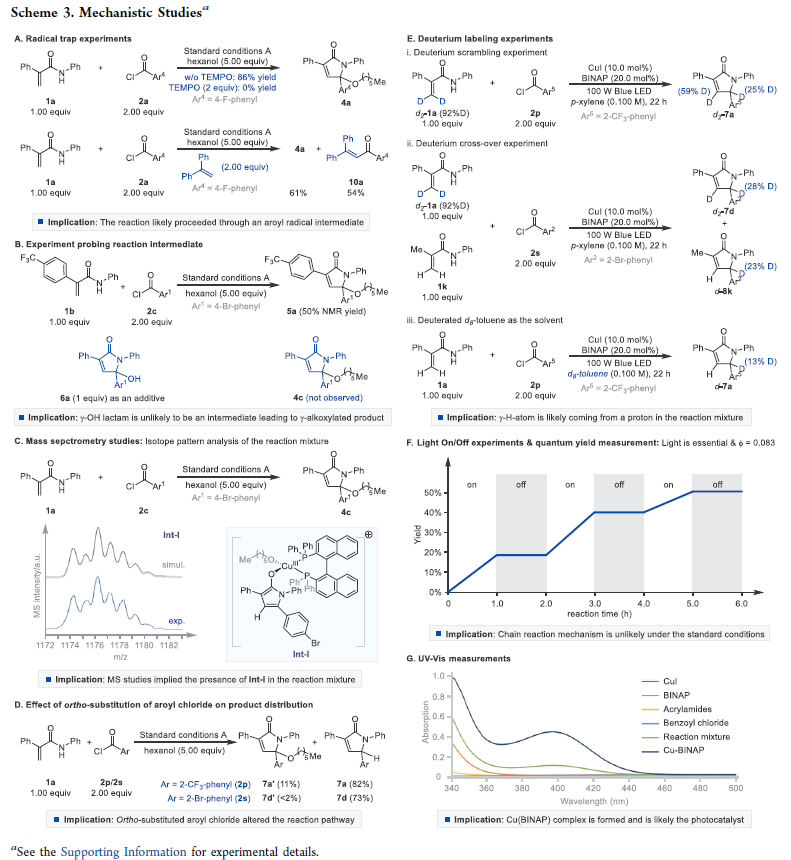
為了深入理解反應機理,作者進行了一系列控制實驗(Scheme 3),并得出以下結論:1)自由基捕獲實驗表明反應中可能涉及芳酰基自由基中間體(Scheme 3A);2)γ-羥基化產物并不是生成γ-烷氧基化產物的中間體(Scheme 3B);3)反應中涉及銅絡合物Int-I的形成(Scheme 3C);4)當芳環鄰位有取代時,主要生成γ-氫化產物(Scheme 3D);5)氘代實驗表明γ-氫化產物中的氫原子即來源于丙烯酰胺又來源于溶劑(Scheme 3E);6)開關燈實驗表明反應不在光照下是不發生的。且在標準條件下生成的γ-氫化產物的量子產率為0.083,這意味著自由基鏈式過程是不可能發生的(Scheme 3F);7)通過CuI?BINAP的UV?Vis吸收波譜可以得出反應中含有CuI?BINAP光活性絡合物(Scheme 3G)。
(圖片來源:J. Am. Chem. Soc.)
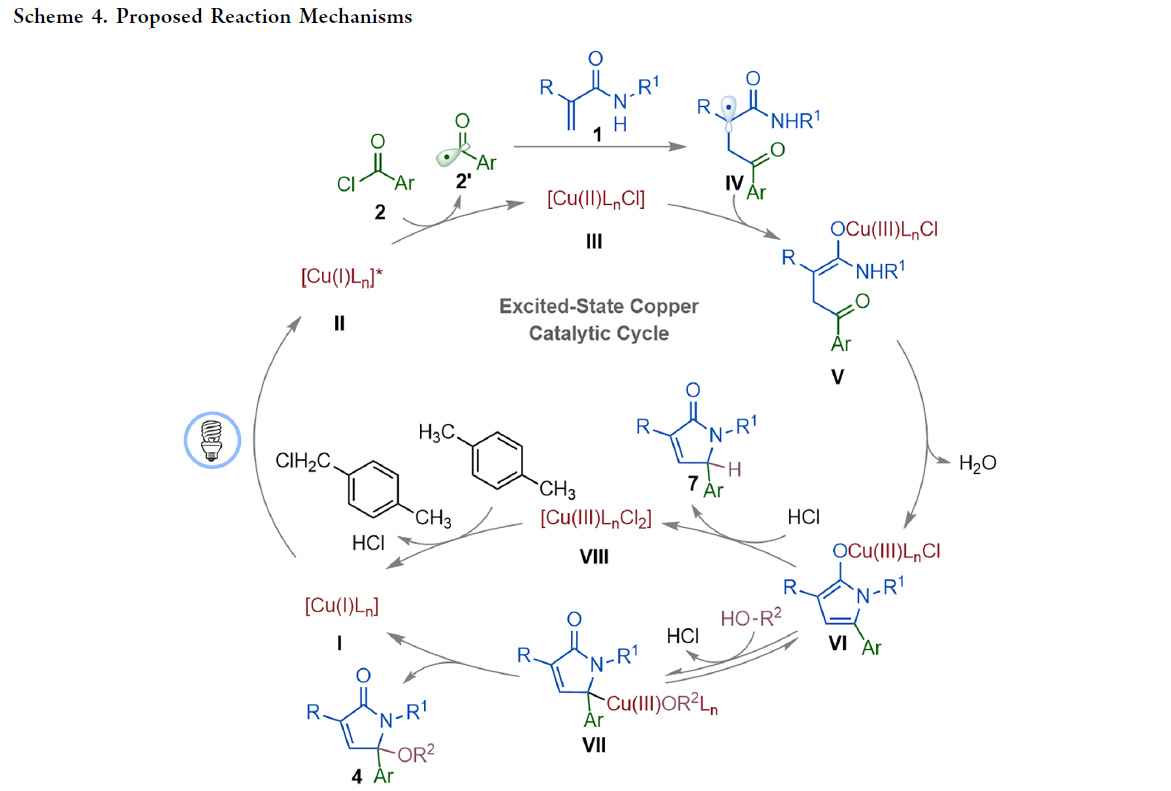
基于上述控制實驗,作者提出了此轉化可能的反應機理(Scheme 4)。首先,藍光激發CuI?BINAP絡合物I形成激發態*[CuI?BINAP]絡合物II。隨后絡合物II還原芳基酰氯2形成銅絡合物III并釋放芳酰基自由基2’。接下來,2’與丙烯酰胺1中的烯烴加成得到三級烷基自由基中間體IV,其可以被III捕獲形成中間體V。接著,V發生分子內縮合得到中間體VI。當體系中存在醇的時候,VI經歷配體交換、銅中心向γ-位遷移和還原消除過程得到γ-烷氧基化產物4并再生銅催化劑I。當體系中不存在醇或者使用鄰位取代的芳酰基氯時,絡合物VI將經歷質子化和互變異構形成γ-氫化產物7和銅物種VIII。最后VIII被對二甲苯還原得到銅催化劑I完成催化循環。
(圖片來源:J. Am. Chem. Soc.)
總結
美國紐約州立大學Christopher J. Johnson和Ming-Yu Ngai課題組發展了首例激發態銅催化的[4+1]環化反應,模塊化實現了一系列α,β-不飽和-γ-內酰胺的合成。此反應條件溫和,底物適用性好,可以兼容一系列復雜天然產物和藥物分子骨架。此外,合成出的產物α,β-不飽和-γ-內酰胺可以經多種合成轉化實現一系列有用雜環的合成。機理研究表明反應經歷了激發態Cu(BINAP)催化,通過單電子轉移、銅物種對自由基中間體的捕獲以及還原消除或質子化過程得到目標產物。此反應的發展為α,β-不飽和-γ-內酰胺骨架的合成提供了新思路。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn