圖1. 光催化次甲基差向異構化(圖片來源:Science)
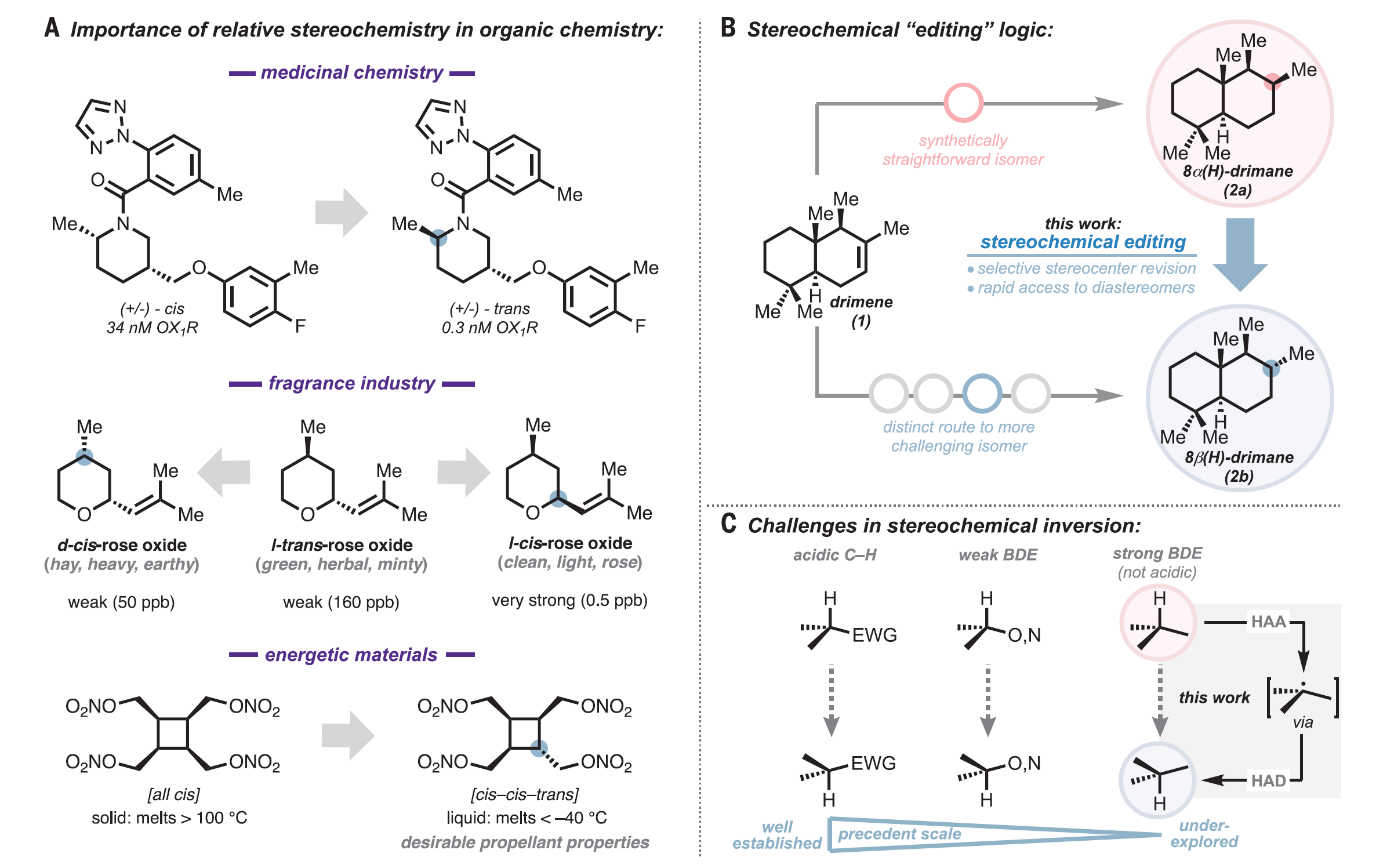
分子中手性中心的構型對于該分子的化學和物理性質起著決定性的作用。特定的立體異構體與手性受體,例如酶和蛋白質等,相比其它立體異構體表現出明顯的相互作用,從而產生關鍵的藥代動力學和藥效上的差異。而對于催化劑和功能材料,非對映異構體的化學和物理性質也有著顯著的差異。然而,當一個分子具有多個手性中心時,改變其中一個手性中心的構型對此分子性質造成的影響往往難以分析。因此,完整地合成一系列立體異構體對于研究相關手性分子的結構-功能關系至關重要。
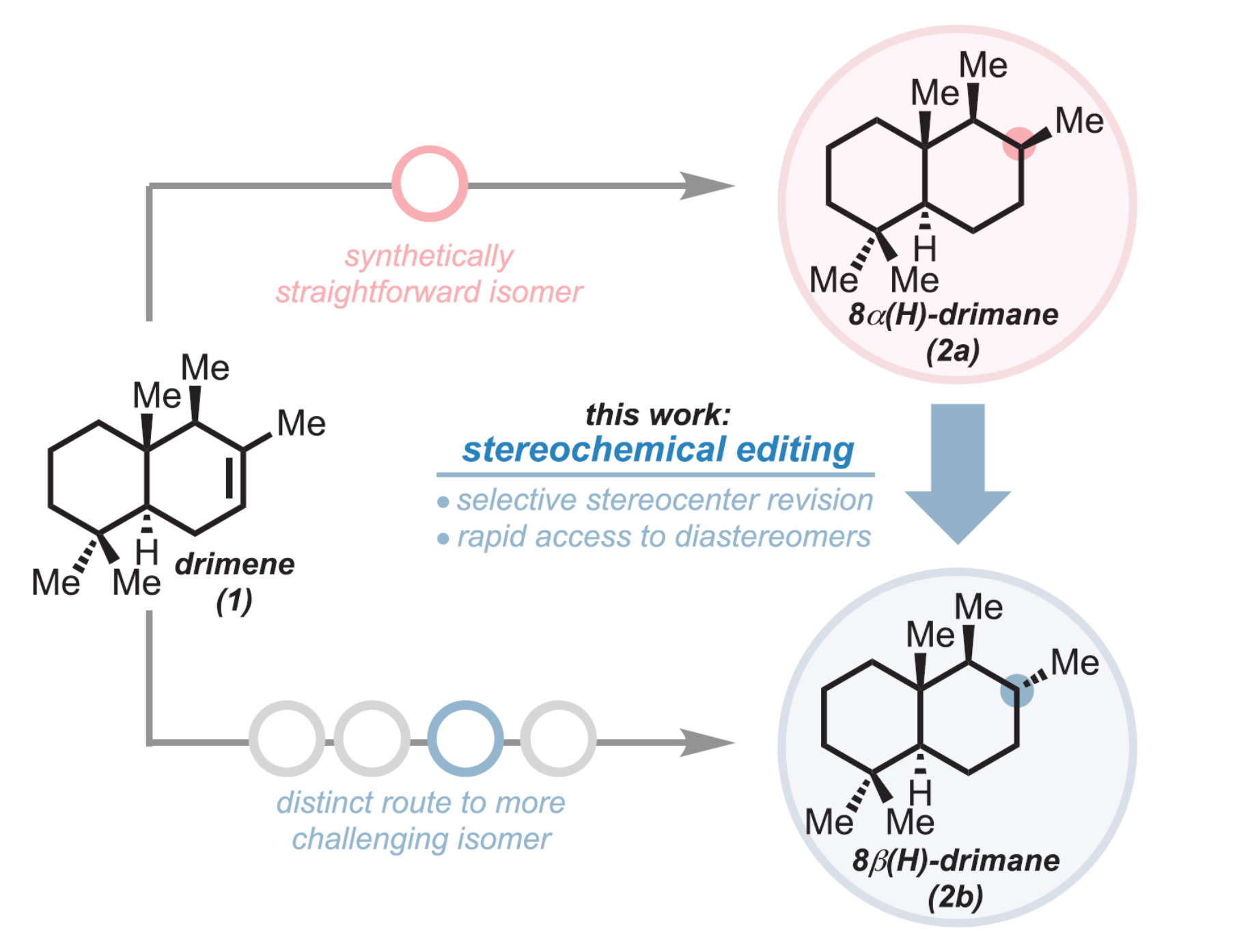
在復雜分子的合成中,立體中心的來源通常是少數高度通用和高度選擇性的化學反應,或者是手性純的起始原料。獲取不同的立體異構體往往需要不同的從頭合成的路線。例如,利用傳統的氫化條件,可以將Drimene(1)選擇性地還原為8α(H)-Drimane(2a),而從相同的原料合成8β(H)差向異構體(2b)需要重新設計路線,并且需要較多步驟(圖2B)。
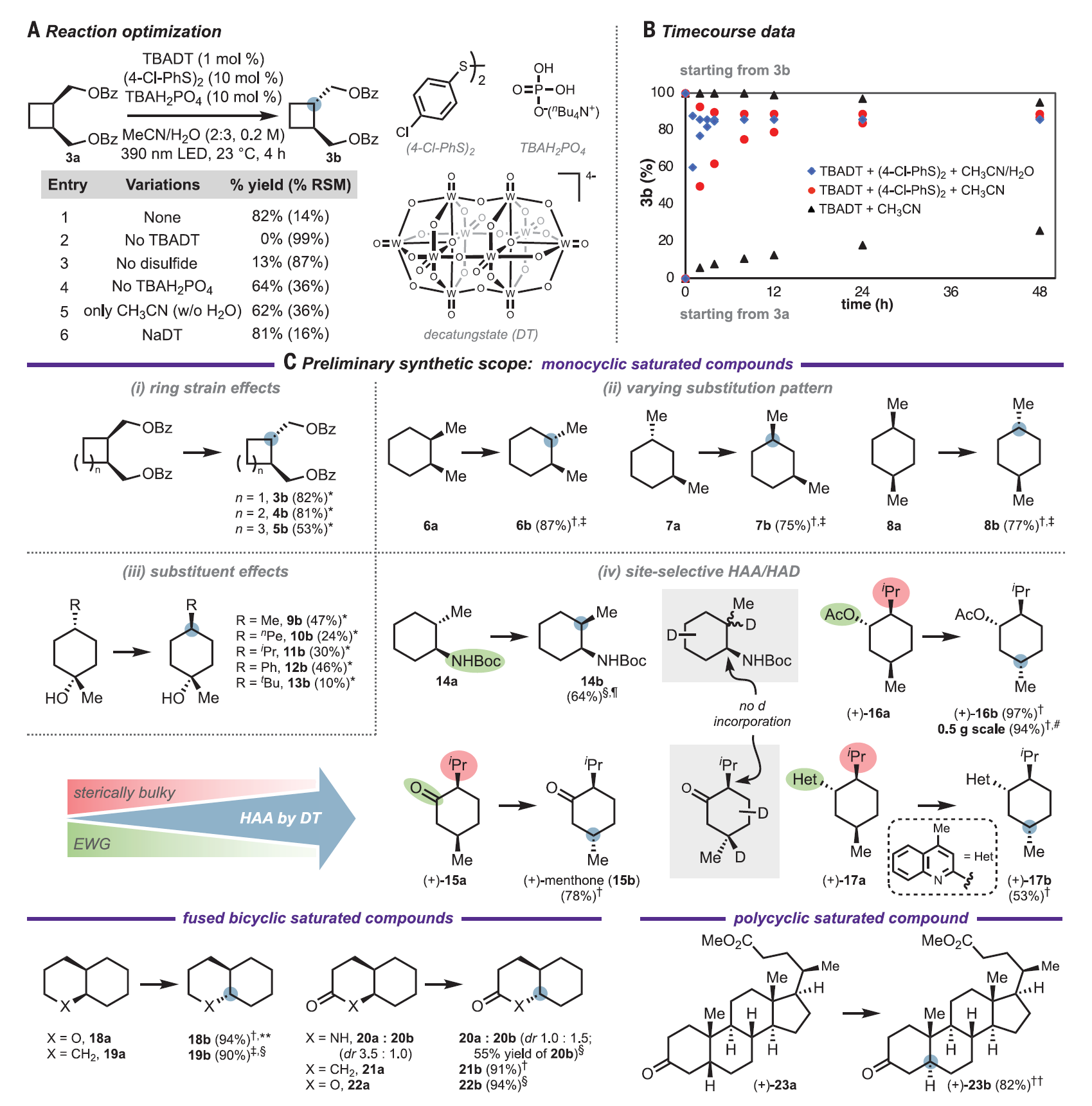
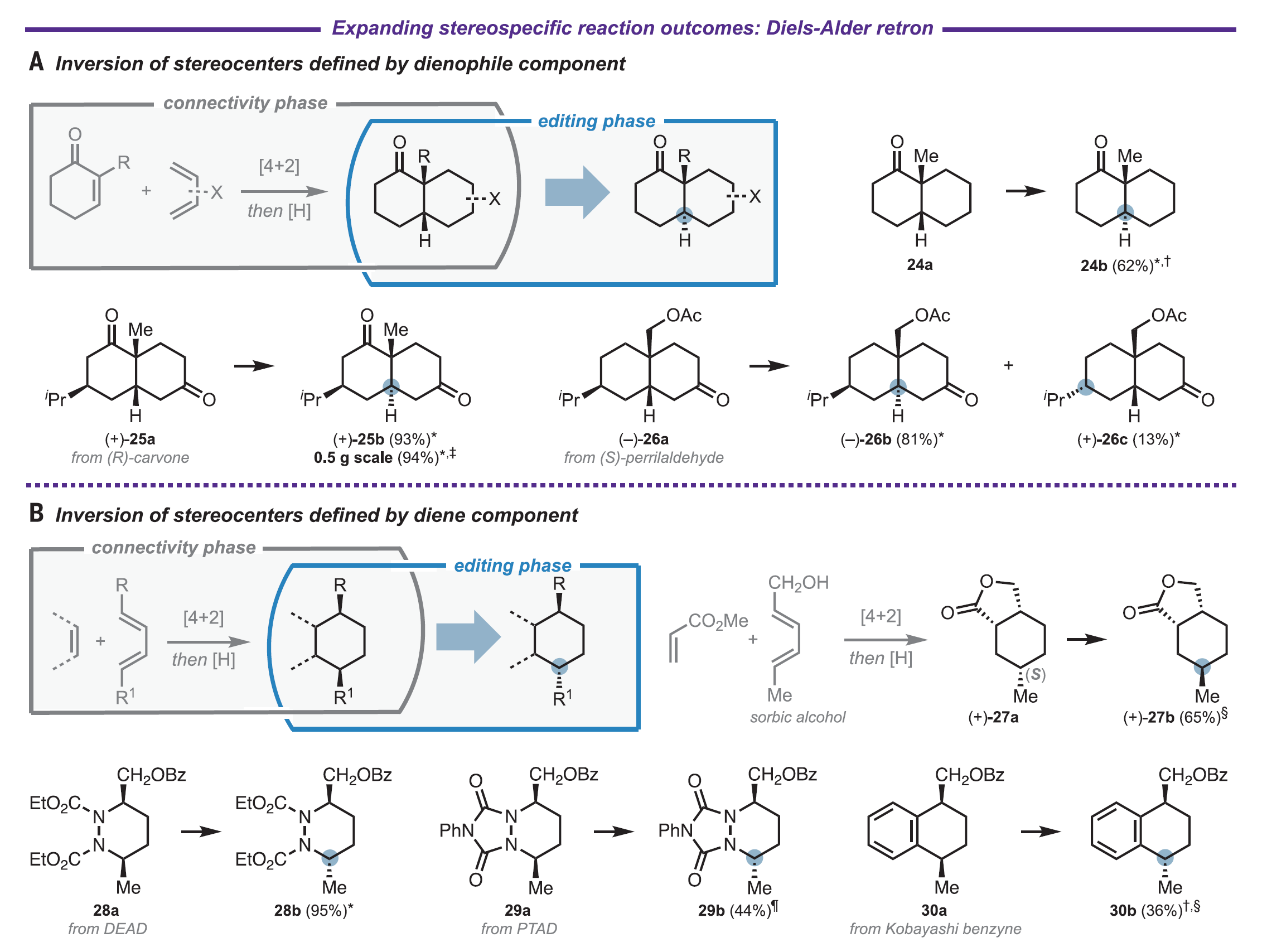
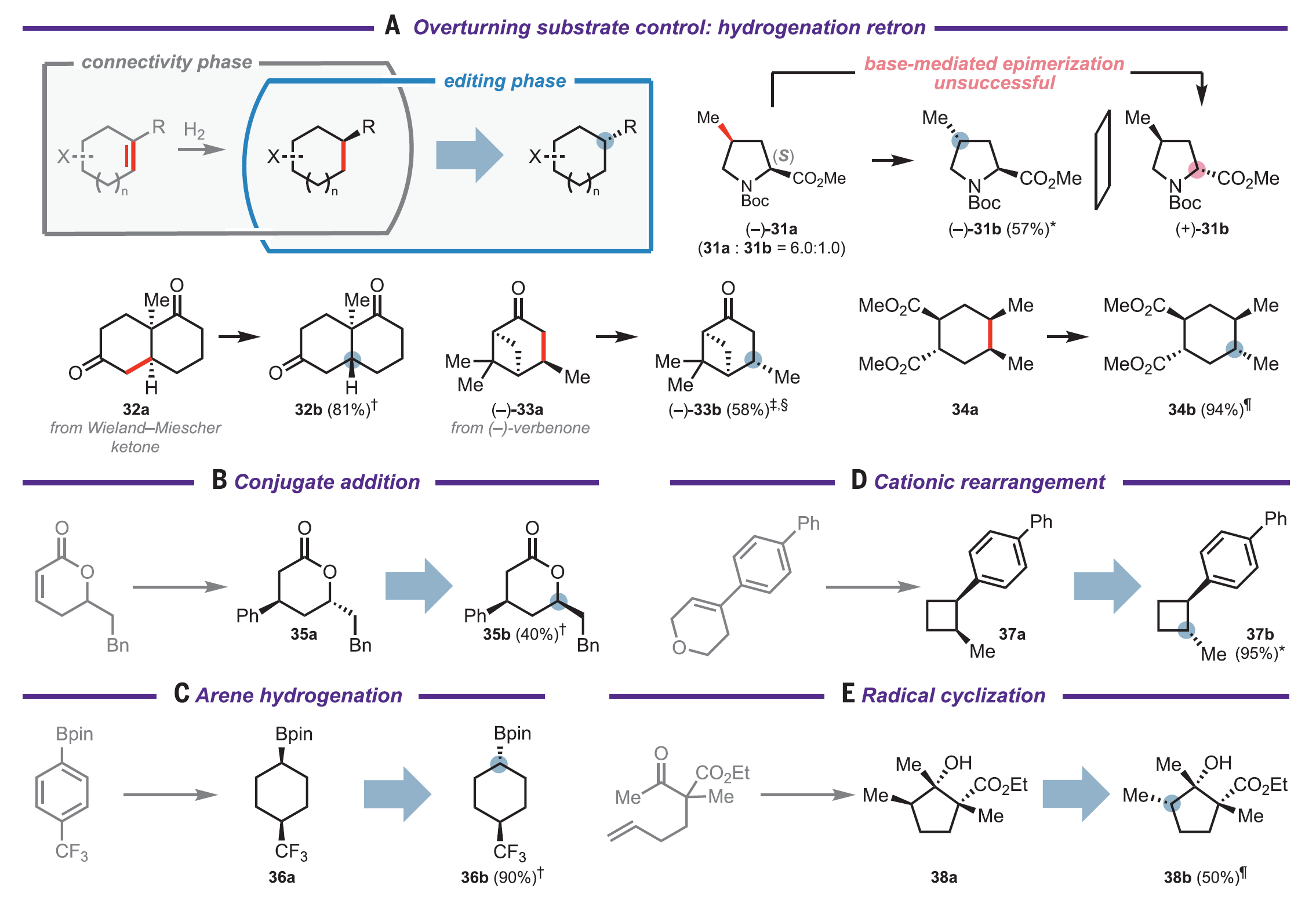
一個簡單的替代方法就是對手性產物進行直接編輯,在后期直接調整其立體化學。與傳統的合成策略相比,這種立體化學編輯方法實現了根本上不同的合成邏輯,即將鍵的形成與立體選擇性的構建分離。原則上,這樣的立體編輯邏輯可以完成:(1)通過非常規的或非選擇性的合成子來制備手性分子。(2)提供了一種覆蓋復雜環境中的強底物控制效應的策略。(3)為分子的后期多樣性修飾提供方法。在此工作中,作者通過識別一種高度通用、廣泛官能團耐受性的催化方法實現了分子中未活化次甲基手性中心構型的相互轉化。酸性C–H鍵(如羰基α-位的C–H鍵)對應立體中心的直接催化相互轉化已經被充分研究。然而強的、疏水性的C–H鍵對應立體中心的選擇性相互轉化,例如惰性次甲基手性中心的立體編輯,仍然是一個未解決的問題。有限的底物范圍,較差的官能團相容性,較長的反應時間,超化學計量試劑的使用和復雜的副產物分布限制了使用光激發酮、HgBr2和過渡金屬試劑等介導的立體編輯的應用。缺乏針對惰性三級立體中心的通用有效立體編輯方法限制了對有機合成中立體編輯邏輯的廣泛探索。作者選用了順式環丁烷3a作為模型底物來探索惰性次甲基立體中心的差向異構化(圖3A)。Combs Walker和Hill之前曾報道過使用十鎢酸鹽(DT)聚陰離子光催化劑將順式十氫化萘差向異構化為反式十氫化萘。然而,在他們的條件下,3b的形成速度非常緩慢。作者根據對不同氫原子受體和供體試劑組成的共催化體系的經驗,篩查了硫醇和二硫化物添加物對于異構化效率的影響。在潛在的氫原子供體下觀察到反應速率提高,例如雙(4-氯苯基)二硫化物(圖3B,紅色)。在使用催化量DT、二硫化物和堿在乙腈/水體系的最佳反應條件下,體系在390 nm LED照射下,于室溫下四小時后達到平衡(圖3B,藍色),以82%的分離收率得到3b。隨后作者以該條件進行了底物拓展。發現此體系可適用于不同大小的的飽和碳環,包括四元環(圖3C, 3b, 82%)、五元環(4b, 81%)以及六元環(5b, 53%)。在六元環體系中,于次甲基對位不同位阻的三級醇均可耐受(9-13b, 10-47%),但當位阻較大時,產率有所下降(13b, 10%)。而對于雙甲基取代的飽和六元環體系,鄰位(6b, 87%)、間位(7b, 75%)和對位(8)取代的底物均可適用于此反應。順式稠合雙環底物(18-22b, 55-94%)以及內固醇((+)-23b, 82%),都可以在反應條件下順利地完成單一次甲基立體構型的翻轉。醇羥基(9b-13b, 10-47%)、叔丁氧羰基保護的氨基(14b, 64%)、醚(3b-5b, 53-82%, 18b, 94%)、酯(22b, 94%, 23b, 82%)以及酰胺(20b, 55%)均可耐受該反應。作者也選取部分底物對反應進行了同位素氘代實驗,發現反應更傾向于發生在富電子和小位阻的位置(14-17b, 53-97%)。圖3. 反應條件優化以及底物拓展(圖片來源:Science)接著,作者展示了此立體編輯方法在合成化學中的應用。運用此反應對于傳統DA反應的順式六元環產物進行立體編輯,可以得到一系列用傳統方法難以構建的非對映異構體(圖4,24b-30b, 36-95%)。而利用此反應編輯一系列具有非對映選擇性的反應的產物,如催化氫化得到的五元環、六元環以及并環產物(31b-34b, 36b, 57-94%)、共軛加成得到的六元內酯(35b, 40%)、碳正離子重排得到的順式環丁烷產物(37b, 95%)和自由基環化得到的環戊烷產物(38b, 50%)時,可以得到相應的非對映異構體(圖5)。作者也將此反應應用在了復雜分子的合成以及后期修飾上(圖6)。運用此反應,作者可以一步以50%的收率從(+)-cedrol (43a)得到(+)-epi-cedrol(43b)。與之對比,之前的合成則需要9步,且是消旋的,總產率也只有7%。從drimene(1)到(–)-8β(H)-drimane(2b),已報道的合成需要4步。而在一步催化氫化得到8α(H)-drimane(2a)后,運用此反應可以以78%的總產率得到2b。而從天然產物(+)-cholic acid 轉化到(+)-45b,已報道的合成需要7步。而在一步酯化以及氧化之后,運用此反應可以以76%的總產率得到(+)-45b,大大縮短了合成步驟且提高了合成效率。圖4. 立體編輯DA反應的產物(圖片來源:Science)圖5. 立體編輯一系列非對映選擇性反應的產物(圖片來源:Science)圖6.立體編輯在復雜分子合成上的應用(圖片來源:Science)麻省理工學院Alison E. Wendlandt 課題組報道了一例室溫光催化次甲基差向異構化反應,反應條件溫和,可以方便地進行分子中未活化的次甲基手性中心構型的相互轉化。此工作為復雜手性分子的合成提供了新的路徑,可以便捷地得到一系列傳統方法難以構建的非對映異構體,為復雜分子的立體編輯提供了一個強有力的工具。