

(圖片來源:Angew. Chem. Int. Ed.)
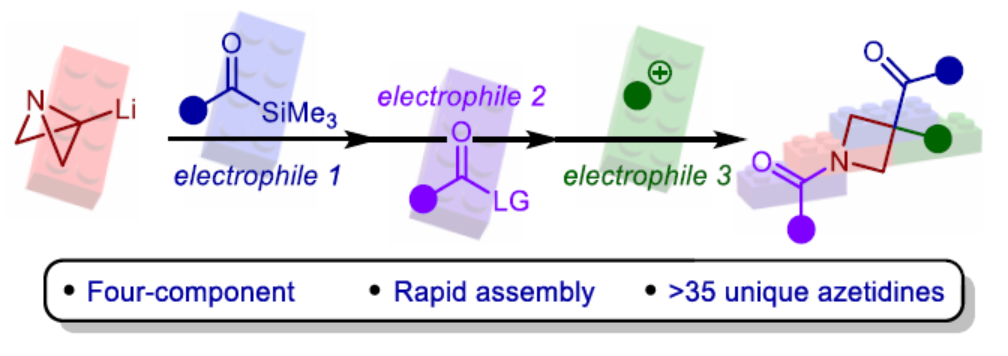
飽和N-雜環化合物是藥物化學中最重要的組成部分之一,例如廣泛存在于藥物中的哌啶、哌嗪和吡咯烷環結構單元。同時,類似的四元N-雜環(氮雜環丁烷)具有一系列理想的特征,如結構剛性、改善的溶解度和對代謝降解的抵抗力,與較大的環類似物相比,這大大提高了臨床成功的機會。雖然氮雜環丁烷單元在藥物化合物上具有一定的價值,但對于氮雜環丁烷衍生物的模塊化和發散性合成方法仍有待進一步的研究。2012年,Marcaurelle課題組報道了一種以β-氨基醇為底物,經5步反應,實現了氮雜環丁烷衍生物的合成,隨后通過進一步的反應(6-9步),構建了螺環骨架(Figure 1ai)。前期,Aggarwal課題組開發了一種以ABB(2)為底物,通過去質子化過程,可生成ABB-Li(1)。1與酮化合物經偶聯,可生成雜雙環[1.1.0]丁基卡賓,隨后經張力釋放驅動的半頻哪醇重排,可獲得酰基-氮雜環丁烷(Figure 1aii)。雖然此策略代表了一種模塊化的合成方法,但親電試劑的種類取決于其活化氮雜雙環的能力,使得酮化合物的選擇成為唯一的變化點。
為了進一步擴展反應的范圍,Aggarwal課題組設想了一種多組分的方法,通過利用ABB-Li與酰基硅烷偶聯的反應性來合成多種1,3,3-三取代氮雜環丁烷衍生物(Figure 1b)。由1,2-加成生成的醇鹽中間體經歷[1,2]-Brook重排,生成碳負離子,該碳負離子應立即裂解(collapse),以打開氮雜雙環[1.1.0]丁烷(ABB)單元的中心鍵。同時,根據Anderson和Duarte課題組的最近研究成果,開環具有低動力學能壘和強熱力學驅動力,有利于氮雜環丁烷產物的生成。陰離子接力也應推動Brook重排向碳負離子的平衡,而在傳統上需要陰離子穩定基團的存在。然后,酰胺鋰3有可能在氮原子處與親電試劑(E2)反應,并在新引入的硅基烯醇醚處與另一種基于碳或雜原子的親電試劑(E3)反應,從而得到氮雜環丁烷(5)。近日,英國布里斯托大學Varinder K. Aggarwal課題組報道了一種多組分[1,2]-Brook重排/張力釋放驅動的陰離子接力串聯的策略,并成功應用于取代氮雜環丁烷的模塊化合成。

(圖片來源:Angew. Chem. Int. Ed.)
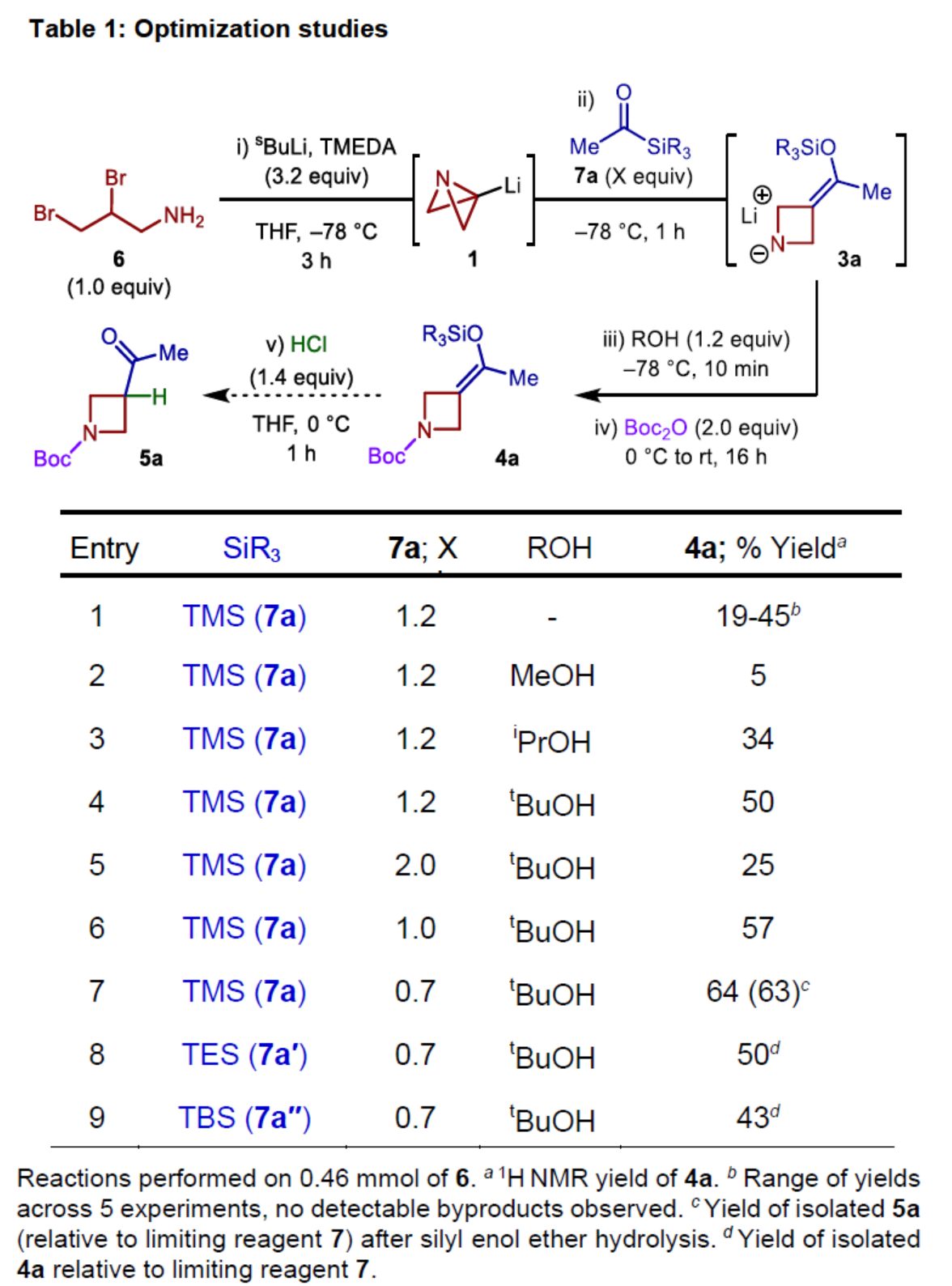
首先,作者以二溴胺衍生物6作為模型底物,進行了相關反應條件的篩選(Table 1)。反應的最佳條件為:6在TMEDA/sBuLi條件下于THF溶劑中-78oC反應3 h,再加入7a繼續于-78oC下反應1h。然后,加入ROH在-78 oC下繼續反應10 min,再加入Boc2O在0 oC-室溫下反應16 h,可以64%的收率得到氮雜環丁烷產物4a。
(圖片來源:Angew. Chem. Int. Ed.)
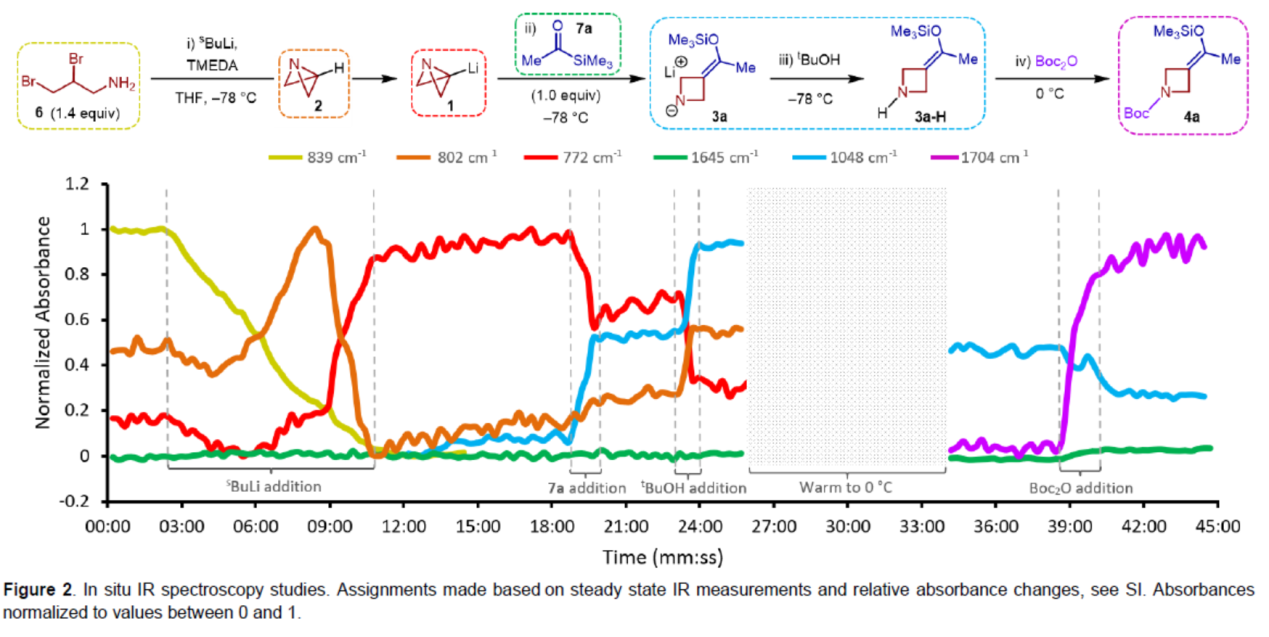
為了進一步了解反應的速率,作者進行了原位紅外光譜法的研究(Figure 2)。首先,6與sBuLi反應可生成ABB-Li(1)。其中,在完全轉化為1(772 cm-1)之前,6(839 cm-1)的消耗伴隨著802 cm-1處(2)瞬態峰的出現。1(772 cm-1)的吸收表明,在加入酰基硅烷7a時,出現部分信號消失,同時在1048 cm-1處生成新的信號峰,歸因于3a。有趣的是,7a反應如此迅速,以至于在實驗的時間上沒有觀察到羰基伸縮峰(1645 cm-1)。一旦7a添加完成,就達到穩定狀態,表明[1,2]-Brook重排/張力釋放驅動的陰離子接力串聯以及ABB的開環是一個幾乎無障礙的過程。tBuOH的加入導致1048 cm-1的吸收強度增加,表明3a質子化形成3a-H,過量的1(772 cm-1)淬滅以再生2(802 cm-1)。在升溫至0 oC(在此期間所有波數的相對吸收都受到固有影響)后,加入Boc2O,導致1048 cm-1處的峰強度降低。這與產物羰基伸縮峰(1704 cm-1)的增加同時發生,在3分鐘內達到最大強度。綜上所述,本研究清楚地證明了反應的快速性,表明了反應發生的總時間幾乎完全取決于試劑的添加速率。
(圖片來源:Angew. Chem. Int. Ed.)
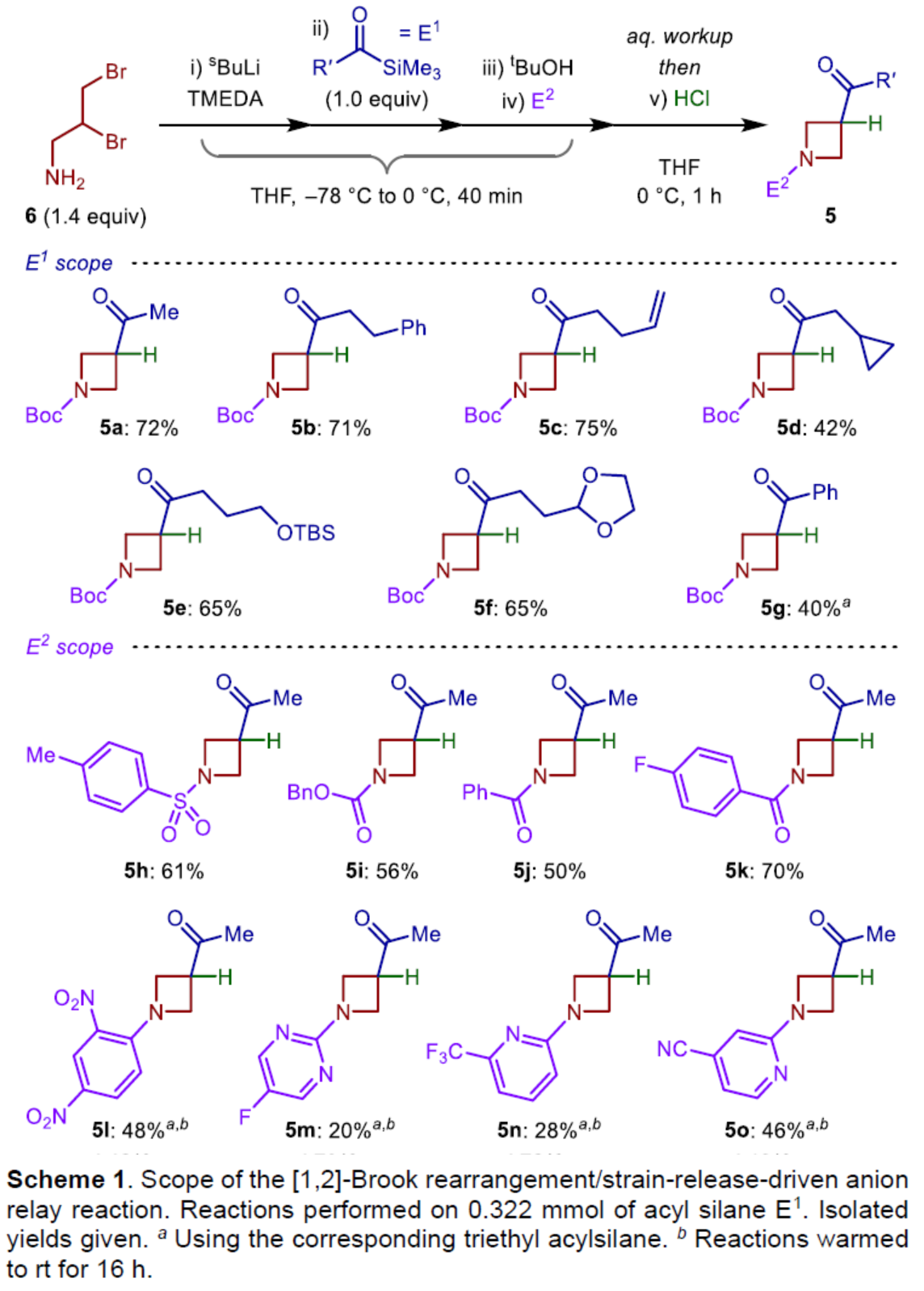
在獲得上述最佳反應條件后,作者對E1和E2底物范圍進行了擴展(Scheme 1)。首先,當底物E1中的R’為烷基與苯基時,均可順利反應,獲得相應的產物5a-5g,收率為40-75%。其次,當E2為TsCl、CbzCl、苯甲酰氯、芳基鹵化物時,均與體系兼容,獲得相應的產物5h-5o,收率為20-70%。
(圖片來源:Angew. Chem. Int. Ed.)
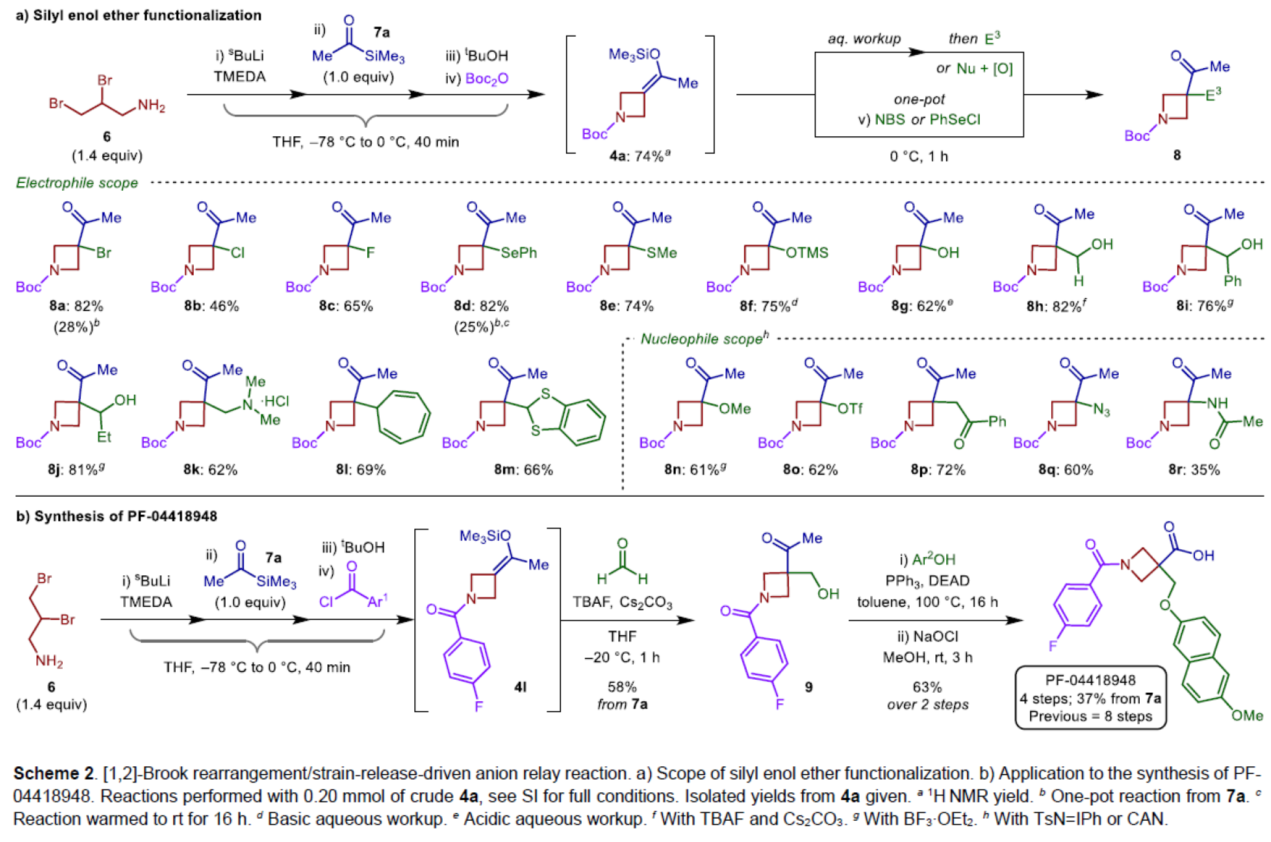
緊接著,作者對親電與親核試劑的底物范圍進行了擴展(Scheme 2a)。首先,一系列不同取代的親電試劑,均可順利進行反應,獲得相應的產物8a-8m,收率為46-82%。同時,該反應具有良好的官能團兼容性。其次,一系列不同的親核試劑,也與體系兼容,得相應的產物8n-8r,收率為35-72%。
最后,作者通過對靶向口服活性和選擇性EP2受體拮抗劑PF-04418948的合成,進一步證明了反應的實用性(Scheme 2b)。以二溴胺衍生物6為初始底物,在上述的四組分[1,2]-Brook重排/張力釋放驅動的陰離子接力的串聯過程后,可以58%的收率得到關鍵的氮雜環丁烷化合物9。9與6-甲氧基-2-萘酚進行Mitsunobu偶聯反應,再通過鹵化反應,可將甲基酮轉化為相應的羧酸,經過4步反應(文獻中需8步反應),總收率為37%,只需要2次色譜純化。
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn