



硫和氟是藥物分子中主要的組成元素之一。含硫藥物可用于治療細(xì)菌感染、糖尿病、癌癥、艾滋病和許多其它臨床疾病。含氟生物活性化合物的有益藥代動(dòng)力學(xué)特性包括高代謝穩(wěn)定性、通常低極性和可能改變藥物的酸堿性質(zhì)。因此,既含硫又含氟的藥物將會(huì)越來(lái)越多。
目前,人們對(duì)二氟甲基硫醇和三氟甲基硫醚類藥物的應(yīng)用非常感興趣。考慮到-CF3在修飾藥物的極性、溶解度和代謝穩(wěn)定性方面具有優(yōu)異的性能,同時(shí)構(gòu)建-CF3和含硫基團(tuán)是一種具有復(fù)雜生物活性和精細(xì)藥代動(dòng)力學(xué)特性的現(xiàn)代藥物設(shè)計(jì)方法。C-S鍵和C-F鍵的構(gòu)建一直是合成化學(xué)的熱點(diǎn)話題,對(duì)于它們的手性控制更是重中之重。作者提出了一個(gè)含-CF3的手性硫化合物的不對(duì)稱合成方法。該方法可通過(guò)烯丙基α-CF3硼酸的硫代官能團(tuán)化來(lái)實(shí)現(xiàn)。
盡管已經(jīng)有報(bào)道說(shuō)鈀可以催化烯丙基硫化并用于合成手性烯丙基硫化物。但當(dāng)α-CF3存在時(shí),硼酸基團(tuán)會(huì)與Pd在-CF3的α位形成M-L鍵,進(jìn)而發(fā)生β-F消除。因此,必須避免在碳立體中心上積累負(fù)電荷。于是,作者選擇了通過(guò)Lewis堿穩(wěn)定的硫氮離子作為硫化試劑。該方法可高效合成各種芳基、烷基和三氟甲基硫醚,具有較高的選擇性。
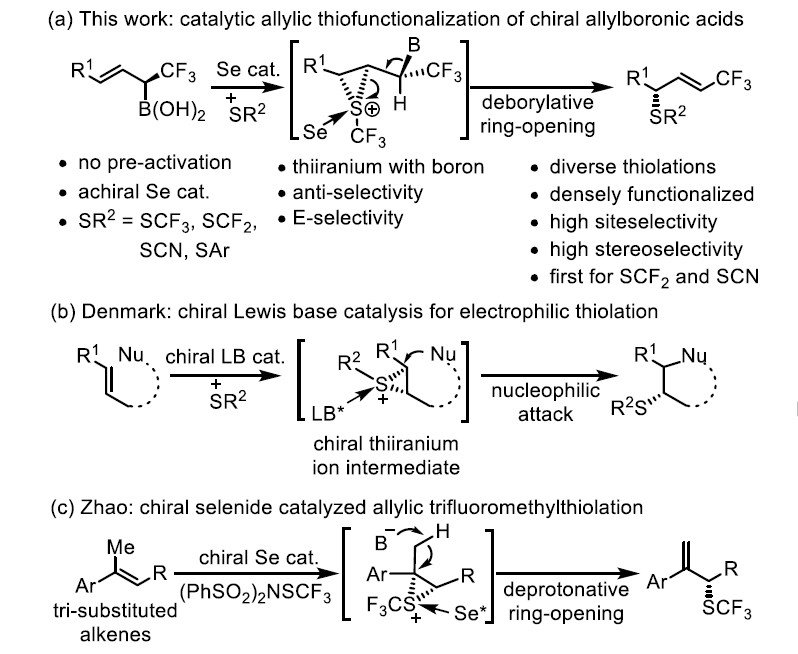
圖1. 研究背景(圖片來(lái)源:Angew. Chem. Int. Ed.)
隨后,作者以1a-Bpin和2a為模型底物進(jìn)行了條件篩選。最終確定最佳條件為在Tf2NH作為酸且Ph2Se作為催化劑時(shí),可以在-20 ℃的條件下以81%的產(chǎn)率與98%/100%的ee/es得到目標(biāo)產(chǎn)物。
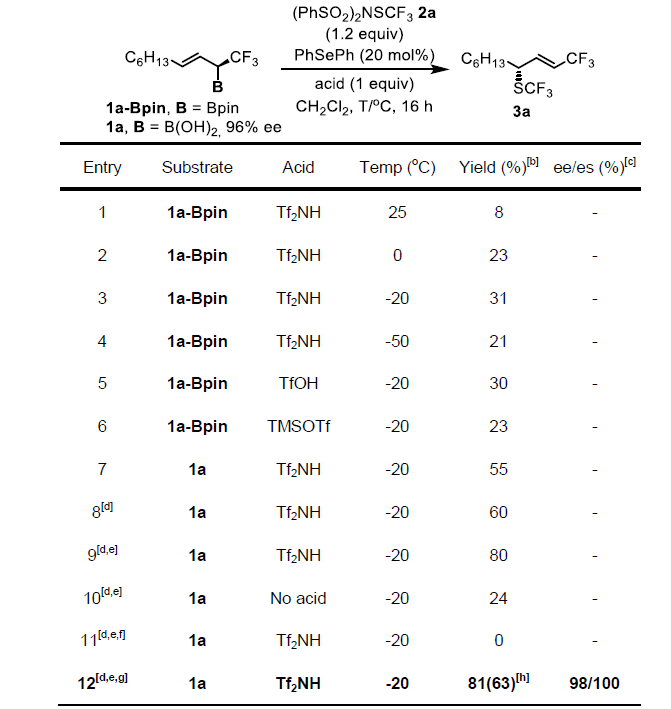
圖2. 條件篩選(圖片來(lái)源:Angew. Chem. Int. Ed.)
作者在上述最佳反應(yīng)條件下進(jìn)行了底物拓展,發(fā)現(xiàn)反應(yīng)具有極好的官能團(tuán)耐受性。用芐基(1b)取代烷基 (1a)并不會(huì)改變反應(yīng)的結(jié)果。1c中的-Cl可以保持較高的非對(duì)映性和位點(diǎn)選擇性,但ee下降到88%。1d的酯基在反應(yīng)中不受影響,使3d具有很高的選擇性,為后續(xù)反應(yīng)提供了兩個(gè)可能的位點(diǎn)。苯酞酰亞胺衍生物1e可以轉(zhuǎn)化為3e,它包含了藥物設(shè)計(jì)的所有6個(gè)主要元素,有很大的機(jī)會(huì)進(jìn)行進(jìn)一步的不對(duì)稱轉(zhuǎn)化,這個(gè)過(guò)程還可以檢測(cè)到α-SCF3產(chǎn)物的生成,X-射線衍射法可以確定晶體3e的絕對(duì)構(gòu)型為(S)。考慮到結(jié)構(gòu)的相似性和反應(yīng)條件,作者在此基礎(chǔ)上,初步確定了其它硫化產(chǎn)物的構(gòu)型。作者預(yù)測(cè)在環(huán)己基(1f)被苯基(1g)取代的情況下,1f具有很高的非對(duì)映和對(duì)映選擇性。然而,由于烯丙基重排破壞了1g的共軛體系,預(yù)計(jì)反應(yīng)性和位點(diǎn)選擇性會(huì)降低。實(shí)際上,在原本條件下雖然可以得到3g但收率很低,如果將催化劑改為(p-OMePh)2Se,用MsOH作為活化劑,可以53%的產(chǎn)率得到3g。作者還試圖獲得3g的類似物,但得到的是一系列混合物,可能是烯丙基硼酸在該反應(yīng)條件下不穩(wěn)定所致。另外,在標(biāo)準(zhǔn)條件下,帶有大位阻叔丁基的化合物1h可以64%的產(chǎn)率得到產(chǎn)物3h且反應(yīng)的對(duì)映選擇性、非對(duì)映選擇性和位點(diǎn)選擇性均很好,這說(shuō)明大位阻的烯基取代基并不影響反應(yīng)的選擇性。
二氟甲基硫醇的合成與修飾是現(xiàn)代藥物設(shè)計(jì)中一顆冉冉升起的新星。-SF2H是羥基和硫醇官能團(tuán)的生物等排體,而基于Lewis堿催化的不對(duì)稱親電二氟甲基硫化反應(yīng)尚未見(jiàn)報(bào)道,手性-SCF2R的合成也無(wú)先例。上述不對(duì)稱三氟甲基硫化反應(yīng)的成功啟發(fā)作者將同樣的概念拓展到極具挑戰(zhàn)性的二氟甲基硫化反應(yīng)。在這類反應(yīng)中,作者使用了由Billard課題組之前報(bào)道的苯胺基二氟甲基化試劑2b-c,并使用了更富電子的(p-OMePh)2Se催化劑以使反應(yīng)更高效。此外,還需要過(guò)量的酸添加劑來(lái)抑制苯胺的親核胺化。脂肪族烯丙基硼酸衍生物1a可以得到完全經(jīng)過(guò)烯丙基重排反應(yīng)的手性SCF2COOEt產(chǎn)物4a,該反應(yīng)產(chǎn)率良好(60%),具有顯著的立體、非對(duì)映和區(qū)域選擇性。對(duì)于芐基和環(huán)己基烯丙基硼酸底物1b和1f來(lái)說(shuō),雖然它們的產(chǎn)率略低,但具有很高的選擇性。
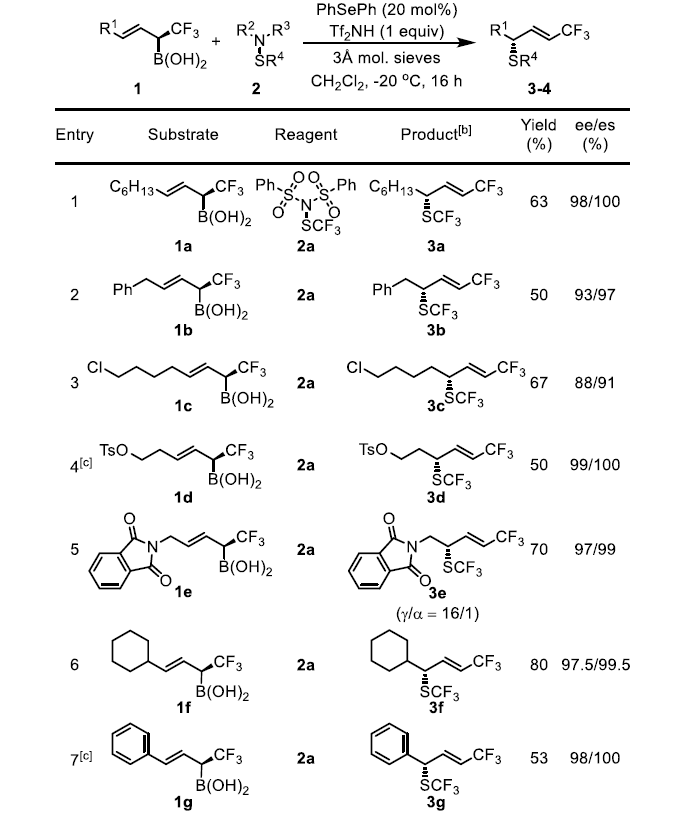
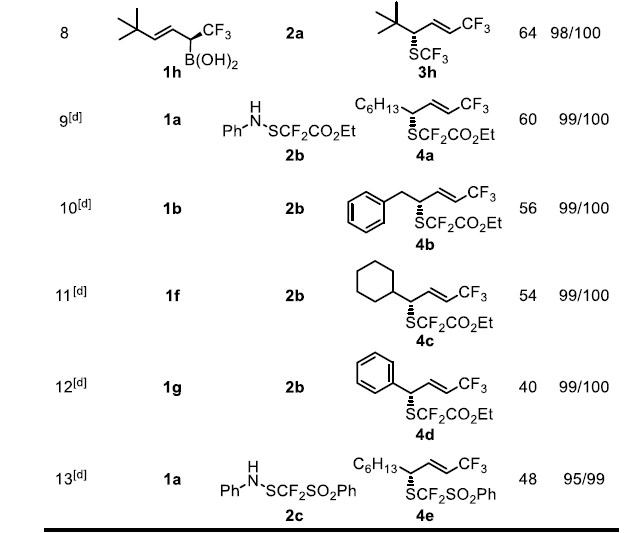
圖3. 底物拓展一(圖片來(lái)源:Angew. Chem. Int. Ed.)
考慮到硒催化烯丙基硼酸的轉(zhuǎn)化通常具有良好的收率和非常高的選擇性,作者試圖將這一概念擴(kuò)展到其它硫化反應(yīng)。有機(jī)硫氰酸酯很容易轉(zhuǎn)化為各種含硫藥物中間體,但很少有方法可以實(shí)現(xiàn)它的不對(duì)稱合成。作者使用SCN轉(zhuǎn)移試劑2d在(p-OMePh)2Se存在下實(shí)現(xiàn)了烯丙基硫氰化反應(yīng)。作者還研究了芳基硫代反應(yīng),但其區(qū)域選擇性明顯低于其它缺電子硫基團(tuán)(-SCF3、-SCF2R或-SCN)。此外,作者還發(fā)現(xiàn)類似的溴化反應(yīng)和氯化反應(yīng)同樣可以進(jìn)行,但是氟化反應(yīng)和碘化反應(yīng)的結(jié)果復(fù)雜,無(wú)法分離出單一的目標(biāo)產(chǎn)物。
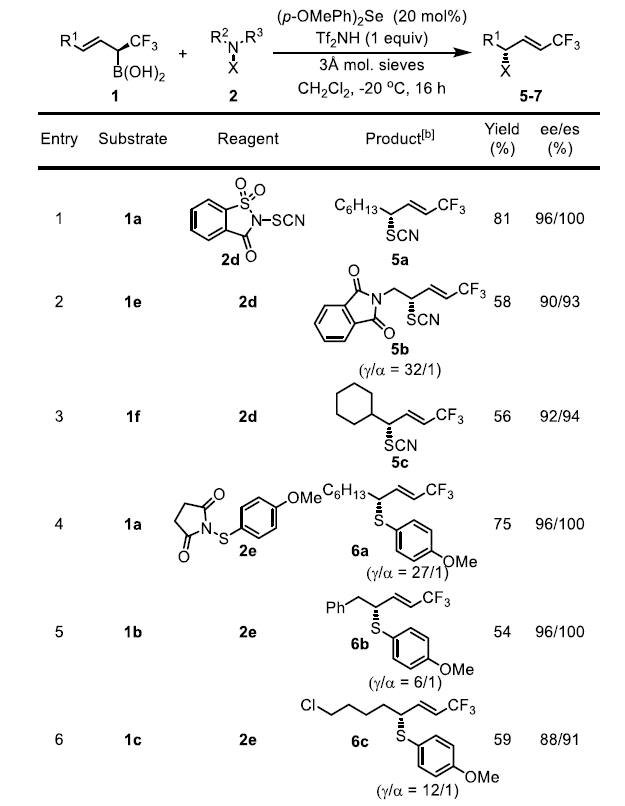
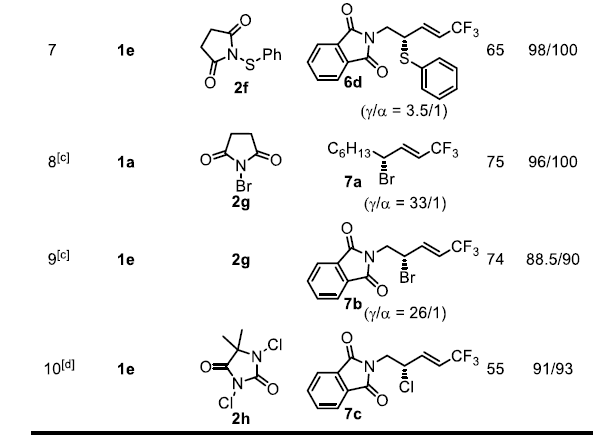
圖4. 底物拓展二(圖片來(lái)源:Angew. Chem. Int. Ed.)
基于上述結(jié)果和文獻(xiàn)報(bào)道,作者提出如下反應(yīng)機(jī)理。首先,Ph2Se和2a反應(yīng)生成硒氮離子8。隨后,8與1反應(yīng)生成硫氮離子9,其中硫和硼酸酯中氧原子的相互作用基決定了該中間體的穩(wěn)定性,又決定了反應(yīng)的立體選擇性。由于1e立體中心的絕對(duì)構(gòu)型為(S),說(shuō)明生成雙鍵前硫鎓離子與-CF3處于反位。隨后。親核試劑(PhSO2)2NH的加入導(dǎo)致了去硼開(kāi)環(huán)反應(yīng)的發(fā)生,并經(jīng)過(guò)反式消除得到目標(biāo)產(chǎn)物3。
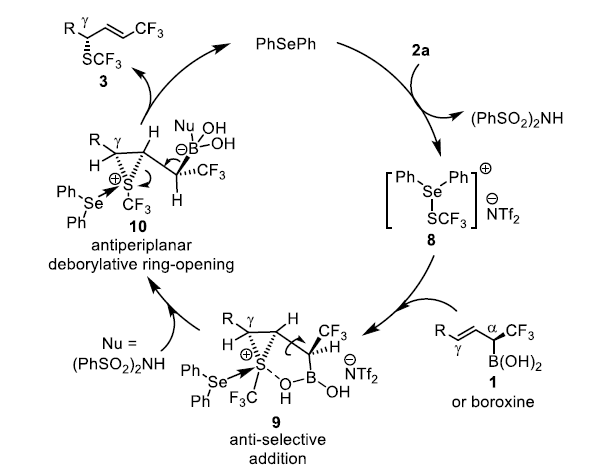
圖5. 反應(yīng)機(jī)理(圖片來(lái)源:Angew. Chem. Int. Ed.)
總結(jié) Kálmán J. Szabó課題組開(kāi)發(fā)了一種高對(duì)映選擇性、非對(duì)映選擇性和位點(diǎn)選擇性的方法,該方法適用于合成含-CF3基團(tuán)的一些含硫化合物和含一個(gè)或多個(gè)用于進(jìn)一步立體選擇性衍生化手柄的密集功能化SCF3、SCF2R、SCN和SAr化合物,補(bǔ)充了手性-SCF2R和-SCN合成的空白。作者希望該反應(yīng)可以用于設(shè)計(jì)包含所有6種基本元素(C, H, O, N, S, F)的多功能藥物和合成含硫天然產(chǎn)物。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn