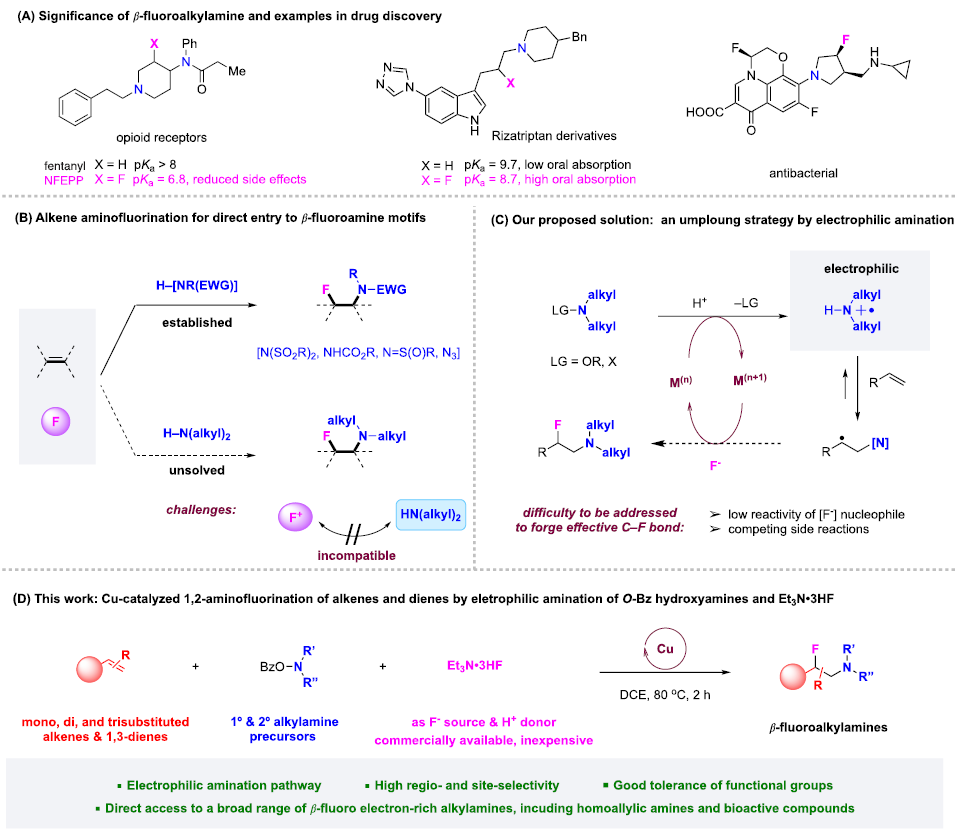
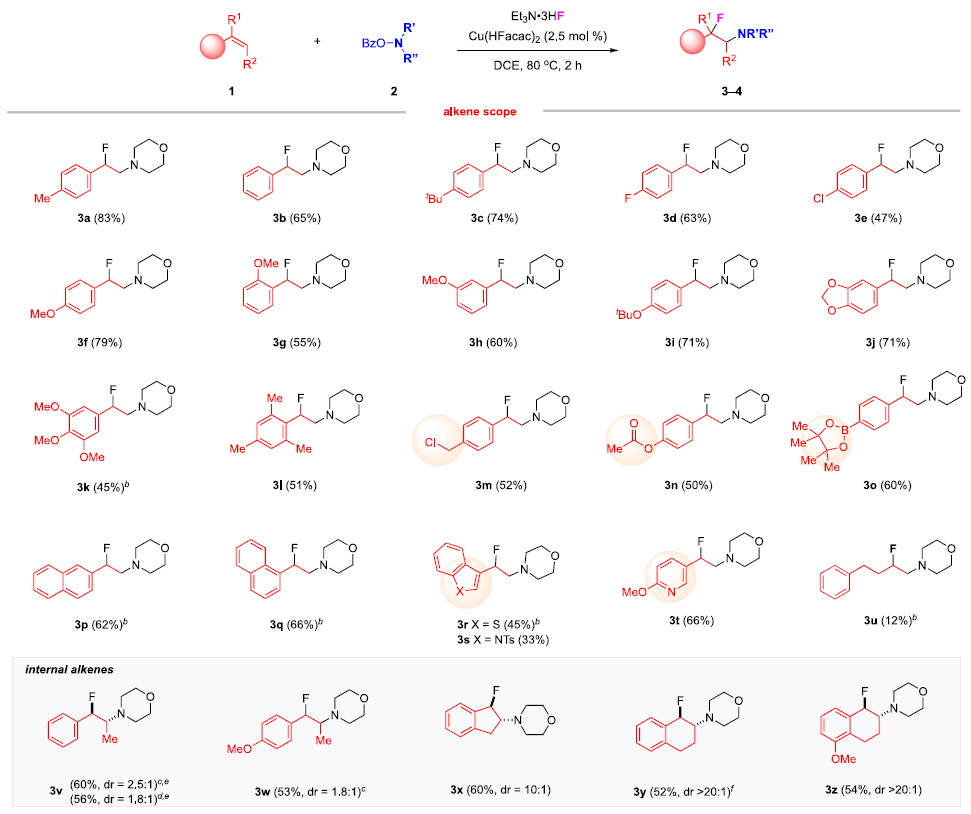
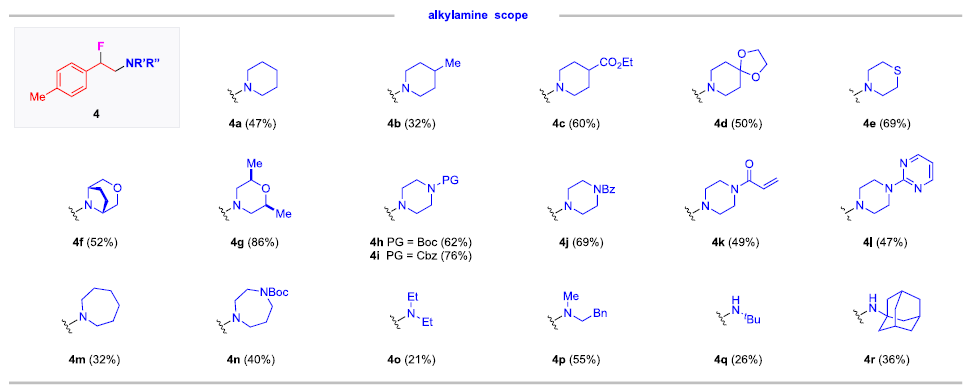
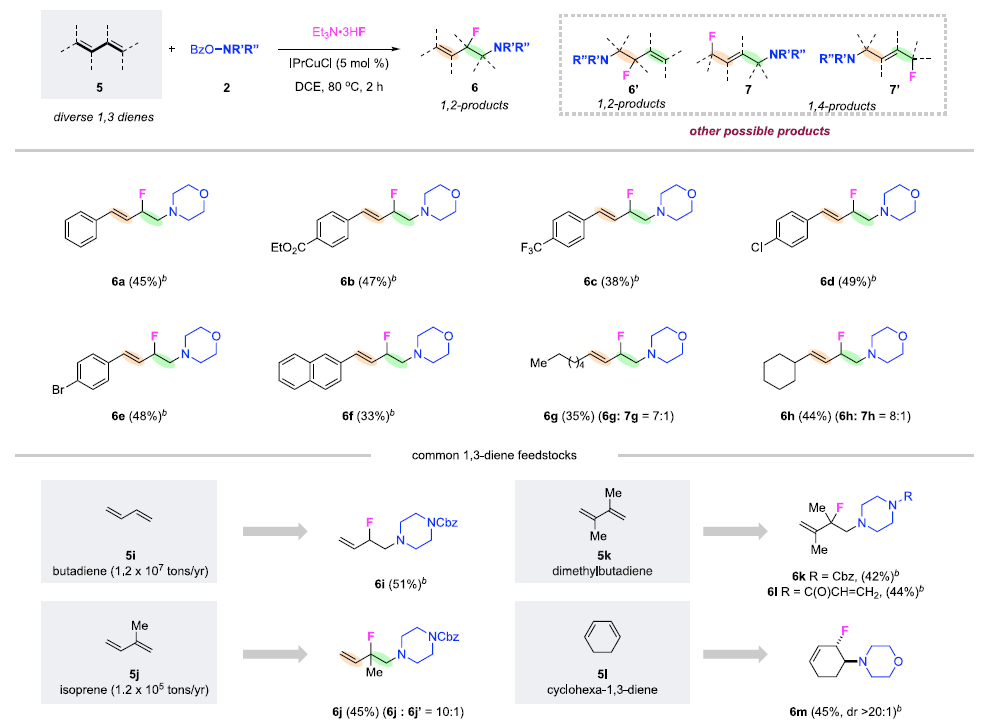
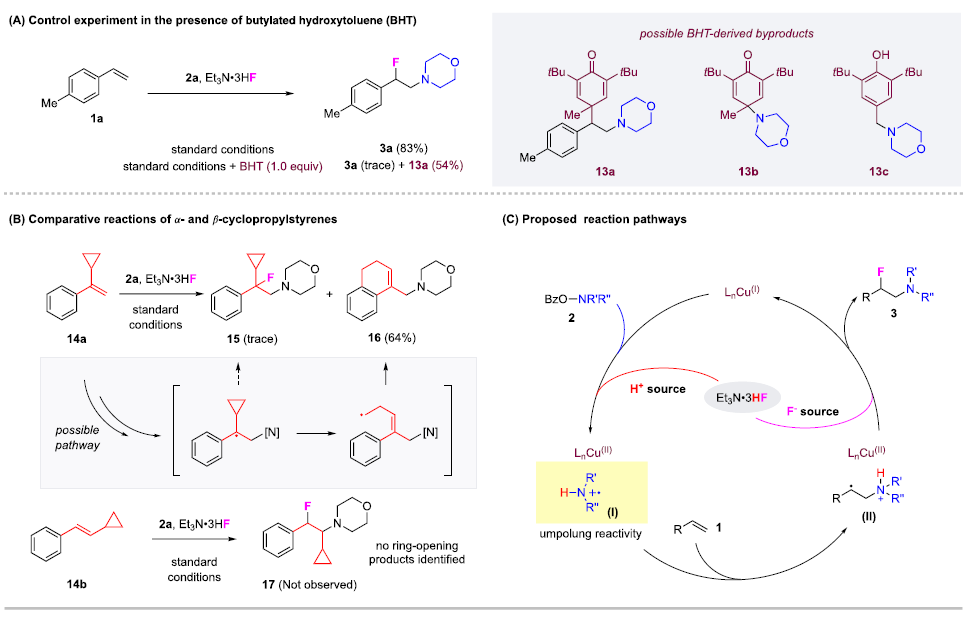
快速、高效地合成具有生物活性的新型含氮化合物在生物醫學研究和藥物開發中具有極其重要的意義。在含胺化合物中引入氟是藥物化學和藥物發現的一個有力策略,可以有效地影響其構象、pKa、物理化學性質、生物和藥代動力學特性。特別是氨基的β-氟化修飾可以極大地調節鄰近氨基的堿度,顯著增強生物利用度、親脂性和生物活性。烯烴的1,2-氨基氟化反應是一種合成β-氟烷基胺的理想策略。近年來,烯烴氨基氟化反應的研究得到了廣泛發展,但是底物的范圍僅限于特定的缺電子胺,為獲得真正有藥用價值的分子仍需進行復雜的后續轉化。考慮到富電子烷基胺與親電氟化試劑固有的不相容性,使用傳統思路一步合成β-氟烷基胺從根本上存在挑戰。作者提出,可以通過使用雜原子取代的烷基胺前體(LG?NR2)對烯烴進行親電胺化后再與親核氟源偶聯。作者此前利用這一策略實現了銅催化的烯烴氨基氧化反應。Morandi課題組也報道了鐵催化氨基氯化反應的例子。雖然該策略代表了烯烴胺化的新方向,但與不同親核試劑的組合卻很有挑戰性。一方面是瞬時氮或碳自由基的高反應性極易發生降解等副反應;另一方面,F-在質子溶劑中的親核性較低,不易參與反應。于是,作者使用現成的N,N-二烷基羥胺作為富電子烷基胺的前體,選用Et3N·3HF作為親核試劑,它不僅可以作為氟化劑,還可以作為質子源形成氨基自由基。這項工作首次實現了β-氟烷基胺的一步合成,在含β-氟胺藥物、天然產物和生物活性化合物的快速合成中具有重要的應用價值。圖1. 研究背景(圖片來源:J. Am. Chem. Soc.)隨后,作者以4-甲基苯乙烯1a和2a作為模型底物進行了條件篩選。首先,作者對氟源進行篩選,并最終確定為Et3N·3HF。在此條件下可以觀察到副產物3a',這是由BzO-的親核加成生成的,同時作者還證實了3a'并不是反應的關鍵中間體,且當過量的Et3N·3HF(10當量)存在時可以有效抑制3a'的形成。接下來,作者又對離去基團和銅催化劑進行了篩選,最終確定苯甲酸A和2.5 mol %的Cu(Hacac)2效果最好,可以以82%收率得到目標產物。圖2. 條件篩選(圖片來源:J. Am. Chem. Soc.)作者在上述最佳反應條件下進行了底物拓展。首先,作者用2a測試了烯烴的適用范圍,發現各種官能團的耐受性都很好。從吸電子基團(3d-3e)、給電子基團(3f-3k)、位阻大的基團(3l),到一些活潑官能團 (3m-3o) 、苯并噻吩(3r)、吲哚(3s)和吡啶(3t)等其雜環底物也能順利地生成相應產物。作者還嘗試了簡單烷基取代烯烴的反應,但只以12%的收率得到3u。不只是末端烯烴,內烯也能生成對應產物(3v?3z)。在無環內烯 (3v?3w)的反應中只觀察到中等水平的非對映選擇性,而環烯烴(3x?3z)的反應則獲得了較高的非對映比(高達20:1)。作者同樣測試了烷基胺的適用范圍。不同含哌啶的胺化試劑的反應可以得到不同的對應產物。4b(產率32%)和4c-4d(產率50-60%)之間的差距表明,哌啶上的吸電子取代基對反應有促進作用。其它六元環胺底物(4e-4l)也適用于該反應。七元環胺底物產率較低,分別以32%和40%的產率得到了4m和4n。最后,無環羥胺底物(4o和4p)也可以參與反應。該方法甚至適用于仲胺(4q-4r)的直接生成,大大擴展了可獲得的β-氟烷基胺的種類。圖3. 底物拓展一(圖片來源:J. Am. Chem. Soc.)作者還探究了1,3-二烯的氨基氟化反應。這類底物對該反應提出了更高要求。首先,兩個碳碳雙鍵的存在導致反應可以發生在兩個不同位置;第二,反應既可以發生1,2-加成,也可以發生1,4-加成。因此,1,3-二烯的氨基氟化反應可能產生1,2-加成產物6和6'以及1,4-加成產物7和7'等一系列同分異構體。作者針對該底物再次進行條件篩選發現IPrCuCl(5.0 mol%)是最有效的催化劑。隨后作者對1,3-二烯進行了底物拓展。雖然產率普遍較低,但可以很明顯發現反應更傾向于得到1,2-加成的產物。圖4. 底物拓展二(圖片來源:J. Am. Chem. Soc.)最后,作者對該反應的機理進行探究。為了探測反應中是否涉及自由基中間體,在存在BHT作為自由基捕獲劑的情況下,使用1a和2a進行對照實驗。其中,以54%的收率生成了BHT加成物13a,這表明在標準反應條件下生成了穩定的碳自由基中間體。13b和13c均未檢測到,表明不存在長壽命的親核氮自由基。此外,作者利用14a和14b進行了自由基鐘實驗。在標準條件下,14a只產生了微量的氨基氟化產物15,而以64%的收率得到了開環產物16,這有力地證明了該反應是通過自由基機理進行的。相比之下,14b的反應沒有產生預期的產物17,也沒有檢測到任何開環副產物。作者認為1,2-雙取代烯烴的位阻可能抑制了反應。根據實驗結果和相關研究,作者提出了以下反應途徑。首先,2在Et3N·3HF和銅催化劑的存在下發生N-O鍵裂解,生成質子化的氨基自由基陽離子(I)。隨后,(I)與碳碳雙鍵發生親電胺化反應產生(II)。最后, (II)將經過銅介導的氟化得到目標產物。考慮到烯烴親電胺化反應中C?N鍵的形成是容易且快速的,C?F鍵的形成可能是該反應的決速步。圖5. 反應機理(圖片來源:J. Am. Chem. Soc.)Qiu Wang課題組開發了一種前所未有的銅催化的烯烴氨基氟化反應,直接合成了(雜)芳基、烷基和烯丙基β-氟烷基胺。該方法具有區域選擇性高、條件溫和、官能團耐受性好等特點。機理實驗表明,銅介導的烯烴親電胺化反應可依次形成以胺和碳為中心的自由基中間體,這些中間體經氟化反應后生成目標產物。該方法的提出在合成和藥物化學領域有著重要意義。