

自然界利用環加成反應生成復雜的天然產物骨架。Dehydrosecodine是一種高活性的生物合成中間體,經過環加成可生成幾種生物堿骨架,這些骨架是藥理學上重要化合物如長春堿和伊寶加因的前體。一種生產生物堿的夾竹桃科的植物已經進化出了環化酶,可以催化一種較高活性的底物—Dehydrosecodine(1)的環加成反應,形成獨特的生物堿骨架。作者和其他團隊最近發現并表征了已知催化1環加成反應的酶:水甘草堿合成酶(TiTabS和CrTS)[催化(-)-水甘草堿(2)(抗癌藥物長春堿和長春新堿的前體)的形成];長春質堿合成酶(CrCS)[催化(+)-長春質堿(3)(長春花堿和長春新堿的前體)的形成];和冠狀堿合成酶(TiCorS)[它催化(-)-冠狀定合酶(4)(抗成癮劑伊波加因的前體)的形成]。TiTabS/CrTS和CrCS將1通過[4+2]環加成直接生成2和3,而TiCorS最初形成一種迄今尚未經過表征的不穩定中間體,然后被酶還原為4。原則上,底物1可以通過選擇性環加成反應生成額外的骨架,但這些環化酶的廣泛突變并沒有導致酶產物譜的擴展。在這里,作者證明了環化酶TiCorS除了能生成4外,還能產生另一種pseudo-aspidosperma(Ψ-aspidosperma)型生物堿pseudo-tabersonine(Ψ-tabersonine)(5)(Fig. 1)。作者首先通過表征環化酶TiCorS產生的不穩定中間體來展示這種轉化背后的機制基礎。這種中間體可以被還原酶捕獲生成4,也可以同時被還原酶和氧化酶捕獲生成替代骨架5。借助氘標記技術研究了這些酶轉化的機制。簡而言之,1的化學反應性是由一個環化酶和一對能異構烯烴部分的氧化還原酶開發得到,這反過來促進了新的區域選擇性環化反應。

Fig. 1: 夾竹桃科植物產生的dehydrosecodine(1)衍生生物堿(圖片來源:J. Am. Chem. Soc.)
Tabernanthe iboga,一種通過酶TiTabS和TiCorS分別產生2和4的植物,也產生Ψ-aspidosperma型生物堿20-epi-ibophyllidine(Fig. 1)。為了確定T. iboga酶可以形成(+)-Ψ-tabersonine 5,作者進行了體外偶合生化分析,其中不穩定的底物1由上游中間的莖乙酸馬藤堿(6)經酶促反應生成。6首先被黃酮類precondylocarpine acetate synthase(PAS)氧化生成precondylocarpine acetate(7),然后被中鏈醇脫氫酶dihydroprecondylocarpine acetate合酶(DPAS)進行1,4-亞胺還原(Fig. 1)。Dihydroprecondylocarpine acetate(8)經過一個乙酰氧基的去除生成底物1,然后被一個環化酶捕獲(Fig. 1)。
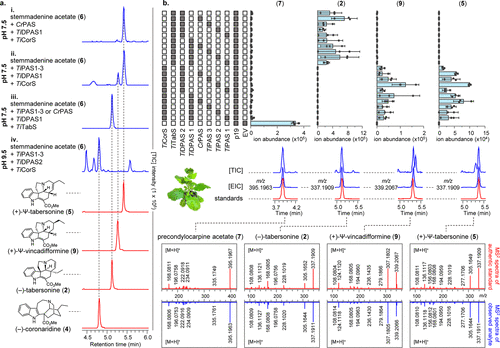
Fig. 2: Ψ-tabersonine(5)的生物合成(圖片來源:J. Am. Chem. Soc.)
如圖2a所示,作者觀察到在某些條件下,5(而不是4)在使用TiCorS的分析中形成。因此,TiCorS似乎參與了4和5的生成。作者隨后使用異質生產的蛋白質進行體外試驗,以探測導致產物選擇性切換的條件。結果發現:在pH 7.5時,在TiPAS1?3或CrPAS和TiDPAS1參與下,有利于形成5;在pH 7.5,在TiPAS1?3或CrPAS、TiDPAS1和TiTabS的參與下有利于生成2;而在pH 9.5時,在TiPAS1?3、TiDPAS2和TiCorS參與下有利于生成4(Fig. 2a)。之后,作者通過重建這里報道的生物合成酶,使其在Nicotiana benthamiana中產生2、5和9,進一步證實在體外獲得的結果(Fig. 2b)。
此外,Dehydrosecodine的酸穩定異構體,angryline(1a),也可以分離和直接用于環化分析(Fig. 1)。1a必須在pH值高于8.5的情況下使用,在那里它將開環產生具有反應性的1。當1a代替6(pH值9.5)用于酶學測定時,作者可以觀察到5、2、4和9的生成。值得注意的是,PAS(TiPAS1?3,CrPAS)和TiDPAS1對5和9的形成都是必需的,這表明Ψ-aspidosperma骨架的形成需要這些酶。然而,在4的生產過程中不需要PAS。
為了研究TiCorS的作用機制,作者通過優化初始不穩定產物的分離的條件,并使用NaBH4還原捕獲該化合物16-carbomethoxycleavamine(10,1H NMR表征得到)。這表明TiCorS的初始環化產物為16-carbomethoxycleaviminium(11)。結合氘標記結果,當TiCorS產物被NaBD4還原時,這將導致11的1,2-還原反應的發生(Fig. 3)。值得注意的是,相關環化酶CrCS的晶體結構(70.8%基因序列一致性)顯示,CS最初形成(+)-16-carbomethoxycleaviminium(11a),隨后環化生成3,但與TiCorS不同的是,中間產物沒有從活性位點釋放出來。此外,3在酸性條件下可以開環形成11a。CD光譜顯示TiCorS生成(?)-16-carbomethoxycleavamine(10),這是由CrCS生成的對映異構體。
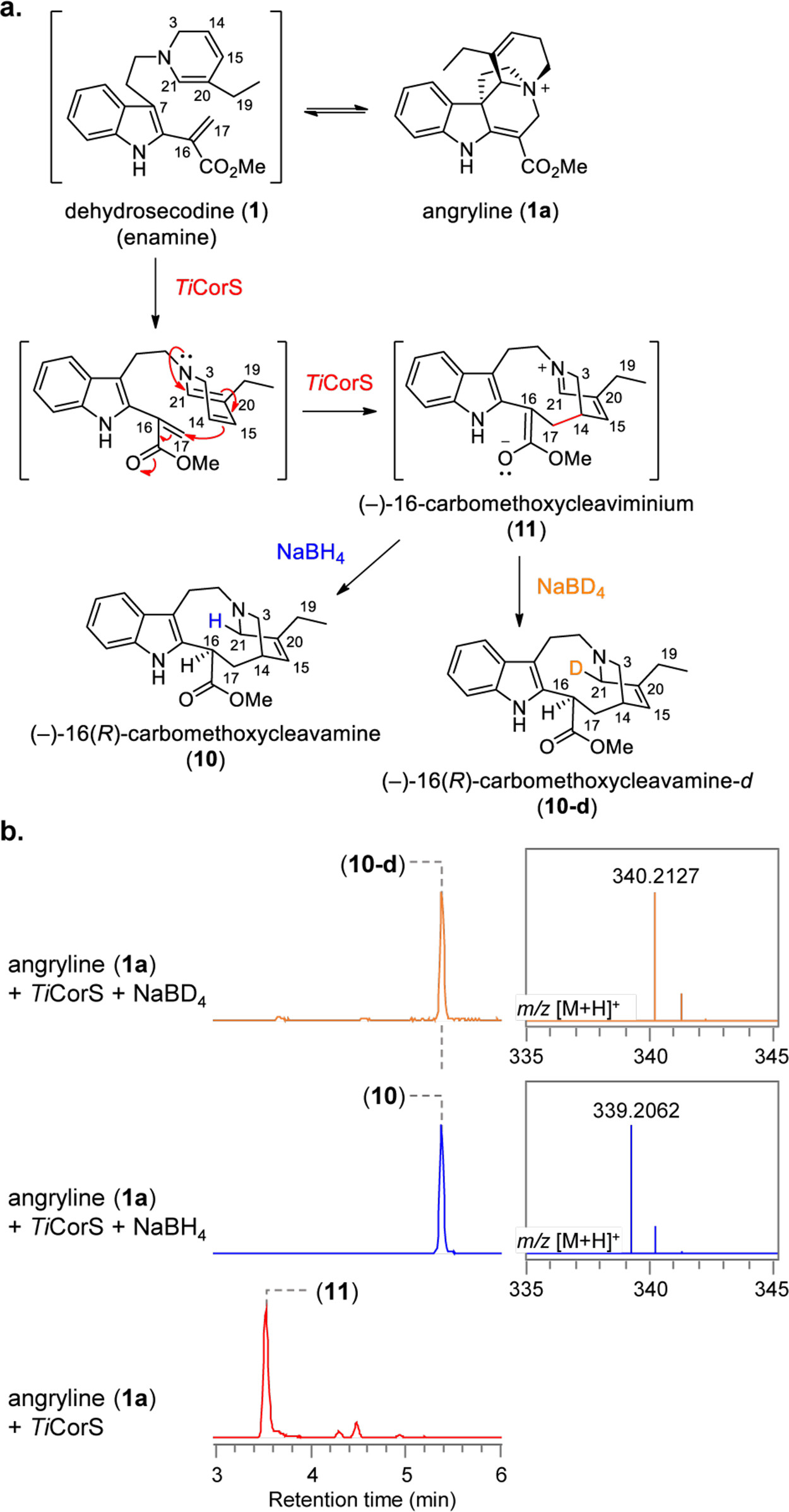
Fig. 3: 16-carbomethoxycleavamine(10)的生成(圖片來源:J. Am. Chem. Soc.)
利用對TiCorS環化產物的了解,作者提出了4的形成機制。從TiCorS活性位點釋放后,11被TiDPAS2進行1,4-還原,進而促進第二次環化形成4(Fig. 4)。
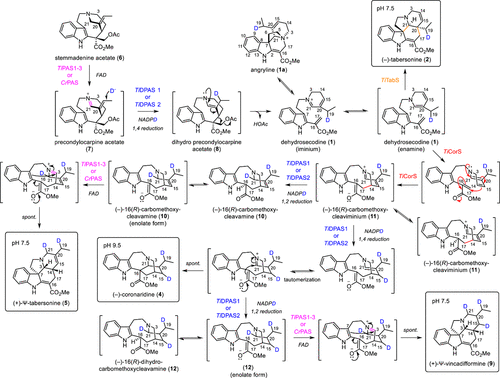
Fig. 4: (?)-iboga 和 (+)-Ψ-aspidosperma生物堿的可能形成機制(圖片來源:J. Am. Chem. Soc.)
對于5的形成機制:TiCorS將1環化到11,并將其從活性位點釋放,在活性位點上,它被TiDPAS1通過1,2-還原反應還原至10,然后被PAS再氧化。生成的中間產物會自發環化形成5。9是由PAS氧化雙還原(?)-16-dihydrocarbomethoxycleavamine(12)形成的(Fig. 4)。4和5之間的轉化最終取決于DPAS催化1,4-還原反應還是1,2-還原反應。實驗pH條件或蛋白質-蛋白質相互作用的變化可能是有利于1,2-還原反應而不是1,4-還原反應的原因。另外,一種尚未發現的在生理pH下產生4的還原酶可能決定著T. iboga中這種化合物的生物合成。
總結
Lorenzo Caputi和Sarah E. O’Connor團隊展示了dehydrosecodine(1)如何通過氧化還原使具有區域選擇性的環加成反應轉化形成(?)-coronaridine(4),(+)-Ψ-tabersonine(5),或(+)-Ψ-vincadifformine(9)。值得注意的是,這些氧化還原酶,DPAS和PAS,將stem madedine acetate(6)轉化為dehydrosecodine(1),是從生物合成途徑的上游引入的。因此,這一發現表明了植物如何在多個途徑中實現對酶的循環利用。同時,如何控制這些上游酶的招募也是未來研究的重要方向。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn