- 首頁
- 資訊
Angew:Bi(V)-介導吡啶酮的O-芳基化極性反轉合成吡啶基醚
來源:化學加原創 2022-10-23
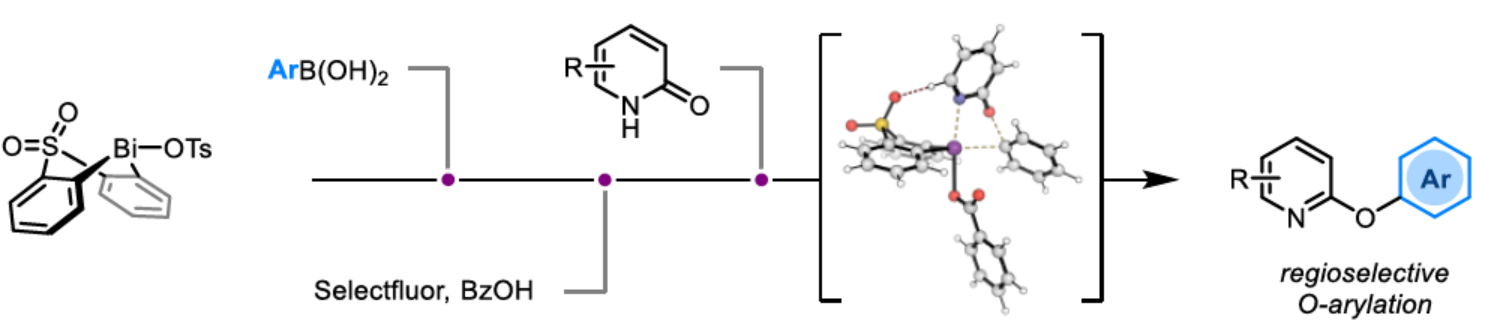
導讀:近日,英國諾丁漢大學Liam T. Ball與美國科羅拉多州大學Robert S. Paton團隊報道了一種2-/4-吡啶酮與芳基硼酸的O-選擇性芳基化反應,合成了一系列吡啶基醚衍生物。同時,該策略是對SNAr或交叉偶聯常規方法的重要補充。此外,通過對Ki6783和氟吡酰草胺(picolinafen)的簡明合成以及卡博替尼(cabozantib)和戈伐替尼(golvatinib)的形式合成,進一步證明了反應的實用性。計算研究表明,O-芳基化是通過5-元過渡態的協同方式進行。O-芳基化的動力學控制的區域選擇性(與之前Bi(V)-介導吡啶酮的N-芳基化相反),主要歸因于雙環骨架施加的幾何約束(geometric constraints)。文章鏈接DOI:10.1002/anie.202212873
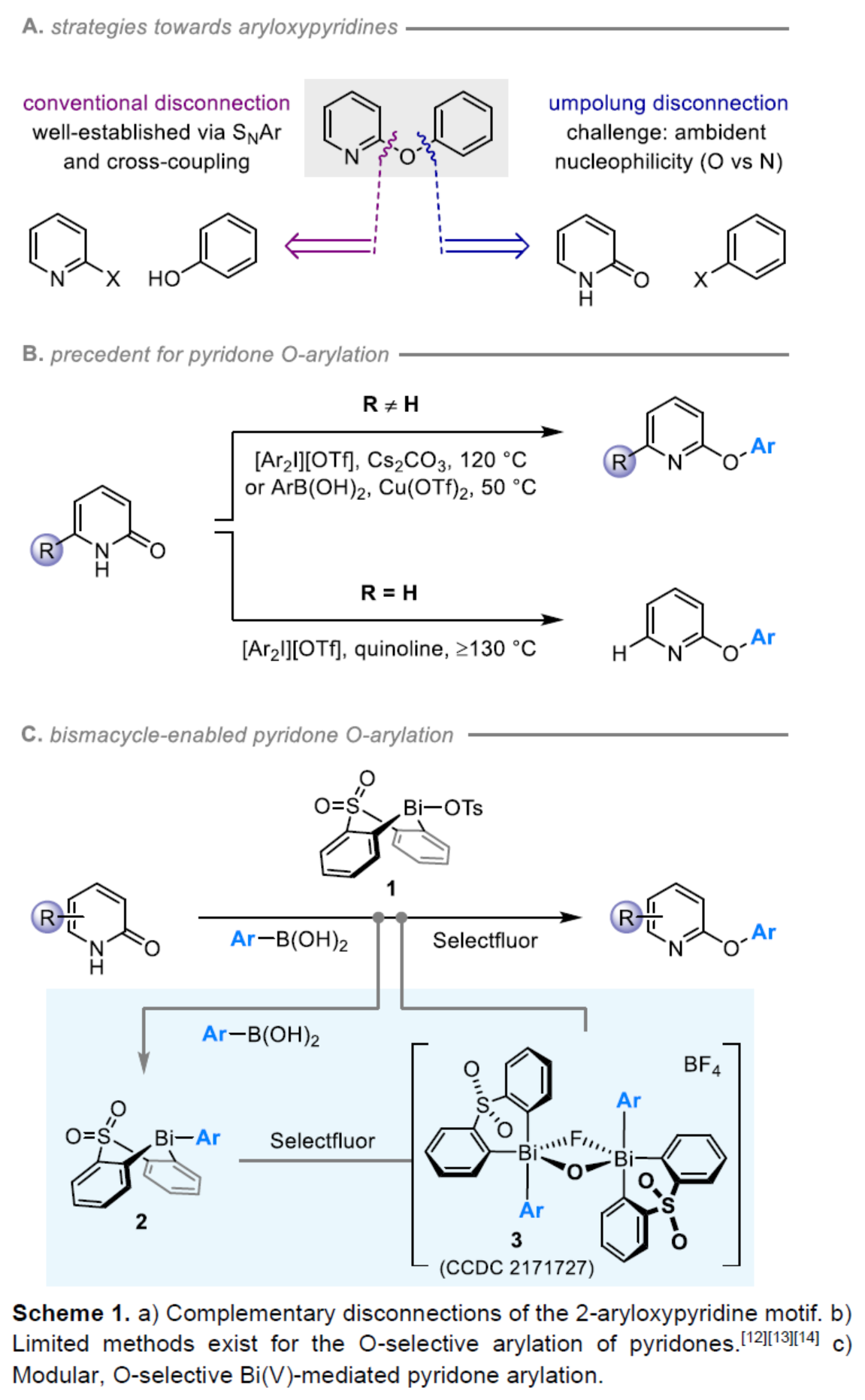
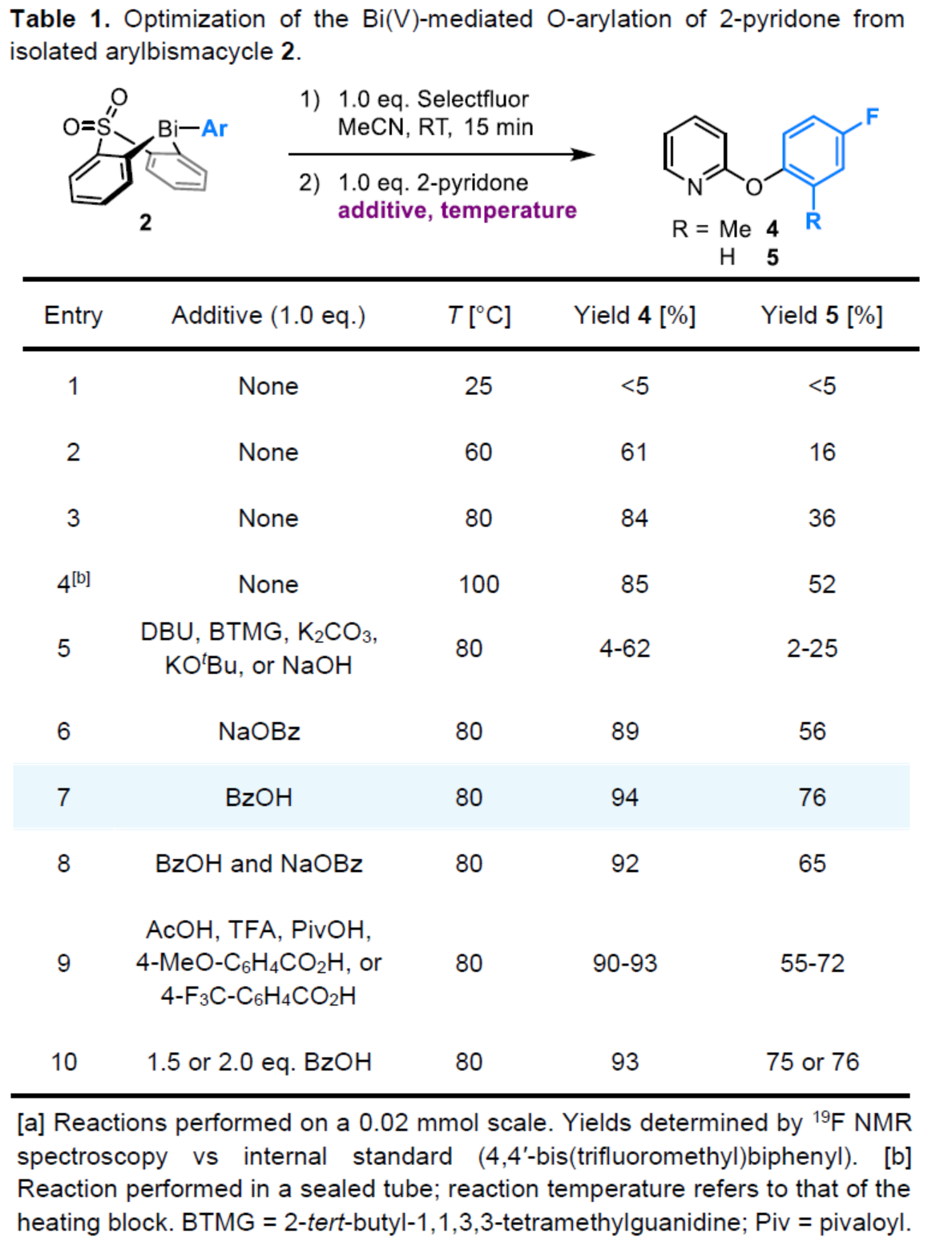
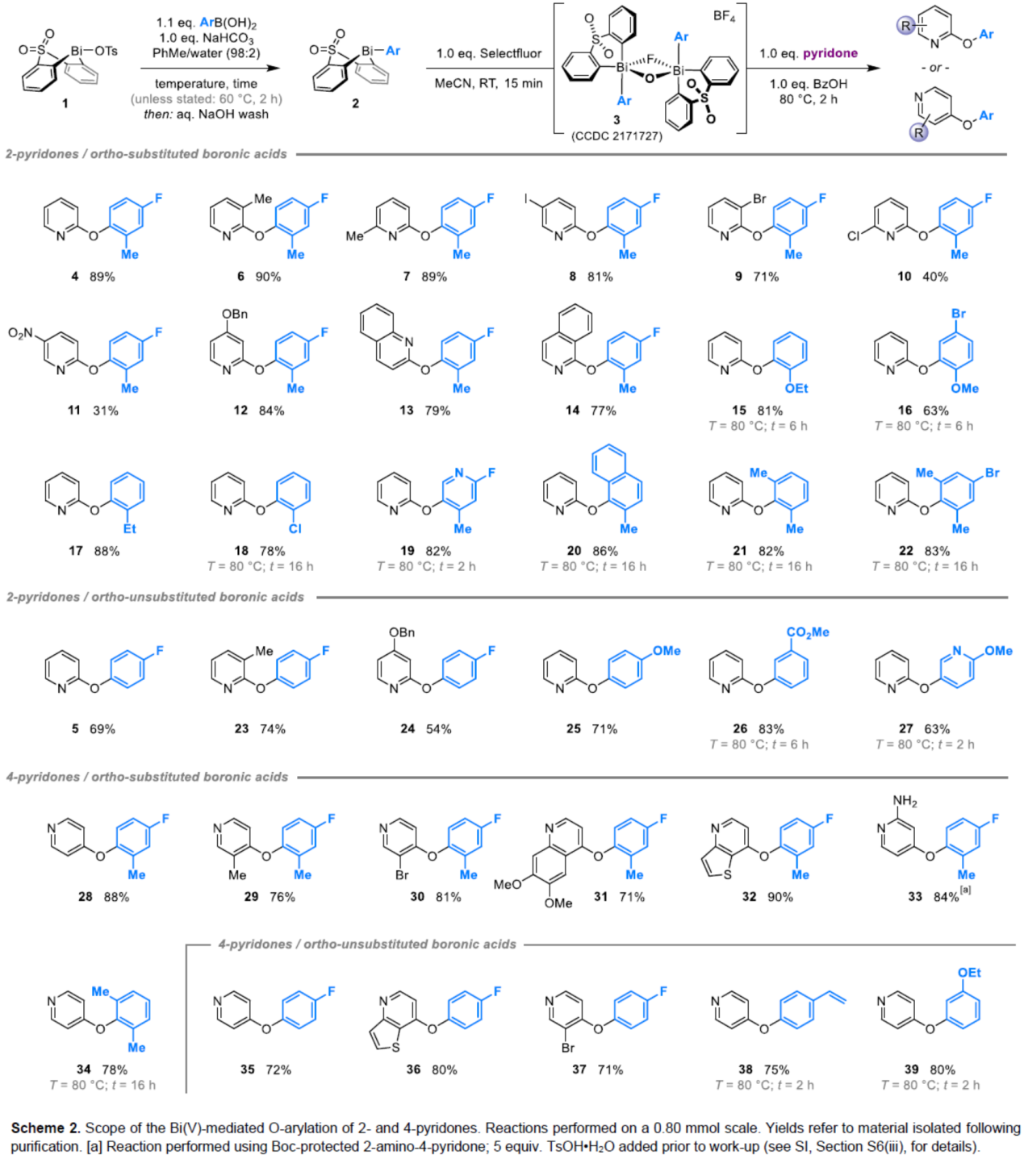
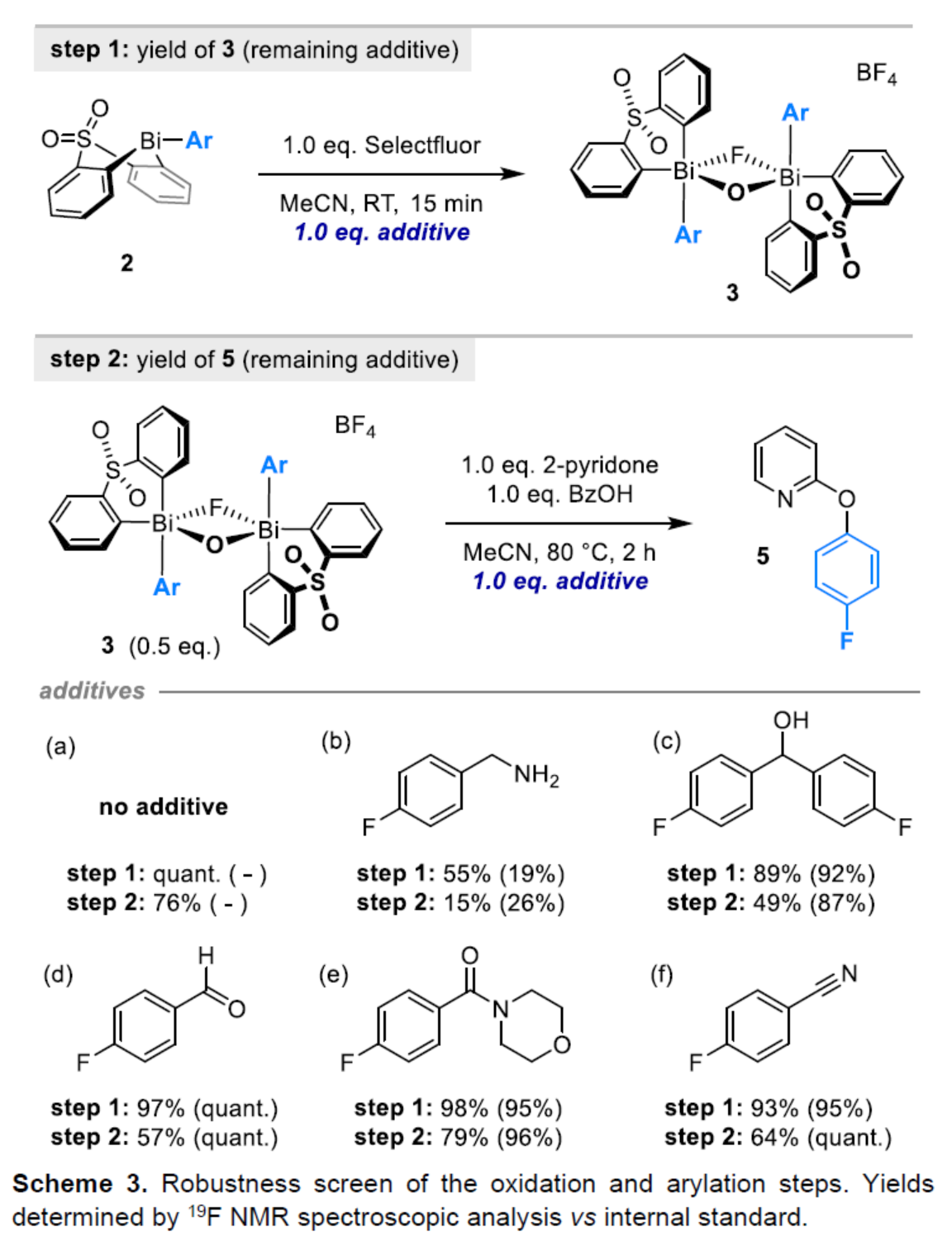
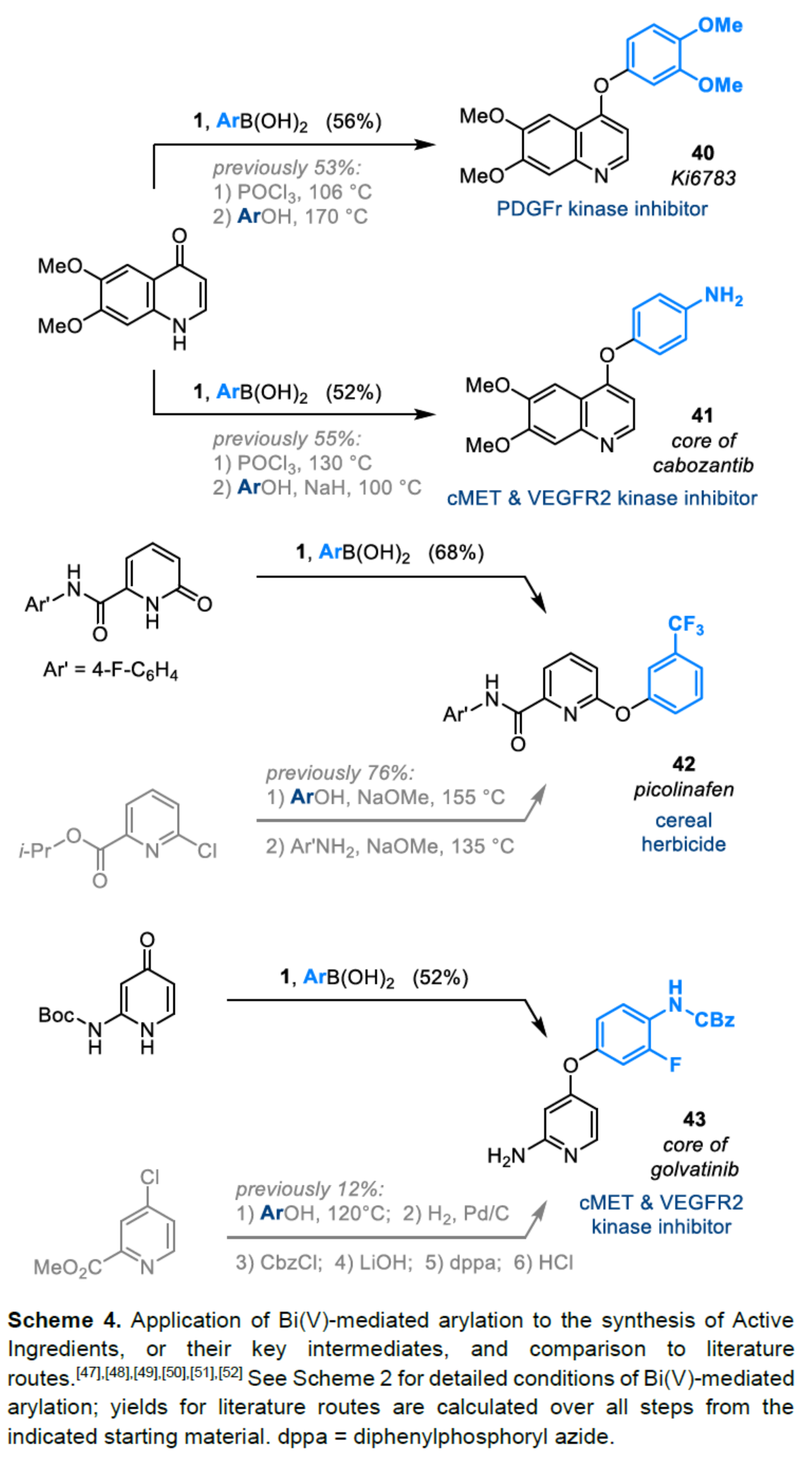
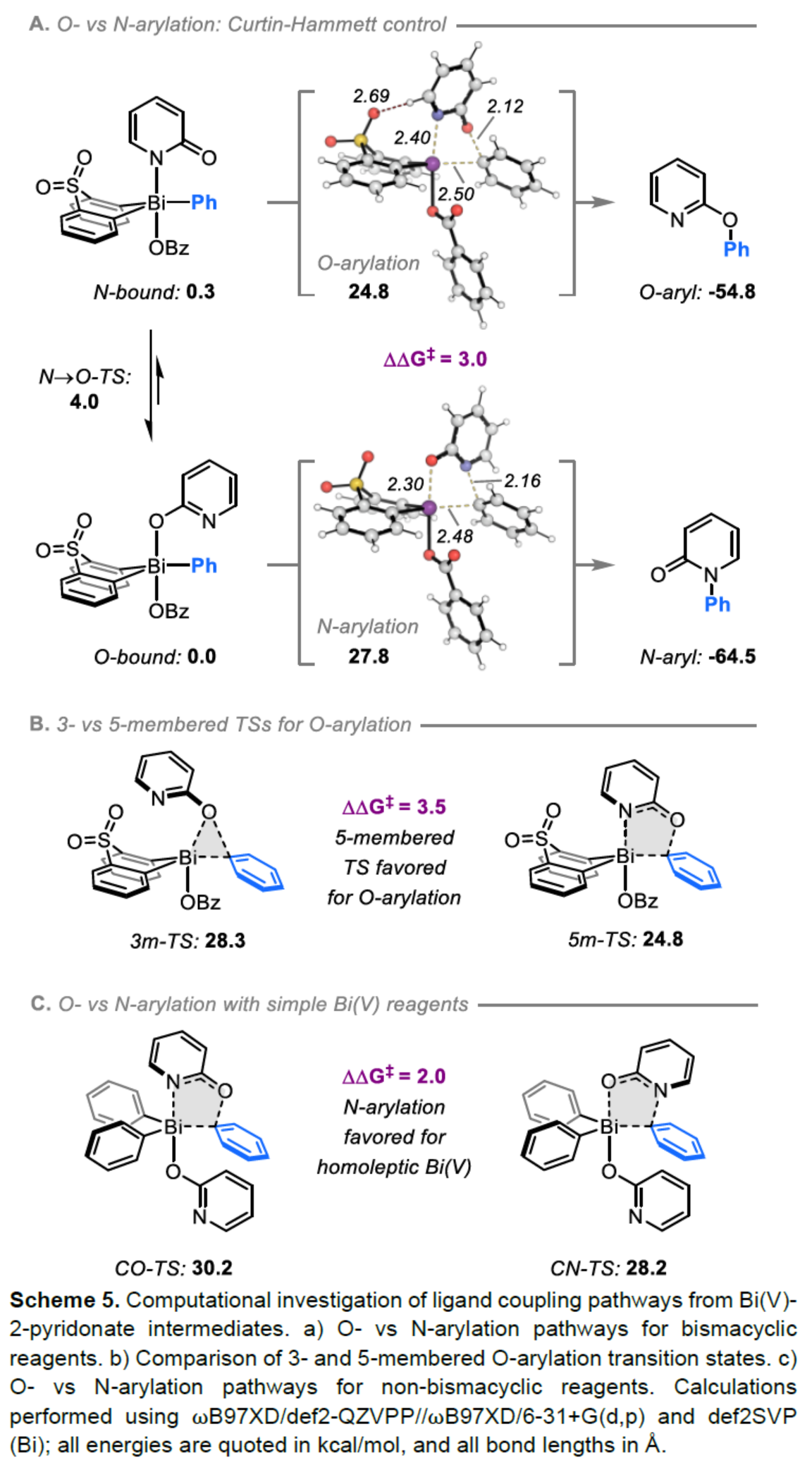
(圖片來源:Angew. Chem. Int. Ed.)2-和4-芳氧基吡啶(aryloxypyridine)單元廣泛存在于各種藥物和農用化學品中,在過去十年中已批準的酪氨酸激酶抑制劑中有6種都含有2-和4-芳氧基吡啶(aryloxypyridine)單元。目前,SNAr反應是合成芳氧基吡啶的一種成熟的方法,但存在反應條件茍刻以及底物僅限于對缺電子吡啶和富電子苯酚。雖然交叉偶聯反應可進一步擴展底物的范圍,但對于C-O偶聯的研究卻相對較少。并且SNAr和交叉偶聯反應的區域選擇性對于聚鹵代吡啶(polyhalopyridines)是不可預測或不可控制的(Scheme 1A,left)。此外,吡啶酮的O-芳基化反應是另一種有效的策略(Scheme 1A,right)。然而,由于吡啶酮的雙親核性,導致O-和N-芳基化反應具有競爭性,從而使該方法具有挑戰。雖然化學家們已對吡啶酮的烷基化的區域選擇性進行了深入的研究,但對于吡啶酮的芳基化仍有待進一步的探索。2-和4-吡啶酮的N-芳基化可使用基于I(III)-或Bi(V)-親電芳基化試劑選擇性地實現,通過與芳基鹵化物、芳基硼酸或三芳基鉍(III)試劑進行的銅催化偶聯反應,或通過與適當活化芳基鹵化物的SNAr反應。相比之下,O-芳基化反應的選擇性則更具挑戰(Scheme 1B)。例如,二芳基碘鎓鹽或Chan-Lam偶聯試劑通常獲得N-芳基化的2-吡啶酮作為主要產物,只有當吡啶酮的6-位被取代時,才有利于O-芳基化反應。事實上,目前只有一種方法可用于2-吡啶酮的O-芳基化反應,該方法不具有6-取代基,但需高溫(130-140 oC)。對于4-吡啶酮的O-選擇性芳基化反應,仍有待進一步的研究。近日,英國諾丁漢大學Liam T. Ball與美國科羅拉多州大學Robert S. Paton團隊報道了一種砜橋聯的雙環促進的2-/4-吡啶酮與芳基硼酸的O-選擇性芳基化反應,合成了一系列吡啶基醚衍生物(Scheme 1C)。同時,該反應具有底物范圍廣泛、區域選擇性高、反應條件溫和、原子經濟性高等特點。(圖片來源:Angew. Chem. Int. Ed.)首先,作者以2與2-吡啶酮作為模型底物,進行了相關反應條件的篩選(Table 1)。反應的最佳條件為:當以Selectfluor作為氧化劑,底物2先在MeCN溶劑中室溫反應15 min。隨后,以BzOH作為添加劑,上述的中間體可與2-吡啶酮在80 oC反應2 h,可以94%的收率得到產物4或以76%的收率得到產物5。(圖片來源:Angew. Chem. Int. Ed.)在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Table 2)。首先,具有不同電性取代的2-吡啶酮與喹啉酮,均可與2-甲基-4-氟苯硼酸順利反應,獲得相應的產物4-14,收率為31-90%。其中,含有-NO2與-Cl取代的吡啶酮底物,收率偏低,如10和11。一系列鄰位取代的苯硼酸、萘基硼酸以及吡啶硼酸,均可與2-吡啶酮順利反應,獲得相應的產物15-22,收率為63-88%。其次,一系列非鄰位取代的苯硼酸與吡啶硼酸,也可與2-吡啶酮衍生物反應,獲得相應的產物5和23-27,收率為54-83%。此外,4-吡啶酮衍生物也可與一系列鄰位取代的苯硼酸反應,獲得相應的產物28-34,收率為71-90%。4-吡啶酮衍生物還可與非鄰位取代的苯硼酸反應,獲得相應的產物35-39,收率為71-80%。(圖片來源:Angew. Chem. Int. Ed.)緊接著,作者對氧化和芳基化步驟進行了Robustness篩選(Scheme 3)。研究表明,伯胺在氧化與芳基化過程中均不相容。二級芐醇,可耐受氧化條件,但不耐受芳基化條件。這種反應性的差異可反映在每種情況下形成的Bi(V)中心的不同形態。同時,苯甲醛、酰胺和腈衍生物在氧化與芳基化過程均可兼容。(圖片來源:Angew. Chem. Int. Ed.)緊接著,作者對反應的實用性進行了研究(Scheme 4)。首先,通過該策略可以56%的收率得到Ki6783(40)和以52%的收率得到卡博替尼(41,cabozantib)的核心骨架,避免了原始文獻中連續的氯代脫氧化以及高溫SNAr的過程。其次,通過該策略可以68%的收率得到除草劑氟吡酰草胺(42,picolinafen),避免了在苛刻條件下進行的SNAr醚化和酰胺化反應。此外,通過該策略可以52%的收率得到戈伐替尼(43,golvatinib)的核心骨架,避免了文獻中的6步合成過程。(圖片來源:Angew. Chem. Int. Ed.)最后,作者對反應機理進行了相關的計算研究(Scheme 5)。首先,通過對比O-與N-芳基化的路徑發現,在不可逆芳基化步驟中確定了區域選擇性,并且O-芳基化在動力學上是有利的(Scheme 5A)。其次,通過對比3-和5-元O-芳基化過渡態發現,5-元過渡態有利于O-芳基化過程(Scheme 5B)。此外,使用簡單的Bi(V)試劑進行O-與N-芳基化的對比發現,N-芳基化偏向于均配型Bi(V)試劑(Scheme 5C)。(圖片來源:Angew. Chem. Int. Ed.)英國諾丁漢大學Liam T. Ball與美國科羅拉多州大學Robert S. Paton團隊報道了一種Bi(V)-介導2-/4-吡啶酮與芳基硼酸的O-選擇性芳基化反應,合成了一系列吡啶基醚衍生物。同時,該策略是對SNAr或交叉偶聯常規方法的重要補充。此外,通過對Ki6783和氟吡酰草胺(picolinafen)的簡明合成以及卡博替尼(cabozantib)和戈伐替尼(golvatinib)的形式合成,進一步證明了反應的實用性。機理研究表明,O-芳基化是通過5-元過渡態的協同方式進行。O-芳基化的區域選擇性控制,主要歸因于雙環骨架施加的幾何約束(geometric constraints)。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn