



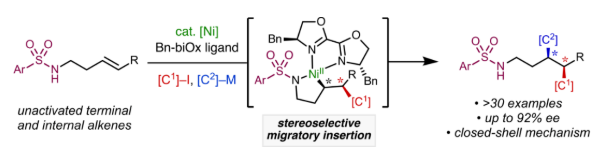
圖1. 鎳催化非活化烯烴三組分1, 2-不對(duì)稱(chēng)雙碳官能團(tuán)化(圖片來(lái)源:J. Am. Chem. Soc.)
近年來(lái),過(guò)渡金屬催化的烯烴1, 2-雙碳官能團(tuán)化反應(yīng)得到了廣泛研究。鎳作為廉價(jià)金屬,具有獨(dú)特的抑制β-H消除能力和多種靈活的價(jià)態(tài),因此在此類(lèi)反應(yīng)中具有一定優(yōu)勢(shì)。1, 2-雙碳官能團(tuán)化反應(yīng)由烯烴出發(fā)同時(shí)形成兩個(gè)相鄰的C(sp3)-C鍵,可作為發(fā)展相關(guān)立體選擇性合成反應(yīng)的潛在有力工具。然而,鎳催化烯烴的分子間三組分不對(duì)稱(chēng)雙碳官能團(tuán)化反應(yīng)研究較為罕見(jiàn),現(xiàn)有的報(bào)道主要局限于活性烯烴的自由基官能團(tuán)化。基于此,作者發(fā)展了在分子間遷移插入過(guò)程中利用非手性導(dǎo)向基團(tuán)和手性半活性N, N-雙齒配體之間的空間相互作用,實(shí)現(xiàn)了基于非自由基歷程,Ni(0)/Ni(II)催化循環(huán)體系的非活化烯烴三組分、對(duì)映選擇性1, 2-二芳基化和1, 2-芳基烯基化反應(yīng)。
此前在鎳催化對(duì)映選擇性1, 2-雙碳官能團(tuán)化方面的工作主要集中于分子內(nèi)雙組分偶聯(lián),在遷移插入或還原消除過(guò)程中控制其立體選擇性 (圖2A和2B)。Morken等課題組在2019-2020年相繼報(bào)道了一些分子間鎳催化烯烴不對(duì)稱(chēng)1, 2-雙碳官能團(tuán)化的反應(yīng)實(shí)例,這些例子都是通過(guò)立體選擇性自由基捕獲機(jī)制進(jìn)行 (圖2C)。然而這些基于自由基的三組分偶聯(lián)反應(yīng)通常只能構(gòu)建一個(gè)立體中心,且底物適用范圍僅限于活性烯烴以及一些活性自由基受體。考慮到其局限性,作者期望開(kāi)發(fā)一種由不對(duì)稱(chēng)遷移插入步驟控制的對(duì)映選擇性鎳催化1, 2-二芳基化反應(yīng),一步構(gòu)建兩個(gè)手性中心 (圖2D)。根據(jù)此前作者報(bào)道的使用導(dǎo)向基團(tuán)通過(guò)非自由基途徑用于非活化烯烴的1, 2-雙碳官能團(tuán)化研究基礎(chǔ),作者認(rèn)為含受保護(hù)氨基的烯烴底物是實(shí)現(xiàn)非活化烯烴分子間不對(duì)稱(chēng)1, 2-二芳基化的最佳選擇。
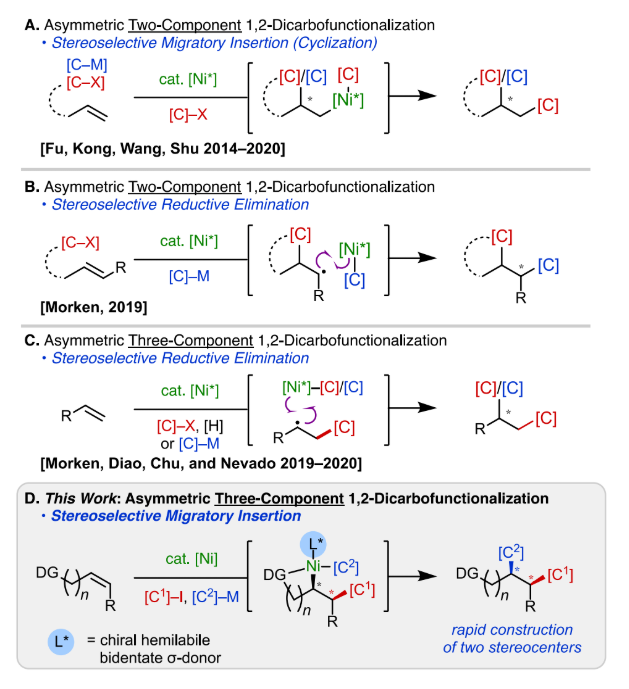
圖2. 研究背景與反應(yīng)體系設(shè)計(jì)(圖片來(lái)源:J. Am. Chem. Soc.)
首先,作者以1-碘-4-異丙氧基苯和苯硼酸新戊二醇酯 (PhB(nep)) 作為模板偶聯(lián)底物,使用(S)-芐基聯(lián)噁唑啉 (Bn-biOx,L9) 為配體,在低溫條件下系統(tǒng)考察了含不同磺酰基烯丁基胺底物的反應(yīng)性 (圖3)。對(duì)位含不同電性取代基的苯磺酰基會(huì)顯著影響反應(yīng)的收率和對(duì)映選擇性,其中2, 4, 6-三異丙基苯磺酰基 (Trisyl) DG8表現(xiàn)出最佳的反應(yīng)性和對(duì)映選擇性,能以良好的收率生成烯烴1, 2-二芳基化產(chǎn)物2a,產(chǎn)物的絕對(duì)構(gòu)型經(jīng)X-射線單晶衍射得到確認(rèn)。此外,作者還篩選了一系列噁唑啉配體,常見(jiàn)的芐基噁唑啉配體L1-L4,丁基聯(lián)噁唑啉配體L5, L6均不能以較好的收率和選擇性得到產(chǎn)物,只有使用芐基聯(lián)噁唑啉骨架配體時(shí)(L7-L11)反應(yīng)才能順利完成。在條件優(yōu)化過(guò)程中,作者還發(fā)現(xiàn)較短的反應(yīng)時(shí)間有利于獲得更高的對(duì)映選擇性但會(huì)損失一定產(chǎn)率。不添加Bn-biOx配體時(shí)也能以13%的收率獲得外消旋產(chǎn)物,表明在該催化過(guò)程中具有一定強(qiáng)度的背景反應(yīng)。值得注意的是,作者使用他們開(kāi)發(fā)的一種空氣穩(wěn)定的Ni(0)前體--Ni(cod)TOA作為催化劑,反應(yīng)無(wú)需惰性氣氛也能成功進(jìn)行。
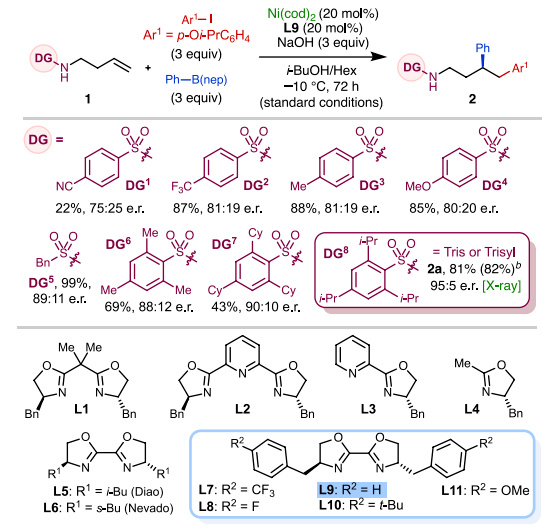
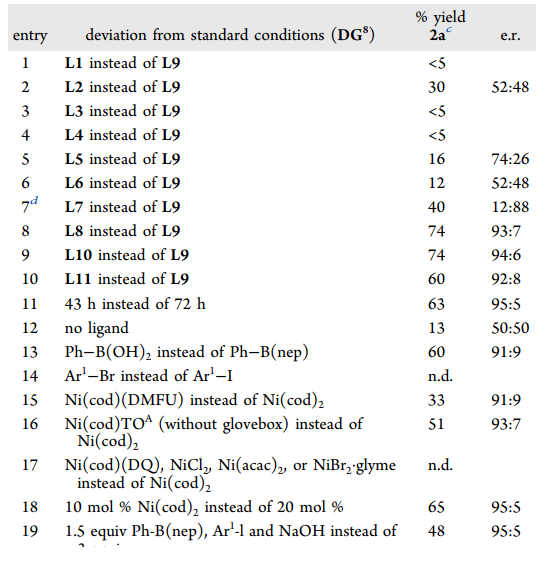
圖3. 反應(yīng)條件優(yōu)化(圖片來(lái)源:J. Am. Chem. Soc.)
隨后,作者分別考察了芳基碘化物和芳基硼酸酯作為偶聯(lián)底物的適用范圍 (圖4)。對(duì)于取代基電性,芳基碘化物對(duì)位含給電子基團(tuán)時(shí)能以良好的收率得到更高對(duì)映選擇性的產(chǎn)物 (2b-e,2h-j,2p,2q),含電中性或吸電子基團(tuán)時(shí)則觀察到較低的對(duì)映選擇性和中等至優(yōu)異的產(chǎn)率 (2k-o)。間位和鄰位上含給電子基團(tuán)的芳基碘化物能以?xún)?yōu)異的收率得到1, 2-二芳基化產(chǎn)物,但對(duì)映選擇性降低。對(duì)于芳基硼酸酯,苯環(huán)上取代基的電性對(duì)反應(yīng)影響較小,對(duì)位上的給電子基團(tuán)、電中性基團(tuán)以及弱吸電子基團(tuán)相比于強(qiáng)吸電子基能得到更高的產(chǎn)率 (2r-v,2x-z)。雜芳基硼酸酯,如3-噻吩基和3-呋喃基硼酸酯 (2aa, 2ab) 也適用于此轉(zhuǎn)化。此外,作者還研究了烯基硼酸酯作為親核試劑在該轉(zhuǎn)化過(guò)程中的反應(yīng)性。使用(E)-(4-甲基)苯乙烯基硼酸新戊二醇酯參與反應(yīng),能以中等的收率得到1, 2-二烯基化產(chǎn)物2ae,但對(duì)映選擇性相對(duì)較低,而1, 2-芳基烯基化產(chǎn)物2af可以兼得良好的產(chǎn)率和對(duì)映選擇性。其它(E)-烯基硼酸酯,如(E)-(3-苯基丙-1-烯-1-基)硼酸酯和(E)-(3, 3-二甲基丁-1-烯-2-基)硼酸酯,也能順利完成該轉(zhuǎn)化。此外,1,1-二取代硼酸酯(1-苯基乙烯基硼酸酯,2ai)和環(huán)己烯基硼酸酯 (2aj) 均能以良好的的對(duì)映選擇性和較低的產(chǎn)率得到偶聯(lián)產(chǎn)物。
作者還研究了該雙芳基化過(guò)程中烯烴母核的底物適用范圍。作者發(fā)現(xiàn),在標(biāo)準(zhǔn)反應(yīng)條件下,2, 4, 6-三異丙基苯磺酰基 (Trisyl) 作為導(dǎo)向的(Z)-和(E)-內(nèi)烯烴只能以較低產(chǎn)率獲得雙官能團(tuán)化產(chǎn)物。而將Trisyl切換為位阻較小的DG2時(shí),反應(yīng)則順利進(jìn)行,生成單一非對(duì)映二芳基化產(chǎn)物 (2ak-2an),且具有良好的產(chǎn)率和ee值。作者使用制備級(jí)手性超臨界流體色譜法成功分離出產(chǎn)物2ak的主要對(duì)映體,其絕對(duì)立體構(gòu)型由單晶X-射線衍射證實(shí)。

圖4. 底物普適性研究(圖片來(lái)源:J. Am. Chem. Soc.)
為了證明Trisyl導(dǎo)向基團(tuán)中的N-H鍵的重要性,作者使用Trisyl磺酸酯1r和N-甲基化的Trisyl磺酰胺1s進(jìn)行了對(duì)照實(shí)驗(yàn),在這兩種底物條件下,均未發(fā)生反應(yīng) (圖5A)。對(duì)于烯烴的雙鍵與導(dǎo)向基之間的距離是否會(huì)影響反應(yīng)對(duì)映選擇性,作者使用將烷基鏈延長(zhǎng)的底物進(jìn)行反應(yīng),結(jié)果表明只有烯丁基胺能順利完成轉(zhuǎn)化 (圖5B)。作者認(rèn)為這可能是由于只有烯丁基胺底物能形成空間構(gòu)型穩(wěn)定的含鎳五元環(huán)狀中間體所致。此外,自由基鐘實(shí)驗(yàn)表明該反應(yīng)并非經(jīng)歷自由基歷程 (圖5C)。基于上述實(shí)驗(yàn)作者提出了可能的反應(yīng)機(jī)理,首先Ni(0)-(Bn-biOx)絡(luò)合物與芳基碘化物發(fā)生氧化加成得到Ni(II)物種,隨后Trisyl保護(hù)的烯基胺上的雙鍵和氮原子與Ni(II)物種進(jìn)行配位,經(jīng)立體選擇性遷移插入形成相應(yīng)的Ni(II)-(Bn-biOx)-烷基-磺胺基五元金屬環(huán)狀中間體,最后與芳基硼酸酯進(jìn)行轉(zhuǎn)金屬化得到Ni(II)-(Bn-biOx)-烷基-芳基物種再還原消除生成1, 2-二芳基化產(chǎn)物 (圖5D)。隨后,作者發(fā)展了一種使用Mg(0)、Ti(Oi-Pr)4和TMSCl對(duì)產(chǎn)物2a進(jìn)行脫保護(hù)的方法,用于得到對(duì)映體富集的1, 2-二芳基胺。在該條件下能以79%的產(chǎn)率高效實(shí)現(xiàn)對(duì)Trisyl基團(tuán)的脫除,同時(shí)保持對(duì)映體比例 (圖5E)。此外,作者還將簡(jiǎn)單的羧基作為導(dǎo)向基,也成功實(shí)現(xiàn)了相應(yīng)底物的對(duì)映選擇性二芳基化 (圖5F, 2au)。
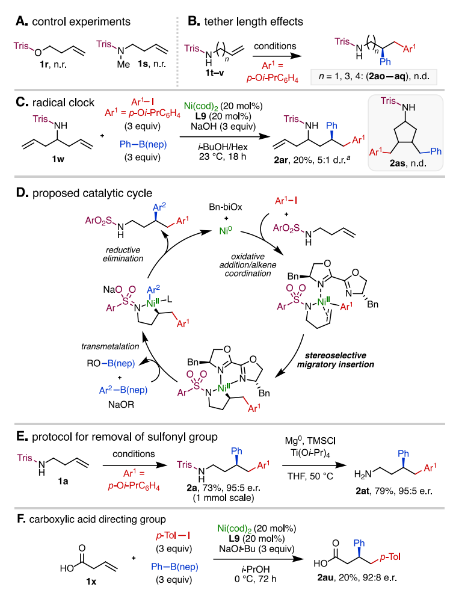
圖5. 機(jī)理實(shí)驗(yàn)、可能的催化循環(huán)以及衍生化研究(圖片來(lái)源:J. Am. Chem. Soc.)
最后,作者使用DFT計(jì)算對(duì)反應(yīng)歷程進(jìn)行了理論研究 (圖6)。首先,反應(yīng)經(jīng)由TS1得到氧化加成Ni(II)中間體4,再進(jìn)行配體交換得到更穩(wěn)定的Ni(II)絡(luò)合物5。隨后烯烴與Ni(II)配位,形成π-烯烴絡(luò)合物6,再經(jīng)歷TS2a遷移插入形成五元鎳環(huán)7。最后經(jīng)歷與芳基硼酸酯形成的TS3和還原消除過(guò)渡態(tài)TS4得到產(chǎn)物2n′。在該歷程中,烯烴的遷移插入步驟具有較低的能壘(5.6 kcal/mol),且放熱不可逆的,因此該步驟決定了反應(yīng)的對(duì)映選擇性。計(jì)算結(jié)果表明,在這些金屬絡(luò)合物中,噁唑啉配體相對(duì)于磺酰胺基更容易解離發(fā)生配體交換。在過(guò)渡態(tài)TS3中,Bn-biOx配體完全解離,并在最后還原消除后重新配位到Ni(0)金屬中心上。Bn-biOx配體易解離的特性在動(dòng)力學(xué)上顯著促進(jìn)了中間體5和7的轉(zhuǎn)化。
由于Bn-biOx配體在決定對(duì)映選擇性的遷移插入步驟過(guò)渡態(tài)中為單齒配位模式,因此其誘導(dǎo)模式不同于涉及C2對(duì)稱(chēng)手性配體常見(jiàn)的對(duì)映選擇性遷移插入過(guò)程。計(jì)算結(jié)果表明該過(guò)程經(jīng)歷的兩種最穩(wěn)定過(guò)渡態(tài)TS2a和TS2b (分別通向S對(duì)映體和R對(duì)映體)的活化自由能分別為5.6和6.9 kcal/mol,根據(jù)遷移插入TS構(gòu)象的Boltzmann平均值計(jì)算出的e.r.為87:13,有利于生成S對(duì)映體的生成,這與實(shí)驗(yàn)值 (88:12) 一致。在優(yōu)化過(guò)渡態(tài)TS2a中,大位阻的Trisyl基團(tuán)位于(S)-Bn-biOx配體占據(jù)較少的區(qū)域,而在較不穩(wěn)定的過(guò)渡狀態(tài)TS2b中觀察到Trisyl基團(tuán)和Bn-biOx配體上的芐基之間存在較大的空間排斥。
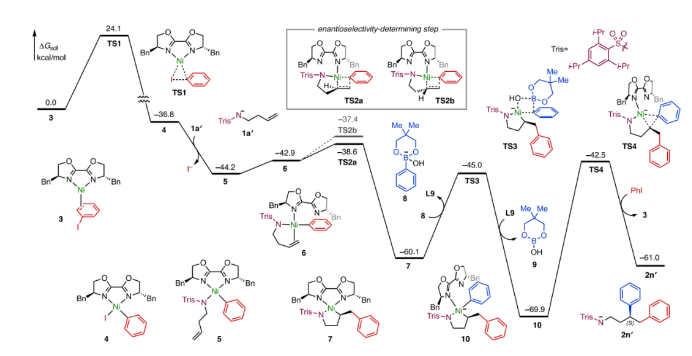
圖6. DFT理論計(jì)算(圖片來(lái)源:J. Am. Chem. Soc.)
總結(jié)
Keary M. Engle教授和劉鵬教授課題組發(fā)展了一種鎳催化非活化烯烴三組分1, 2-不對(duì)稱(chēng)雙碳官能團(tuán)化反應(yīng)。該反應(yīng)可兼容眾多偶聯(lián)底物以及1, 2-二取代(E)-和(Z)-烯烴,能以良好的產(chǎn)率和對(duì)映選擇性得到雙官能團(tuán)化產(chǎn)物。作者還開(kāi)發(fā)了后續(xù)的脫保護(hù)反應(yīng),用于合成對(duì)映體富集的1, 2-二芳基胺。DFT計(jì)算研究揭示了立體誘導(dǎo)的機(jī)制以及導(dǎo)向基和配體的作用。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn