

(圖片來源:Nat. Commun.)
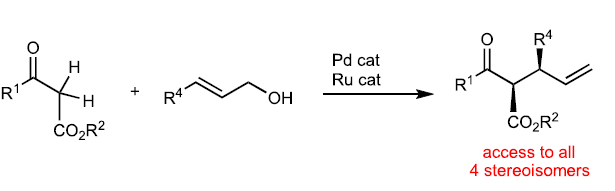
β-酮酯的α-烷基化反應是構建C-C鍵的有效手段,其廣泛的應用于有機合成中。而發展其立體選擇反應仍然是一個重大的挑戰,主要是由于產物容易在酸性或堿性條件下發生外消旋化。近些年,化學家們利用Tsuji–Trost類型的不對稱烯丙基化反應來實現1,3-二羰基化合物的烷基化,但是其通常僅能實現單一立體中心的構建(Fig. 1a),且催化體系不能同時控制兩個季碳中心的立體化學(Fig. 1b)。最近,日本名古屋大學Masato Kitamura和日本國家先進工業科學技術研究所Shinji Tanaka課題組發展了Ru/Pd協同催化體系,實現了α-非取代β-酮酯與烯丙基醇的不對稱脫水縮合反應,以良好的區域選擇性、對映選擇性以及非對映選擇性實現了具有兩個連續手性中心的α-單取代產物合成(Fig. 1c)。
(圖片來源:Nat. Commun.)
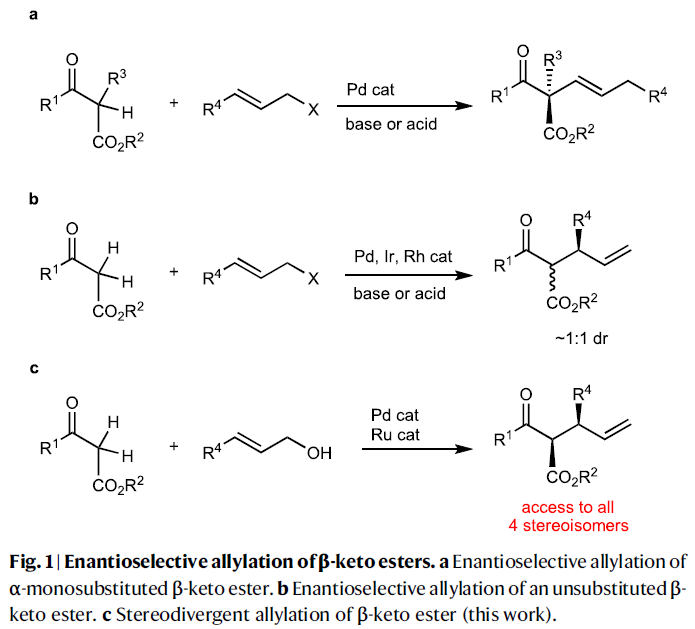
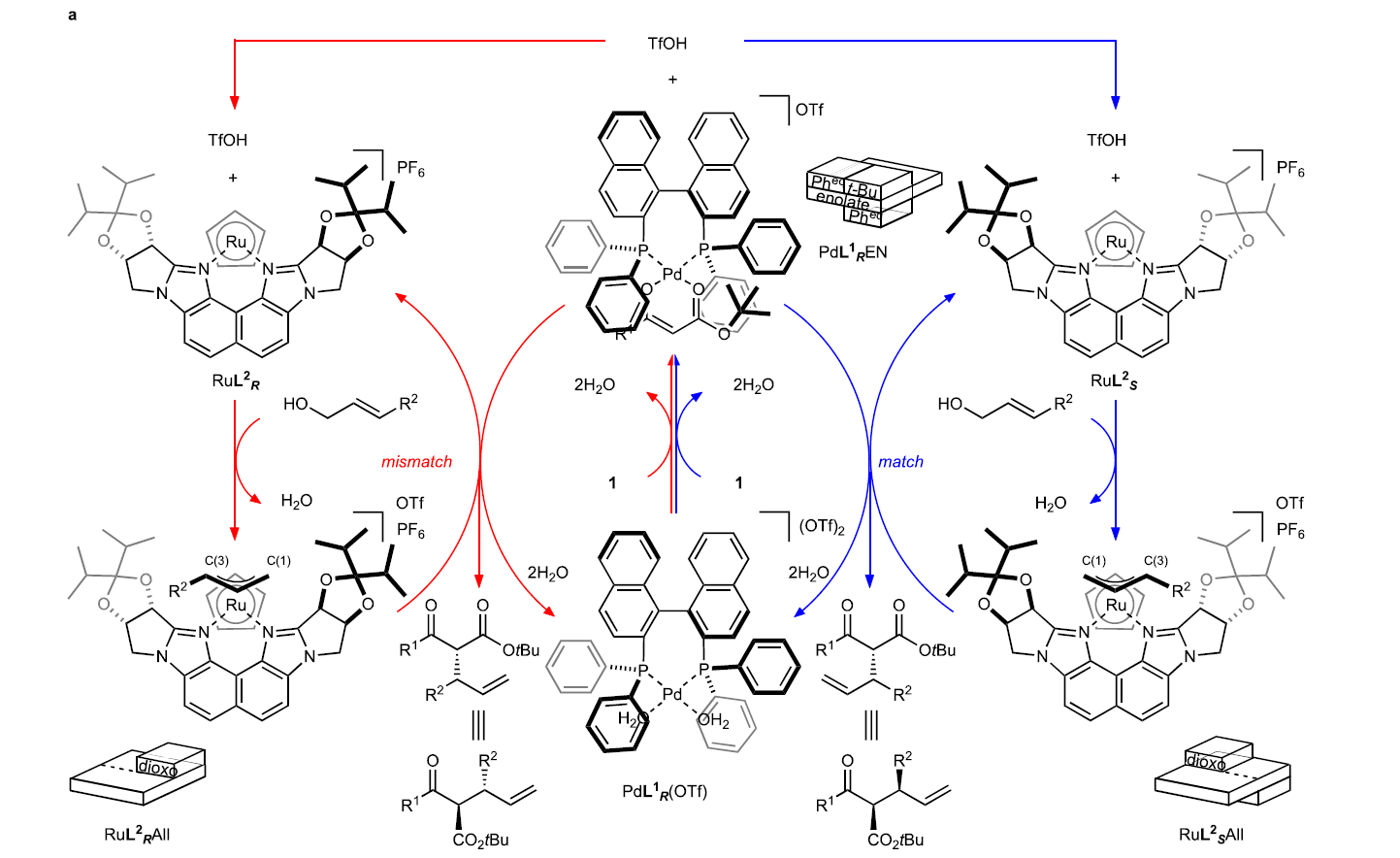
基于立體發散烯丙基化反應的二元手性催化體系(M1XL1和M2L2),作者提出了此轉化的基本策略(Fig. 2):首先,催化劑M1XL1活化β-酮酯1形成相應的金屬烯醇中間體(M1 enolate)。陰離子X作為Br?nsted堿攫取β-酮酯1中的質子形成HX。催化劑M2L2活化烯丙基醇2形成π-烯丙基絡合物(M2 π-allyl)。由于烯丙醇與HX之間形成氫鍵后會活化C-O鍵,因此會促進其與M2L2的氧化加成過程,并伴隨著水的釋放。最后,金屬烯醇中間體(M1 enolate)與π-烯丙基絡合物(M2 π-allyl)反應得到烯丙基化產物3。由于M1L1和M2L2的不同手性環境可以區分金屬烯醇中間體和π-烯丙基的對映面選擇性。因此,對M1XL1和M2L2的選擇至關重要。
(圖片來源:Nat. Commun.)
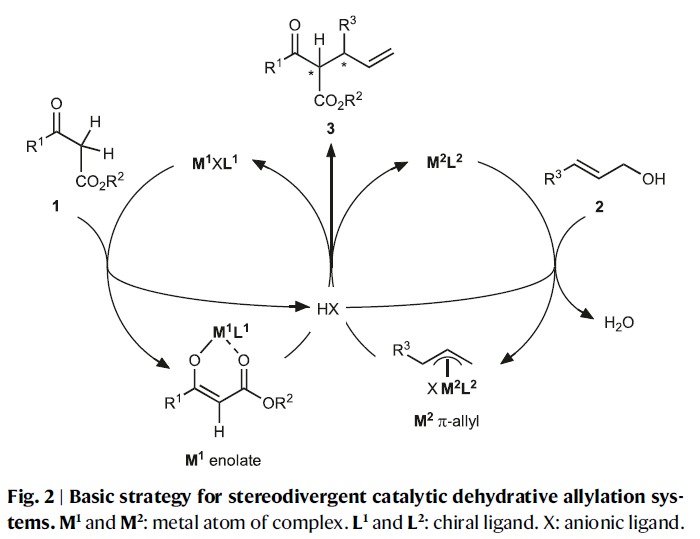
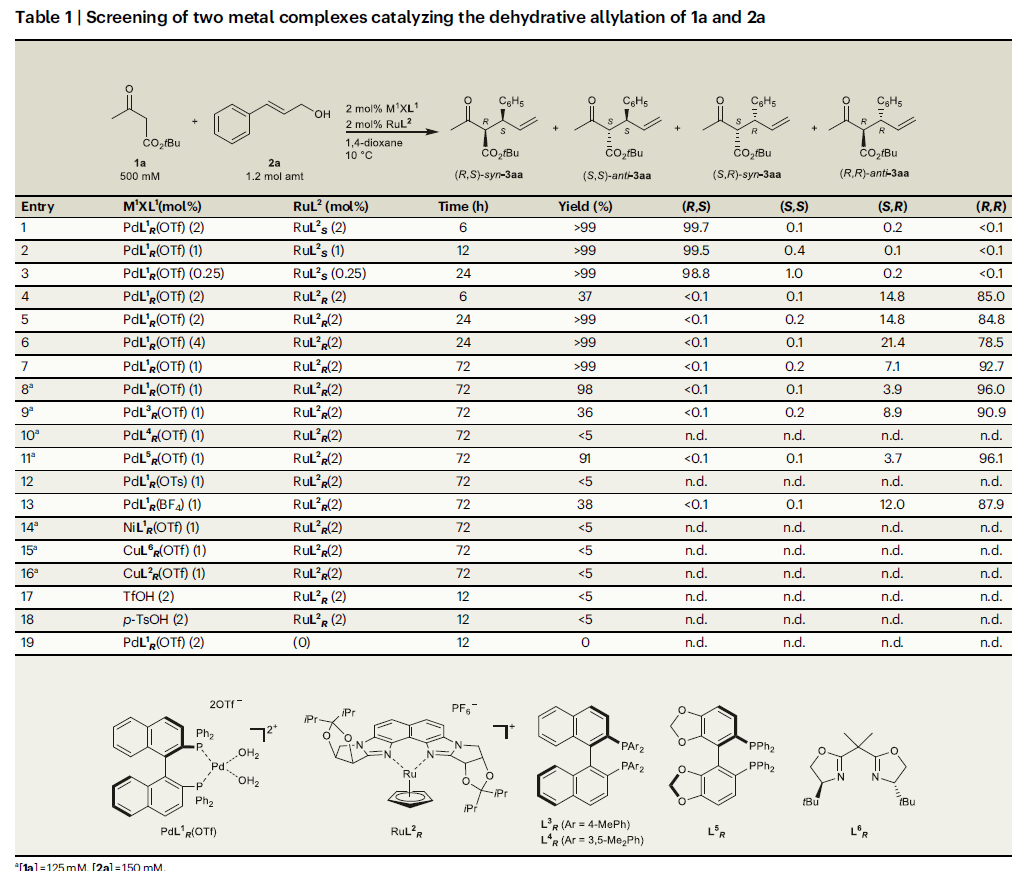
作者首先利用3-氧代丙酸叔丁酯1a和肉桂醇2a作為模板底物對反應進行探索(Table 1)。通過條件篩選,作者發現RuL2R/PdL1R(OTf)(非匹配的催化體系)和RuL2S/PdL1R(OTf) (匹配的催化體系)體系可以以良好的區域選擇性、對映選擇性以及非對映選擇性實現α-單取代產物的合成。
(圖片來源:Nat. Commun.)
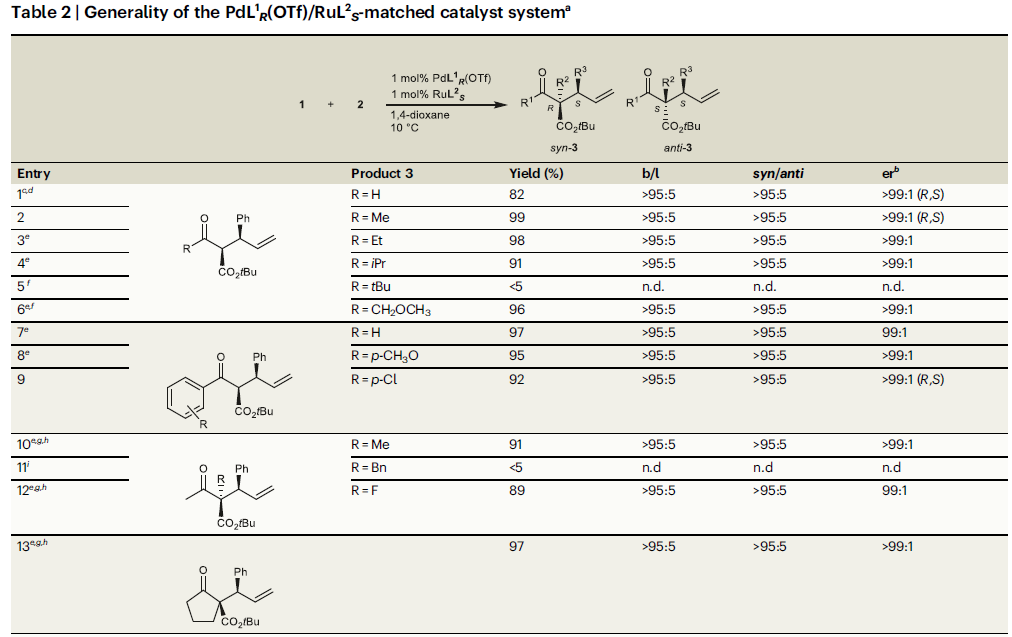
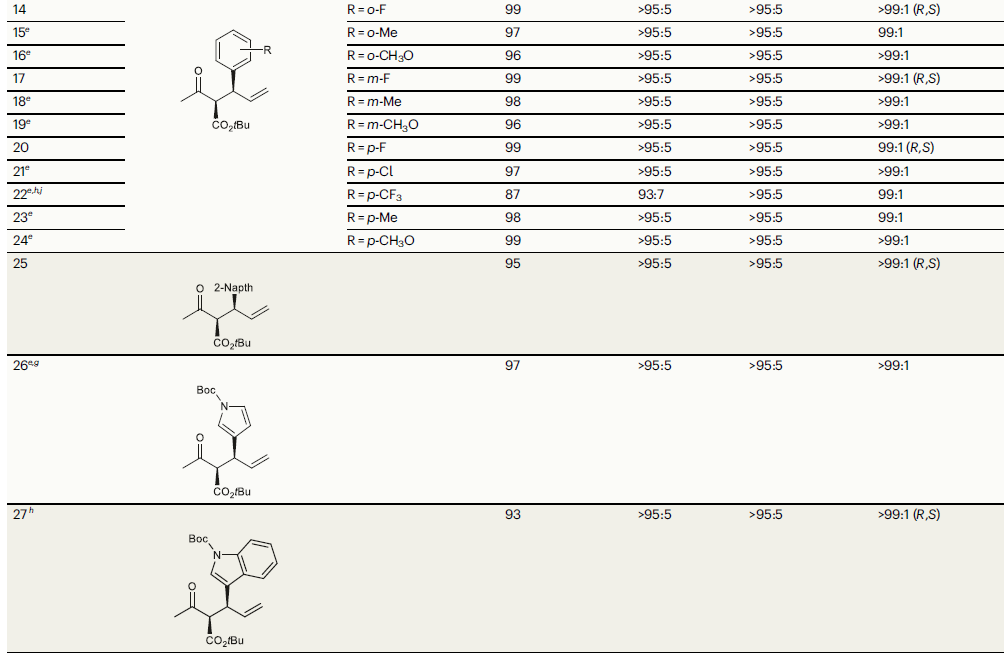
在得到最優條件后,作者對在PdL1R(OTf)/RuL2S催化體系(匹配的催化體系)中β-酮酯1與肉桂醇2a反應時的底物兼容性進行探索(Table 2)。將1中羰基所連接的Me變化成H、Et、iPr、CH2OCH3、Ph后均未對反應性和選擇性產生影響(entries 1-4,6,7)。具有較大位阻的tBu存在時會完全抑制反應(entry 5)。此外,無論缺電子苯環還是富電子苯環均可與此體系兼容(entries 8,9)。α-位Me或F取代的β-酮酯具有良好的兼容性,而α-位Bn取代的底物并沒有反應活性(entries 10-12)。值得注意的是,環狀酮酯底物也具有良好的反應性(entry 13)。
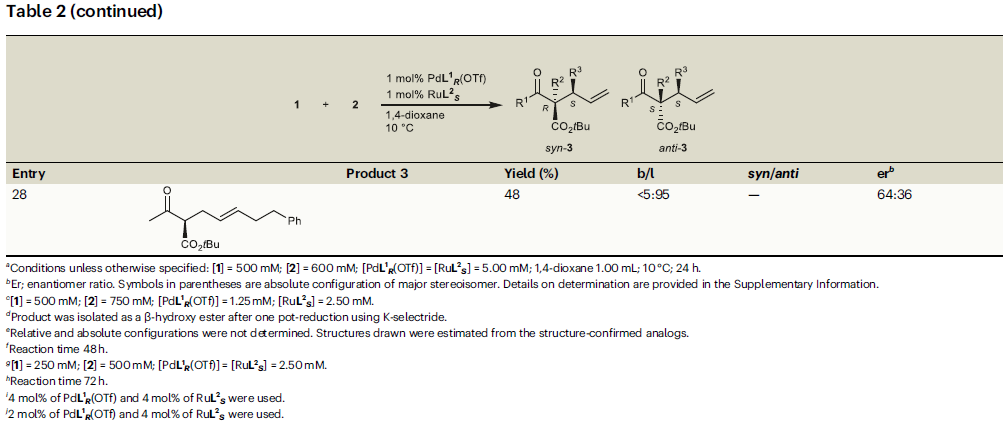
接下來,作者對烯丙基醇2的底物適用性進行探索(Table 2)。實驗結果表明,將F、Me、OMe、Cl、CF3等一系列取代基引入到肉桂醇苯環的鄰、間、對位后均具有良好的兼容性(entries 14-24)。此外,將苯基替換成其它芳環也具有良好的反應性(entries 25-27)。值得注意的是,烷基取代的烯丙基醇參與反應時以中等的對映選擇性(64:36 er)得到線性產物(entry 28)。
(圖片來源:Nat. Commun.)
(圖片來源:Nat. Commun.)
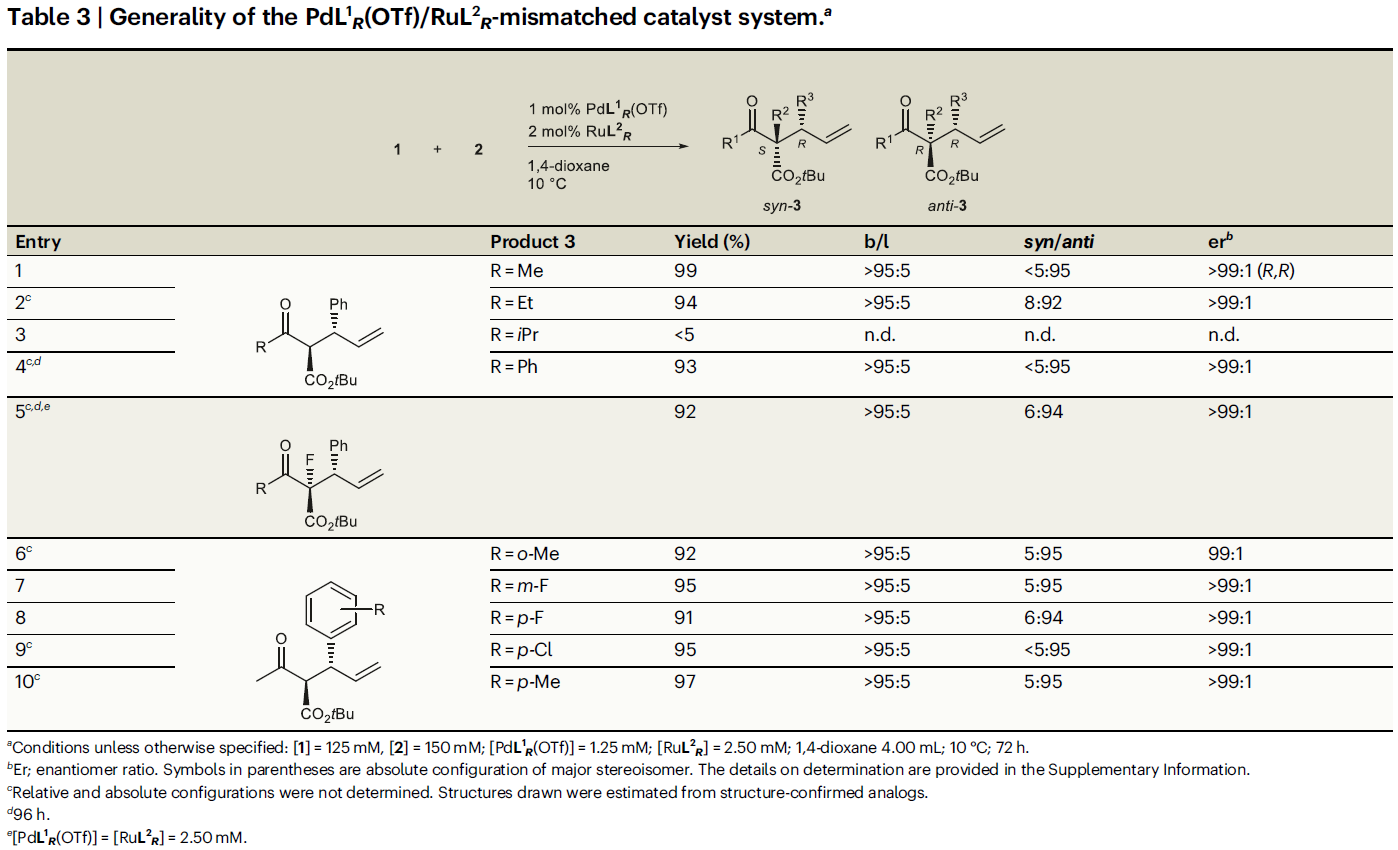
在非匹配的催化體系(PdL1R(OTf)和RuL2R)中(Table 3),乙基或苯基取代的β-酮酯與匹配的催化體系反應結果基本類似,但是異丙基取代的底物不能兼容(entries 1-4)。α-位F代的β-酮酯仍具有良好的兼容性(entry 5)。此外,烯丙基醇2的底物適用性與匹配的催化體系反應結果基本類似(entries 6-10)。
(圖片來源:Nat. Commun.)
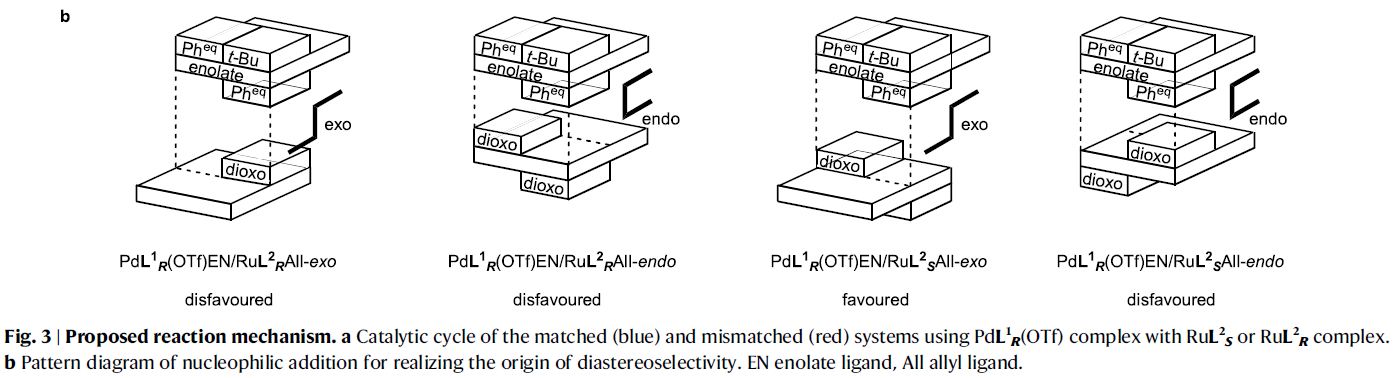
接下來,作者提出了此反應可能的反應機理(Fig. 3)。首先,PdL1R(OTf)與底物1反應形成鈀烯醇中間體(Pd enolate),且烯醇陰離子與鈀金屬中心以雙齒模式配位。此外,反應中釋放的TfOH會與RuL2S結合來實現烯丙基醇的活化從而形成endo-π-烯丙基物種RuL2SAll,并釋放一分子水(RDACat機理)。最后,鈀烯醇中間體進攻烯丙基物種得到目標產物3并再生PdL1R(OTf)和RuL2S。值得注意的是,在π-烯丙基絡合物RuL2SAll的形成過程中,由于手性配體L2S的存在,使得其可以選擇性的以單一異構體形成RuL2SAll絡合物。此外,由于π-烯丙基上的取代基R2處于遠離手性配體L2S大位阻部分的位置,因此Ru占據了π-烯丙基配體的Si面(R2 = Ph)(如RuL2SAll所示)。在PdL1REN中,由于BINAP骨架上的兩個苯基遮擋了平面烯醇化物的一側,而羧酸鹽上的叔丁基為了避免與BINAP的一個苯基的立體排斥作用而處于另一側。由于兩個苯基和一個叔丁基均占據了一定的空間,使得鈀烯醇中間體只僅能從外部接近RuL2SAll從而形成(R,S)-3作為主要的異構體。此外,反應中大位阻的叔丁基對非對映選擇性至關重要,而當使用甲基代替叔丁基時,僅得到混合的非對映異構體(1:1)。值得注意的是,不論是在匹配或不匹配的催化體系中,π-烯丙基部分的對映面選擇性幾乎是完美的,且烯醇中間體的選擇受到空間位阻的高度影響(Fig. 3a)。此外,Fig. 3b展示了匹配或非匹配催化體系的親核進攻模型。模型表明親核進攻過程由于BINAP (L1)的聯萘骨架和Naph-diPIM-dioxo-iPr (L2)的萘骨架的相對立體化學不同會產生exo和endo兩種模式。
(圖片來源:Nat. Commun.)
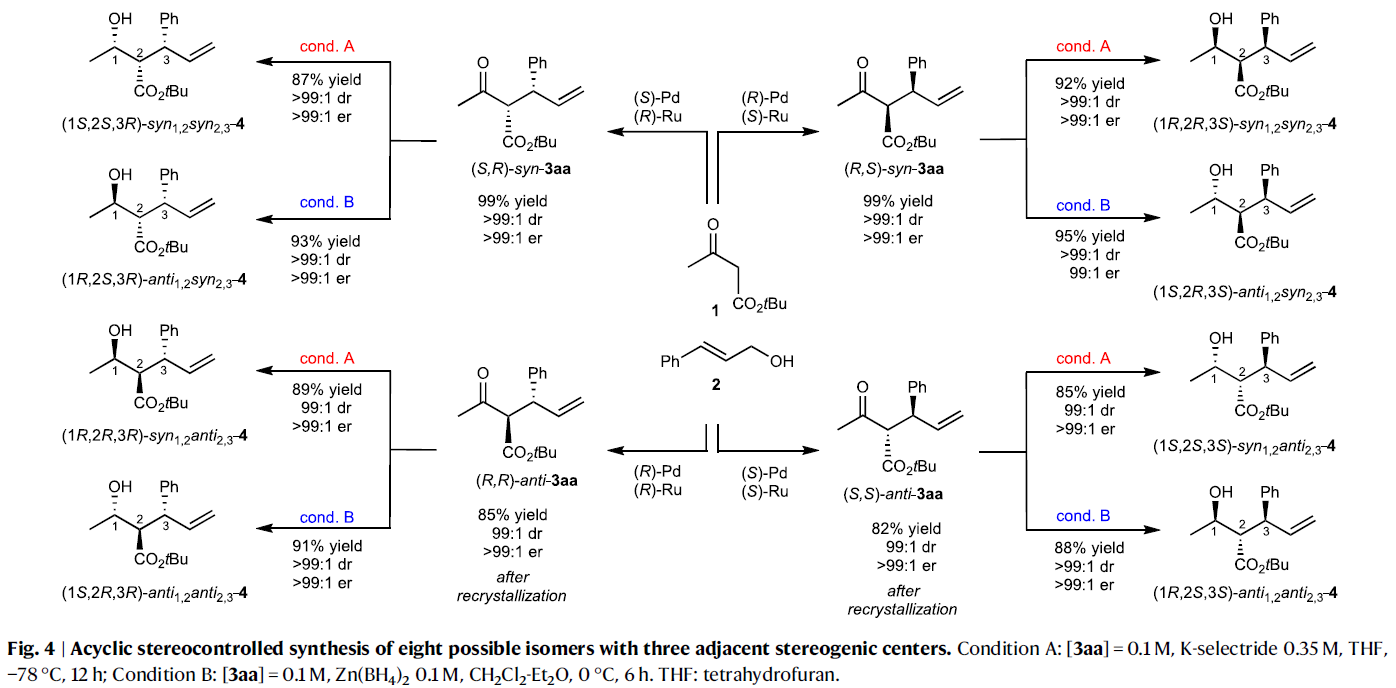
對產物3中的羰基進行還原可以實現另一個立體中心的構建。如Fig. 4所示,通過非對映選擇性還原過程可以控制三個相鄰的手性碳中心。例如,在匹配的PdL1R(OTf)/RuL2S體系中得到的產物(R,S)-syn-3aa可以被K-selectride(cond. A)還原得到產物syn, syn-4。且用Felkin-Ahn模型可以進一步解釋非對映選擇性的來源。此外,使用Luche還原(LaCl3/NaBH4)仍可以以較高的選擇性實現syn, syn-4(93:7 dr)的合成。相反,當使用Zn(BH4)2(cond. B)還原(R,S)-syn-3aa時卻得到另一種異構體anti, syn-4。而此還原過程可以通過Zimmerman–Traxler螯合模式進行解釋。并且,利用上述方法還可以將(S,R)-syn-3aa分別還原(S,S,R)-syn, syn-4和(R,S,R)-anti, syn-4。此外,(R,R)-anti-3aa和(S,S)-anti-3aa也可以分別利用上述還原方法實現高對映選擇性還原。總體來說,利用上述還原方法與發展的立體發散烯丙基化反應相結合,可以實現8種非對映異構體的合成。
(圖片來源:Nat. Commun.)
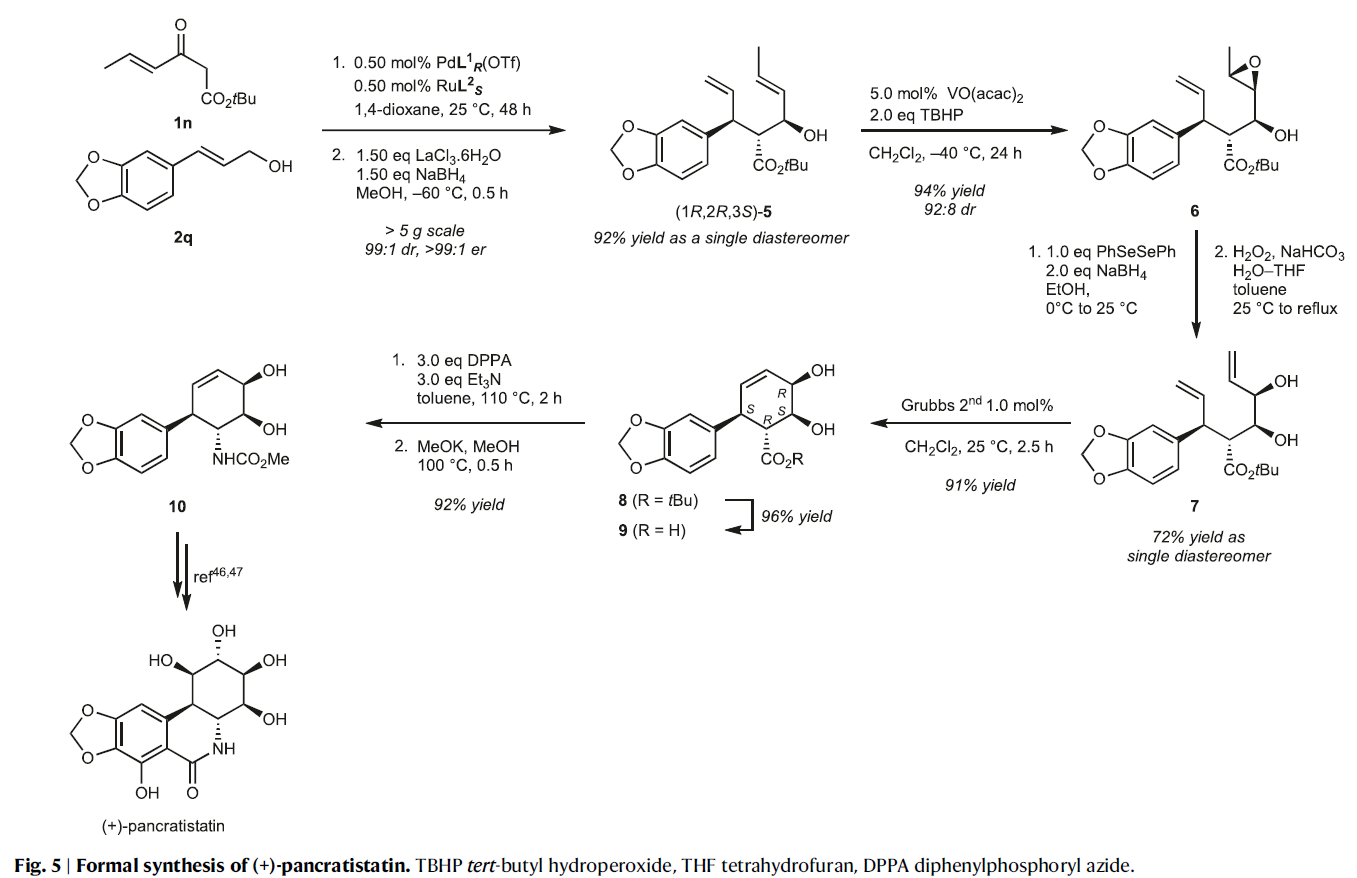
最后,作者應用發展出的方法實現了(+)-pancratistatin的形式合成,證明了此方法的實用性(Fig. 5)。首先,作者使用β-酮酯1n和烯丙基醇2q并利用發展出的催化方法(0.5 mol% PdL1R(OTf), RuL2S, 1,4-dioxane, 25 °C, 48 h, > 99% yield (NMR), >99:1 er, 99:1 dr)和Luche還原一鍋實現單一異構體5的合成(92%)。隨后,5中的內烯部分可以通過與VO(acac)2/TBHP反應,高區域選擇性和非對映選擇性實現環氧化產物6的合成(94%, 92:8 dr)。接下來,6的環氧部分通過區域選擇性開環、親核硒醇加成、硒醚的氧化以及β-消除過程得到烯丙基醇產物7。隨后7利用Grubbs二代催化劑通過關環復分解反應以91%的產率得到鄰二醇產物8。而8可以通過酯水解過程以接近定量產率得到相應的羧酸產物9。最后,9通過Curtius重排以92%的產率得到中間體10,并根據Hudlicky報道的過程即可實現(+)-pancratistatin的合成(J. Am. Chem. Soc. 1996, 118, 10752)。雖然此合成方法在合成步數和總產率并不是最突出的,但其每一步的化學產率都很高。而當每種手性催化劑使用得當時,實現立體控制是很簡單的。即通過改變催化劑的手性和試劑的種類,即可實現各種立體異構體的合成。此外,此方法還可以減少保護基的使用。
總結
日本名古屋大學Masato Kitamura和日本國家先進工業科學技術研究所Shinji Tanaka課題組發展了Ru/Pd協同催化體系,實現了α-非取代β-酮酯與烯丙基醇的不對稱脫水縮合反應,以良好的區域選擇性、對映選擇性以及非對映選擇性實現了α-單取代產物的合成。通過對催化體系中鈀或釕絡合物的立體化學的調控,可以分別選擇性實現四種非對映體的合成。此外,通過對產物中羰基的非對映選擇性還原可以實現三個連續立體中心的構建,實現八種非對映異構體的合成。值得注意的是,利用發展的催化體系可以實現(+)-pancratistatin的形式合成,證明了此反應具有良好的實用性。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn