




由于免疫測(cè)定具有高靈敏度和選擇性,使它們對(duì)于檢測(cè)不同應(yīng)用中的不同生物分子特別有用。傳統(tǒng)的免疫傳感器基于三明治測(cè)定形式,將兩種抗體結(jié)合到目標(biāo)分析物的不同區(qū)域,并將特定識(shí)別抗體轉(zhuǎn)換為物理上可檢測(cè)的電子或光學(xué)信號(hào)。通常通過(guò)用化學(xué)試劑修飾換能器表面來(lái)實(shí)現(xiàn)捕獲抗體受體與信號(hào)轉(zhuǎn)導(dǎo)的結(jié)合。作者報(bào)道了一種新的生物電子親和傳感策略,該策略將天然細(xì)胞膜作為識(shí)別層,作為傳統(tǒng)免疫測(cè)定中有吸引力的抗體受體替代品。細(xì)胞膜涂層技術(shù)構(gòu)成了一種能夠在合成材料或設(shè)備上復(fù)制細(xì)胞膜的豐富生物功能的強(qiáng)大策略。天然細(xì)胞膜涂層保留了細(xì)胞膜上膜蛋白和脂質(zhì),因此賦予涂層裝置具有與生物系統(tǒng)交互的獨(dú)特性能,包括捕獲和分離生物靶標(biāo)以及阻止非特異性吸附。
在這項(xiàng)工作中,作者衍生了巨噬細(xì)胞膜,將它們涂在電化學(xué)傳感器上,并檢查了它們?cè)跈z測(cè)膜親和性生物分子方面的性能(圖1A)。由于腫瘤壞死因子-α (TNF-α) 在許多炎癥性疾病中發(fā)揮著重要作用,因此作者選擇其作為模型分析物。在該仿生平臺(tái)中,TNF-α的特異性檢測(cè)依賴于巨噬細(xì)胞膜識(shí)別層上的天然TNF-α受體和辣根過(guò)氧化物酶(HRP)標(biāo)記的抗TNF-α檢測(cè)抗體(HRP-Ab)。為了防止非特異性結(jié)合,作者進(jìn)一步將巨噬細(xì)胞膜與紅細(xì)胞膜融合,并使用混合膜對(duì)傳感器進(jìn)行功能化。具體來(lái)說(shuō),混合細(xì)胞膜功能化的金電極芯片用于基于單樣品孵育的TNF-α親和力測(cè)定,其中靶細(xì)胞因子被細(xì)胞膜上TNF-α受體選擇性捕獲,隨后被HRP-Ab標(biāo)記。這種三明治模式的細(xì)胞膜實(shí)驗(yàn)采用3,3',5,5'-四甲基聯(lián)苯胺 (TMB)/H2O2作為介體/底物氧化還原檢測(cè)系統(tǒng)。在靶標(biāo)TNF-α存在下,被捕獲的HRP酶在H2O2的支持下催化TMB氧化,隨后被氧化的TMB通過(guò)電化學(xué)還原反應(yīng)恢復(fù)到原始狀態(tài)。實(shí)驗(yàn)得到的還原電流與傳感器表面捕獲的HRP-Ab量相關(guān),同時(shí)還與目標(biāo)TNF-α的水平成正比。為了區(qū)分空白與目標(biāo)TNF-α,常用的TMB/HRP/ H2O2比色法需要幾分鐘氧化溶液中的TMB;然而,在電流分析中, 在施加恒定電位(-0.1 V)150秒后,氧化的TMB被選擇性地還原。在這種檢測(cè)過(guò)程中,結(jié)合在傳感器表面的HRP-Ab會(huì)迅速氧化TMB,進(jìn)而促進(jìn)電化學(xué)信號(hào)變化。作者通過(guò)蛋白質(zhì)印跡分析證實(shí)了巨噬細(xì)胞膜上存在TNF-α受體(圖 1B )。如圖C,傳感器對(duì)10 nM的TNF-α具有超靈敏和選擇性的檢測(cè),而對(duì)過(guò)量(300nM)的其它細(xì)胞因子的響應(yīng)可忽略不計(jì),并能夠檢測(cè)低至500 pM的TNF-α。
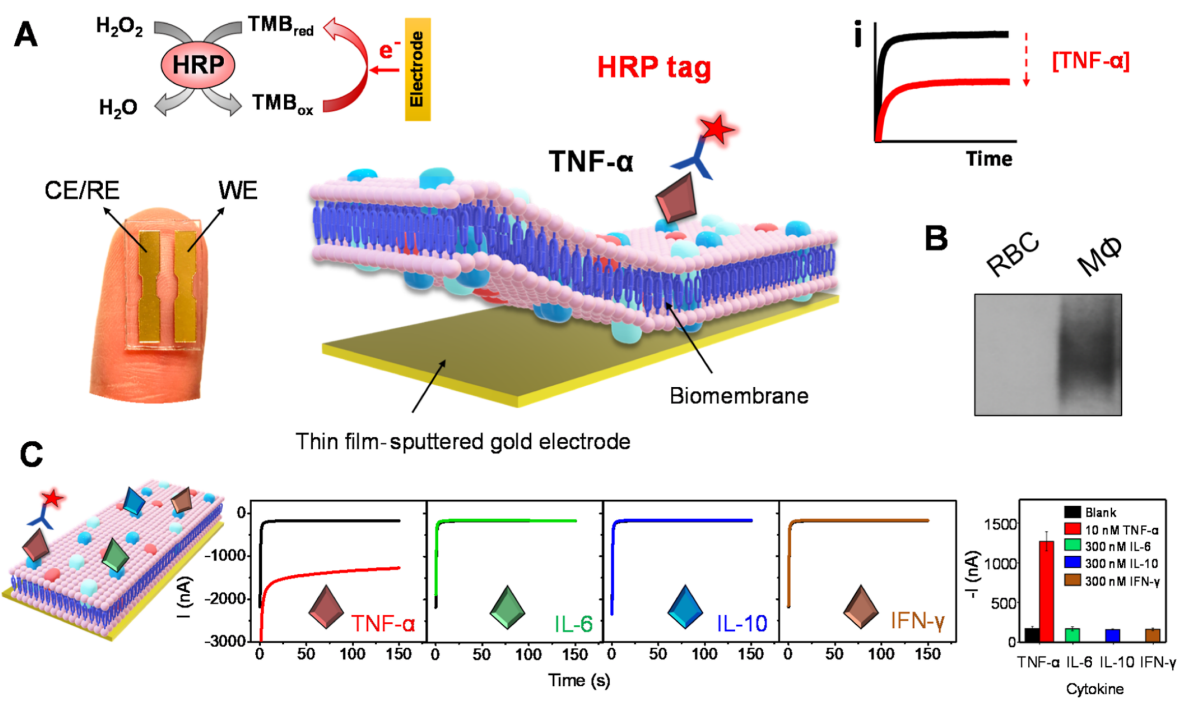
圖1. 基于細(xì)胞膜的TNF-α 檢測(cè)的生物電子親和傳感器。(圖片來(lái)源:J. Am. Chem. Soc.)
作者通過(guò)三步制備了基于細(xì)胞膜的生物電子傳感器芯片(圖2A)。首先,將純化的紅細(xì)胞和巨噬細(xì)胞膜超聲,并融合生成混合膜囊泡。隨后,為了在工作電極區(qū)域產(chǎn)生均勻的生物膜涂層(不覆蓋參考電極),將調(diào)整體積后的囊泡30 mL懸浮液滴鑄到鍍金電極上。此外,作者還通過(guò)調(diào)整囊泡負(fù)載和混合膜涂層組成,探索了巨噬細(xì)胞/紅細(xì)胞混合膜的協(xié)同功能。考慮到包括TNF-α在內(nèi)的許多血清蛋白都含有巰基,可以與傳感器芯片表面進(jìn)行非特異性結(jié)合,導(dǎo)致假陽(yáng)性信號(hào)。為了抑制非特異性結(jié)合,作者使用紅細(xì)胞膜衍生囊泡覆蓋電極,并通過(guò)優(yōu)化細(xì)胞膜負(fù)載有效實(shí)現(xiàn)抗生物污染的效果(圖2B)。 在PBB(含有1%BSA的磷酸鹽緩沖液)溶液中,用計(jì)時(shí)安培法評(píng)估金表面HRP-Ab和TNF-α蛋白的非特異性吸附水平。在沒有和存在高濃度TNF-α的情況下,測(cè)試了未涂層和涂有不同RBC膜濃度的傳感器芯片性能。結(jié)果顯示,當(dāng)金表面涂覆大量的膜,可以更好地防止不需要的蛋白質(zhì)吸附。0.05 mg/mL(1.5μg)的膜負(fù)荷能夠使最小附著量HRP Ab和TNF-α蛋白所產(chǎn)生的信號(hào)空白(S/B)比值變化到達(dá)平臺(tái)。接下來(lái),優(yōu)化兩種膜的混合比例,用于高靈敏度檢測(cè)細(xì)胞因子(圖2C)。具體來(lái)說(shuō),在沒有和存在100 nM的TNF-α情況下,測(cè)量了生物傳感器上混合膜涂層的中兩種膜的比例從0:1(100%RBC)到1:0(100%巨噬細(xì)胞)時(shí),S/B比率值的變化,這是由于巨噬細(xì)胞含有TNF-α受體,隨著巨噬細(xì)胞的增加,更多的TNF-α/HRP-Ab結(jié)合物被捕捉到傳感器表面上,導(dǎo)致其敏感性增加(圖2C)。因此,作者選擇巨噬細(xì)胞/紅細(xì)胞膜比為3:1的混合細(xì)胞膜制備TNF-α生物傳感器,該傳感器包含足夠數(shù)量的TNF-α受體用于檢測(cè),以及足夠數(shù)量的紅細(xì)胞膜用于防止非特異性吸附。
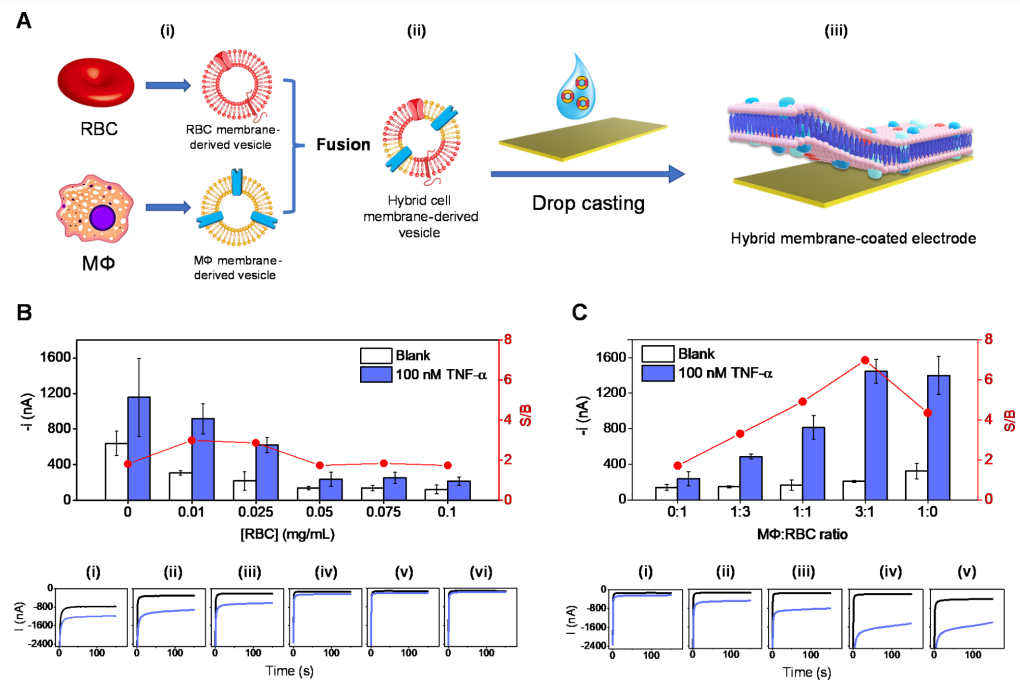
圖2. MΦ/RBC混合膜涂層生物電子傳感器芯片的制造和優(yōu)化。(圖片來(lái)源:J. Am. Chem. Soc.)
作者使用雙熒光圖像來(lái)驗(yàn)證金電極表面上的囊泡融合(圖3A)。實(shí)驗(yàn)分別使用DiI和DiO標(biāo)記巨噬細(xì)胞和紅細(xì)胞膜,結(jié)果表明在金片上形成了高度均勻的混合細(xì)胞膜涂層。此外,SEM表征進(jìn)一步驗(yàn)證裸金電極表面通過(guò)滴注法形成細(xì)胞膜涂層的穩(wěn)定性(圖3B)。結(jié)果表明,與粒狀金表面相比,生物膜表面覆蓋率更高。隨后,對(duì)不同的細(xì)胞膜涂層方法進(jìn)行檢測(cè),通過(guò)使用高電荷轉(zhuǎn)移電阻值證實(shí)滴注法是最有效的方法(圖3C)。在評(píng)估操作特性后,對(duì)生物電子芯片的制造及TNF-α的生物檢測(cè)重復(fù)性通過(guò)比較五個(gè)獨(dú)立測(cè)量5 nM TNF-α計(jì)時(shí)安培標(biāo)準(zhǔn)值進(jìn)行評(píng)估(圖3D)。為了調(diào)查細(xì)胞膜涂層芯片的物理特性,作者通過(guò)AFM分析研究了細(xì)胞膜涂層的形態(tài)(圖3E),觀察到混合膜涂層的平均厚度約為50 nm。
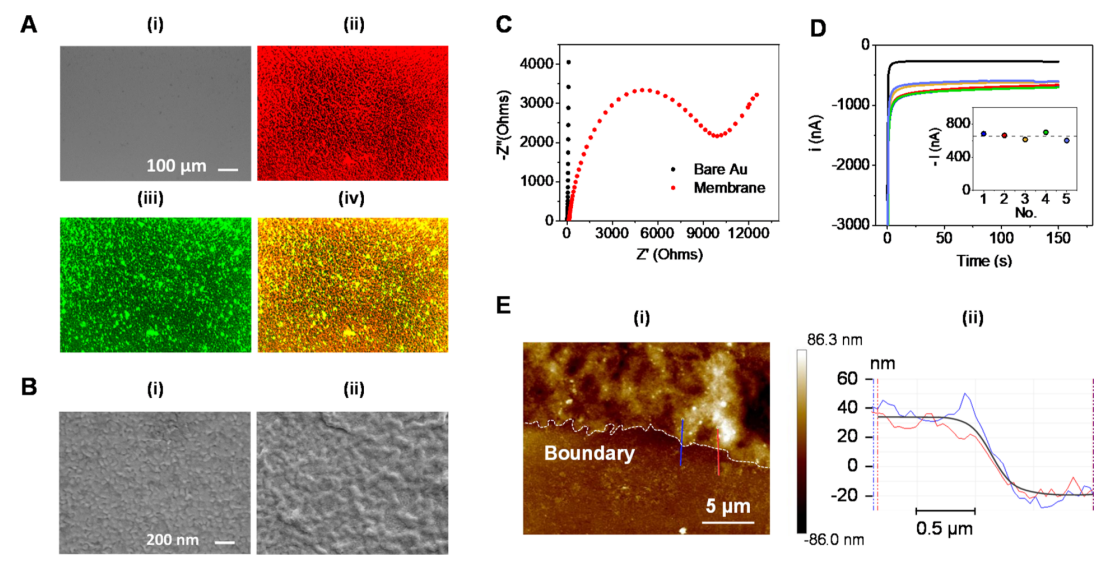
圖3. 混合細(xì)胞膜生物電子傳感器芯片的表征。(圖片來(lái)源:J. Am. Chem. Soc.)
在優(yōu)化生物膜組成后,作者測(cè)試了混合膜涂層生物電子傳感器對(duì)不同的納米級(jí)濃度TNF-α的檢測(cè)能力。首先使用PBB培養(yǎng)基對(duì)生物傳感器的靈敏度進(jìn)行評(píng)估。實(shí)驗(yàn)檢測(cè)了不同孵育時(shí)間下,不同濃度TNF-α的響應(yīng)信號(hào)(圖4A)。隨后構(gòu)建了TNF-α校準(zhǔn)曲線(R2=0.9985),證實(shí)了基于細(xì)胞膜生物傳感器可以在5分鐘內(nèi)快速捕獲TNF-α并產(chǎn)生可測(cè)量的信號(hào)。作者還評(píng)估TNF-α檢測(cè)傳感器的選擇性,研究了其他細(xì)胞因子對(duì)電流信號(hào)的影響。結(jié)果證實(shí),修飾的生物膜有足夠的TNF-α結(jié)合位點(diǎn),因此,檢測(cè)不受高IL-6濃度的影響。同時(shí),作者證實(shí)了該傳感器可以在多細(xì)胞因子樣本矩陣中實(shí)現(xiàn)對(duì)TNF-β細(xì)胞因子的選擇性檢測(cè)(圖4B)。
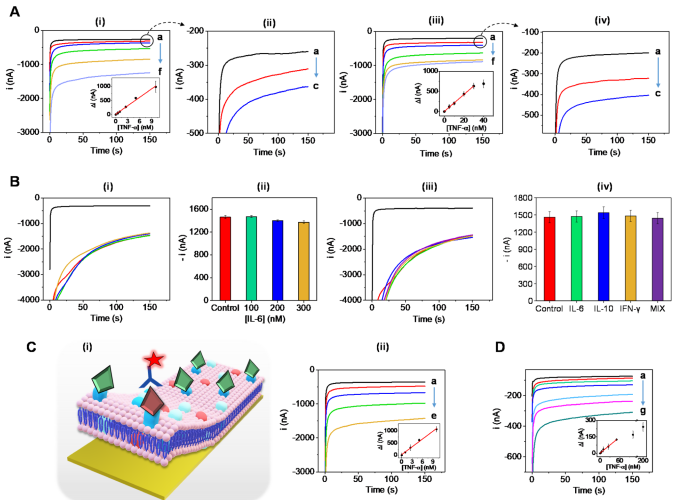
圖4. 緩沖溶液中TNF-α的校正曲線。(圖片來(lái)源:J. Am. Chem. Soc.)
總結(jié) 作者通過(guò)實(shí)驗(yàn)證明使用天然細(xì)胞膜作為識(shí)別層,構(gòu)建的生物膜涂層電化學(xué)傳感器能夠?qū)?/span>TNF-α細(xì)胞因子進(jìn)行高度特異、靈敏和快速檢測(cè)。該傳感器在復(fù)雜體液或高濃度細(xì)胞因子環(huán)境中,對(duì)不同痕量的TNF-α具有良好的分析性能。實(shí)驗(yàn)表明,在傳感器制備過(guò)程中,巨噬細(xì)胞膜上表達(dá)的TNF-α受體的完整性和功能性以及紅細(xì)胞膜的抗生物污染性被很好的保留下來(lái)。不同細(xì)胞類型的多樣性和獨(dú)特功能為開發(fā)具有廣泛應(yīng)用的仿生傳感平臺(tái)提供了相當(dāng)大的前景,為生物傳感器的應(yīng)用新領(lǐng)域鋪平了道路。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn