



(圖片來源:Angew. Chem. Int. Ed.)
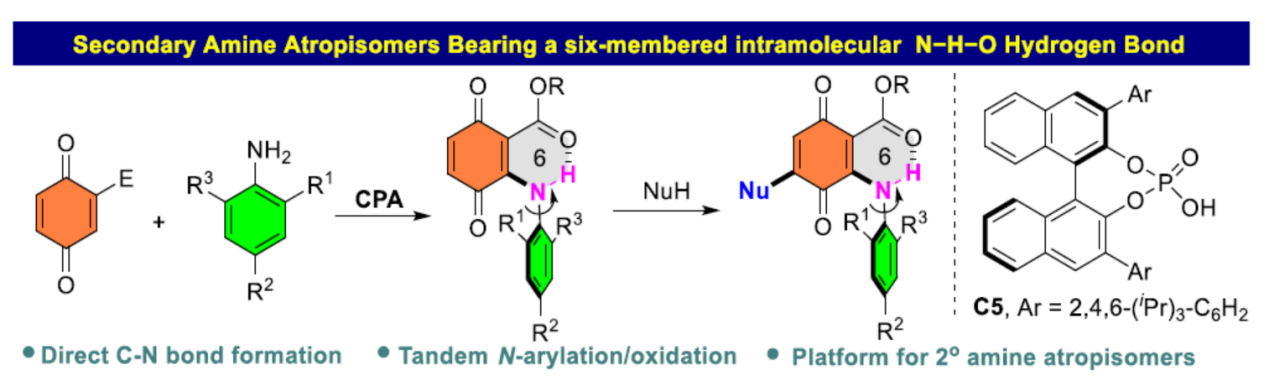
在過去的幾十年里,化學(xué)家們一直致力于軸手性分子的構(gòu)建研究。其中,具有軸手性的結(jié)構(gòu)獨(dú)特的阻旋異構(gòu)體,如(雜)二芳基、苯胺和芳基烯烴,引起了有機(jī)化學(xué)家的極大關(guān)注。二芳胺及其相關(guān)的骨架是許多生物活性天然產(chǎn)物和藥物中最常見的結(jié)構(gòu)單元之一,如FDA批準(zhǔn)的藥物博舒替尼(bosutinib)和比美替尼(binimetinib),以及其它非核苷逆轉(zhuǎn)錄酶(NNRT)和血管內(nèi)皮生長因子受體(VEGFR)抑制劑。由于二芳胺阻旋異構(gòu)體的旋轉(zhuǎn)能壘較低,導(dǎo)致其構(gòu)型不穩(wěn)定,易于互換。與其它穩(wěn)定的阻旋異構(gòu)體的合成方法相比,在二芳胺以及相關(guān)骨架中引入軸手性仍然具有挑戰(zhàn)性。
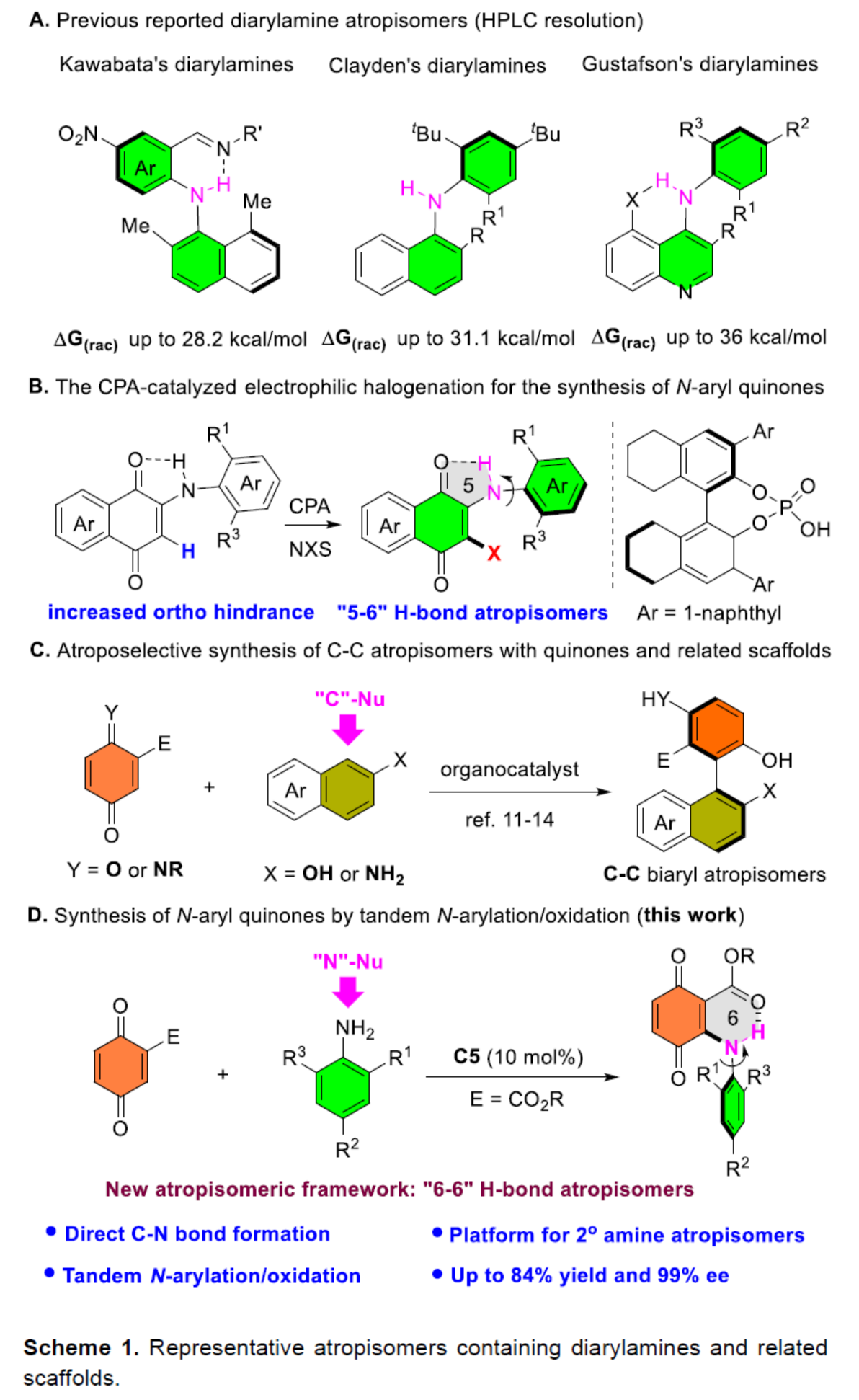
2009年,Kawabata課題組首次通過手性HPLC拆分合成了一系列含有N-H-N氫鍵的二芳胺阻旋異構(gòu)體。其中,分子內(nèi)氫鍵的形成對于穩(wěn)定軸手性是必要的(Scheme 1A)。基于手性HPLC拆分策略,Clayden課題組還實(shí)現(xiàn)了無分子內(nèi)氫鍵的無環(huán)二芳胺阻旋異構(gòu)對映體的合成。Gustafson課題組進(jìn)一步通過引入吡啶等缺電子雜環(huán)骨架,并引入分子內(nèi)的氫鍵,實(shí)現(xiàn)了高度穩(wěn)定的二芳胺阻旋異構(gòu)體的拆分。然而,上述三種光學(xué)活性二芳胺阻旋異構(gòu)體的合成均依賴于手性拆分策略。最近,Gustafson課題組報(bào)道了一種手性磷酸催化對映選擇性親電鹵化反應(yīng),從而以良好的收率和對映選擇性獲得了一系列立體化學(xué)穩(wěn)定的N-芳基醌(Scheme 1 B),這是文獻(xiàn)中首次通過不對稱催化合成二芳胺阻旋異構(gòu)體的方法。醌類化合物及其相關(guān)骨架長期以來一直是手性化合物的合成前體。最近,化學(xué)家們通過使用2-萘酚或2-萘胺作為碳親核試劑,合成了一系列非-C2對稱軸手性聯(lián)芳基化合物(Scheme 1C)。然而,迄今為止,氮親核試劑尚未應(yīng)用于這些不對稱催化反應(yīng)。近日,青島大學(xué)劉人榮課題組報(bào)道了一種手性磷酸催化醌與苯胺的阻轉(zhuǎn)選擇性偶聯(lián)反應(yīng),合成了一系列具有六元分子內(nèi)N-H-O氫鍵的N-芳基醌阻旋異構(gòu)體(Scheme 1D)。
(圖片來源:Angew. Chem. Int. Ed.)
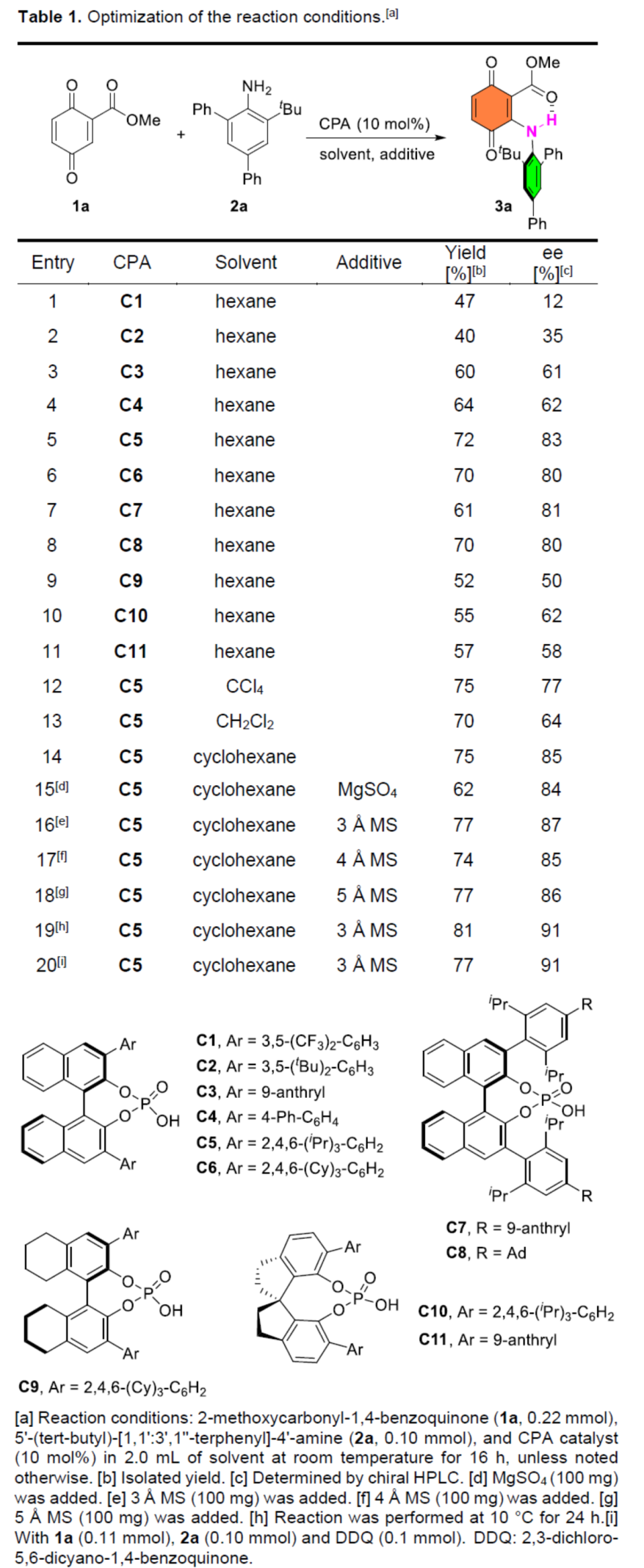
首先,作者以醌酯1a與苯胺衍生物2a作為模型底物,進(jìn)行了相關(guān)偶聯(lián)反應(yīng)條件的篩選(Table 1)。當(dāng)以C5作為催化劑,3? MS作為添加劑,在環(huán)己烷溶劑中10 oC反應(yīng)24 h,可以81%收率和91%ee得到產(chǎn)物3a。
(圖片來源:Angew. Chem. Int. Ed.)
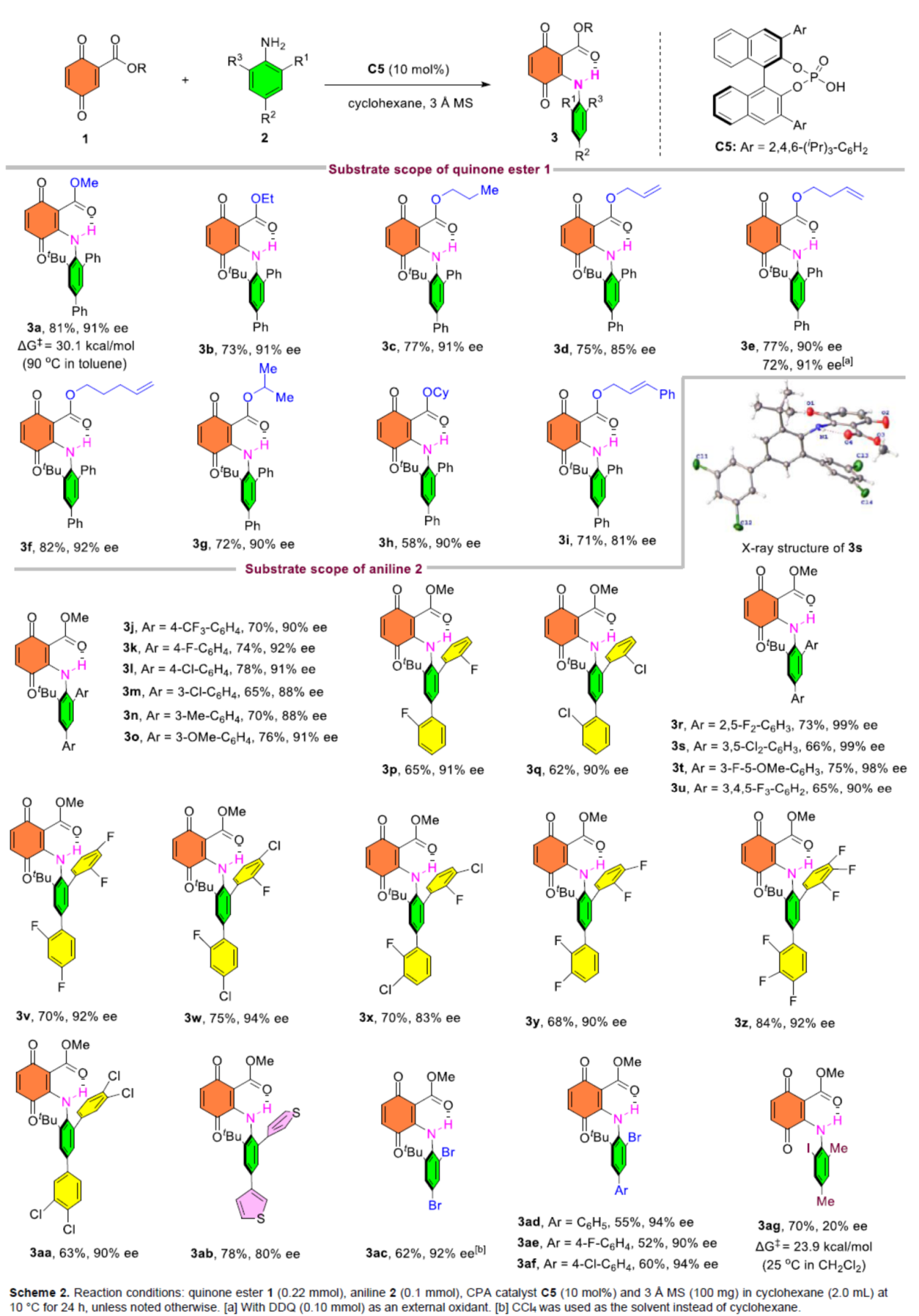
在獲得上述最佳反應(yīng)條件后,作者對底物范圍進(jìn)行了擴(kuò)展(Scheme 2)。首先,當(dāng)醌酯底物1中的R為一系列烷基取代時(shí),均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物3a-3i,收率為58-82%,ee為81-92%。其次,當(dāng)苯胺底物2中的R1、R2或R3為具有不同電性取代的芳基、噻吩基時(shí),均與體系兼容,獲得相應(yīng)的產(chǎn)物3j-3af,收率為52-84%,ee為80-99%。然而,當(dāng)苯胺底物2中含有鄰位碘取代的芳基時(shí),產(chǎn)物3ag的對映選擇性大幅降低。
(圖片來源:Angew. Chem. Int. Ed.)
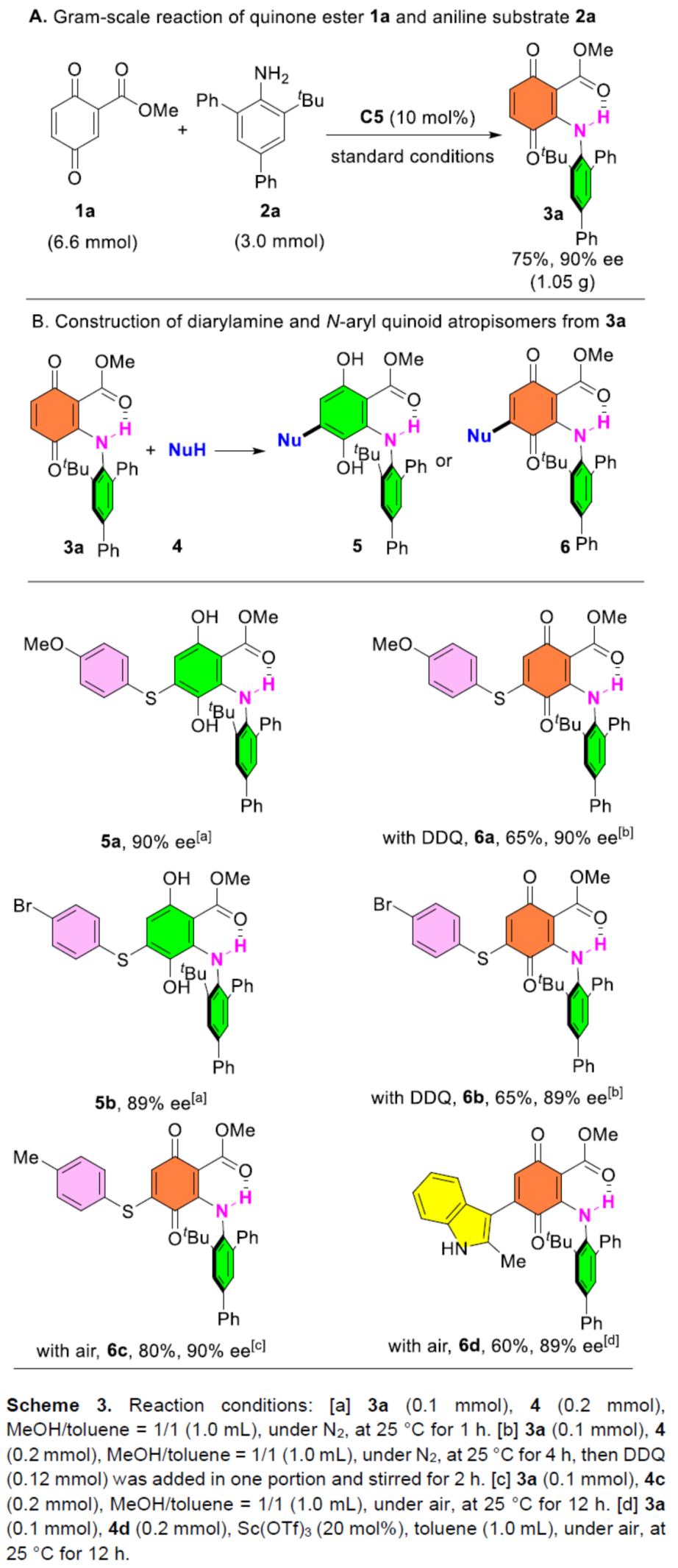
緊接著,作者對反應(yīng)的實(shí)用性進(jìn)行了研究(Scheme 3)。首先,克級規(guī)模實(shí)驗(yàn),同樣能夠以75%收率和90%ee得到產(chǎn)物3a。其次,3a可與不同的親核試劑進(jìn)行加成反應(yīng)。例如,當(dāng)使用親核試劑4-甲氧基苯硫醇4a時(shí),通過Michael加成可快速生成二芳胺阻旋異構(gòu)體5a,且對映選擇性沒有降低。然而,由于高富電子的5a在柱層析過程發(fā)生快速氧化,從而阻礙了其分離。因此,作者選用了DDQ重新氧化5a,從而以65%的收率和90%的ee獲得高度功能化的N-芳基醌阻旋異構(gòu)體6a。同時(shí),對溴苯基苯酚4b和對甲基苯基苯酚4c在該條件下也能順利進(jìn)行反應(yīng)。值得注意的是,即使在空氣中,也可以80%的收率和90%的ee獲得N-芳基醌阻旋異構(gòu)體6c。在Sc(OTf)3催化下,具有代表性的C-親核吲哚也可與3a順利反應(yīng),從而以60%的收率獲得相應(yīng)的N-芳基醌阻旋異構(gòu)體6d,且對映選擇性沒有降低。
(圖片來源:Angew. Chem. Int. Ed.)
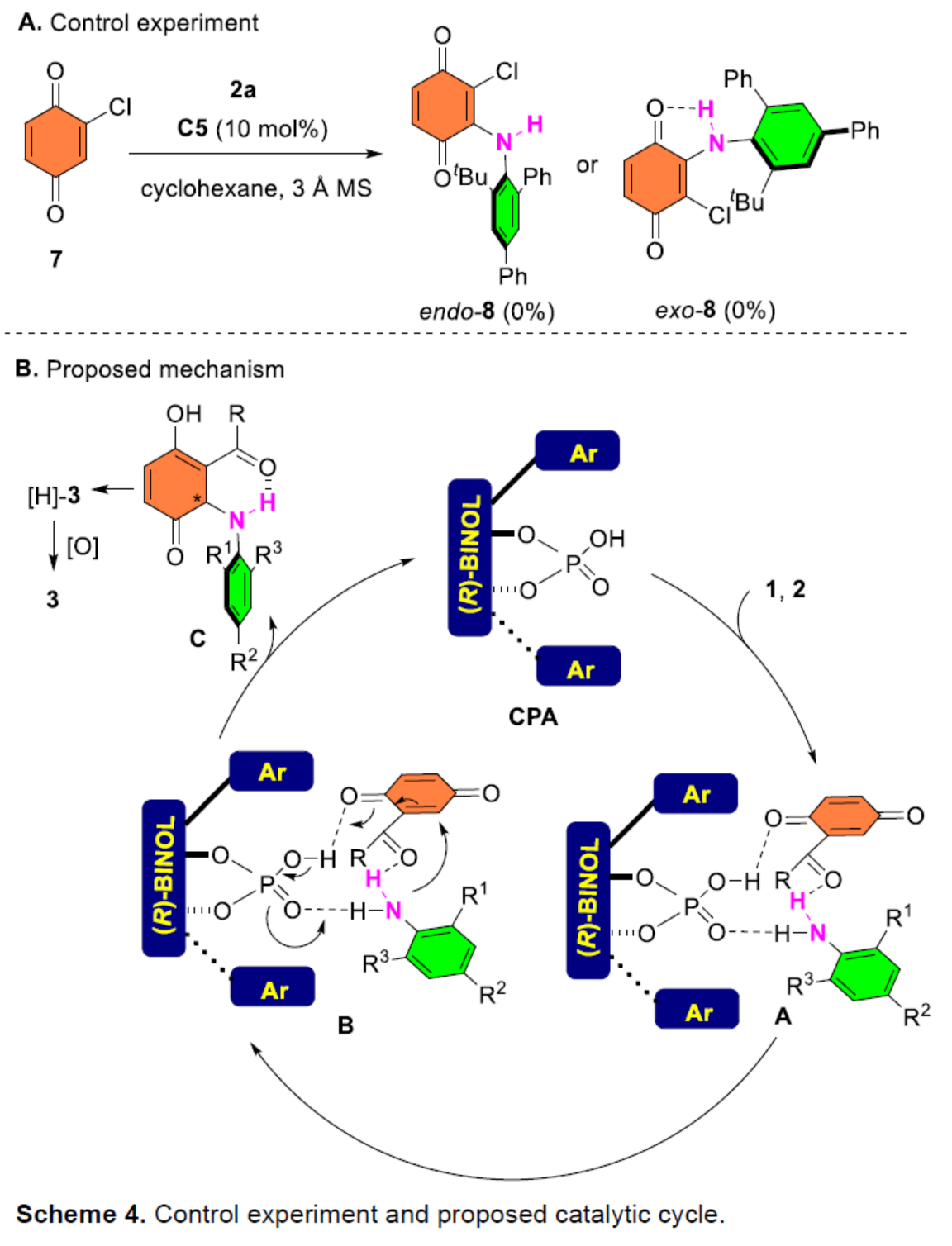
此外,作者還對反應(yīng)機(jī)理進(jìn)行了進(jìn)一步的研究(Scheme 4)。首先,控制實(shí)驗(yàn)表明,羰基在反應(yīng)過程中對六元?dú)滏I環(huán)的構(gòu)建起著重要作用,但也不能排除氯化物底物的親電性低于酯的可能性(Scheme 4A)。因此,作者提出了一種合理的催化循環(huán)過程(Scheme 4B)。首先,CPA通過多個(gè)氫鍵同時(shí)活化醌酯1和苯胺2,生成中間體A。該過程促進(jìn)了隨后的不對稱共軛加成,通過中間體B生成具有六元分子內(nèi)N-H-O氫鍵的中心手性中間體C。緊接著,中間體C異構(gòu)化,實(shí)現(xiàn)中心手性向軸手性的轉(zhuǎn)移,生成對苯二酚中間體[H]-3。最后,中間體[H]-3經(jīng)氧化后,從而獲得目標(biāo)的產(chǎn)物3。
(圖片來源:Angew. Chem. Int. Ed.)
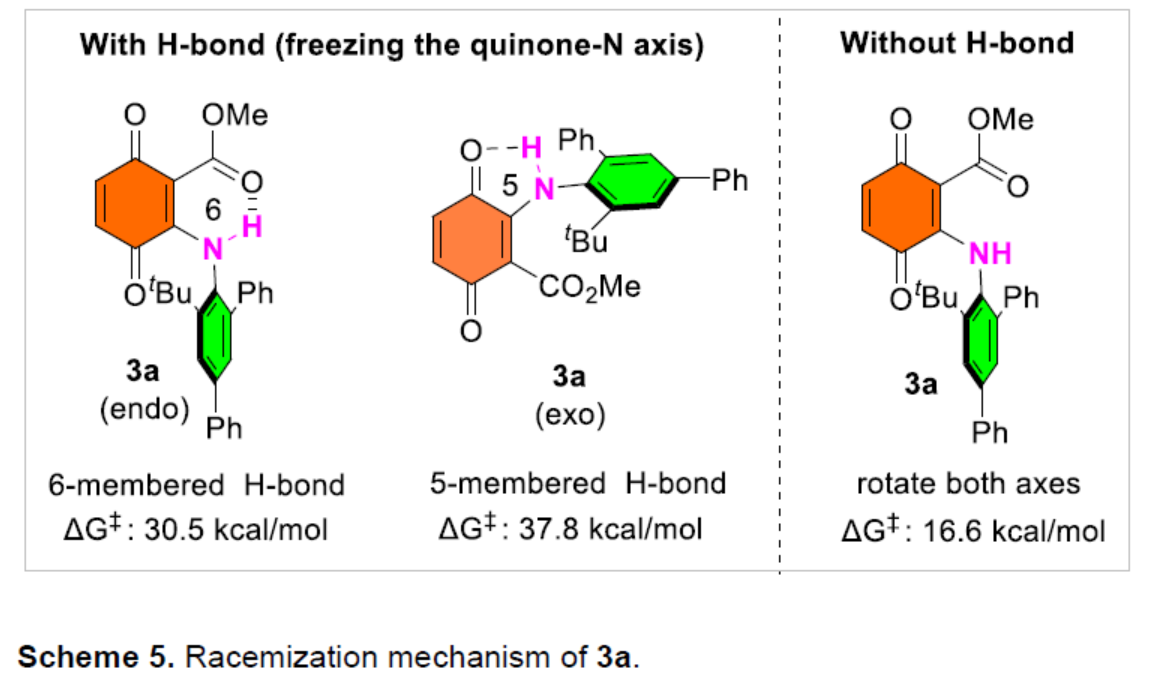
此外,作者還對3a的外消旋化機(jī)理進(jìn)行了研究(Scheme 5)。研究表明,外消旋化可能是通過二級胺與酯羰基形成六元環(huán)氫鍵的過程。在該種情況下計(jì)算所得旋轉(zhuǎn)能壘與實(shí)驗(yàn)較吻合,通過與酮羰基形成五元環(huán)氫鍵的能壘大幅高于實(shí)驗(yàn)值,而沒有氫鍵的旋轉(zhuǎn)能壘則大幅低于實(shí)驗(yàn)值。
(圖片來源:Angew. Chem. Int. Ed.)
總結(jié) 青島大學(xué)劉人榮課題組報(bào)道了一種通過手性磷酸催化串聯(lián)N-芳基化/氧化反應(yīng),合成了一系列N-芳基醌阻旋異構(gòu)體。同時(shí),該反應(yīng)具有反應(yīng)條件溫和、底物范圍廣泛、官能團(tuán)兼容性高、對映選擇性高等特點(diǎn)。此外,通過克級規(guī)模以及與不同親核試劑的反應(yīng),從而進(jìn)一步證明了反應(yīng)的實(shí)用性。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn