



(圖片來(lái)源:Nat. Commun.)
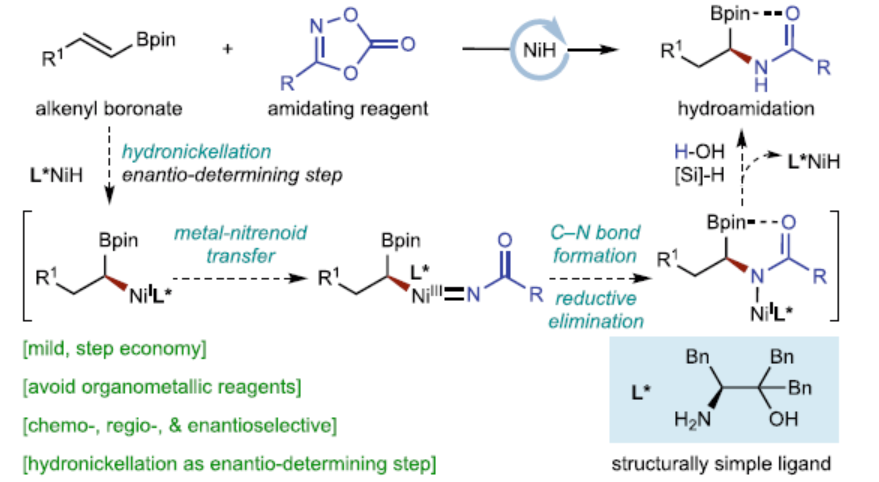
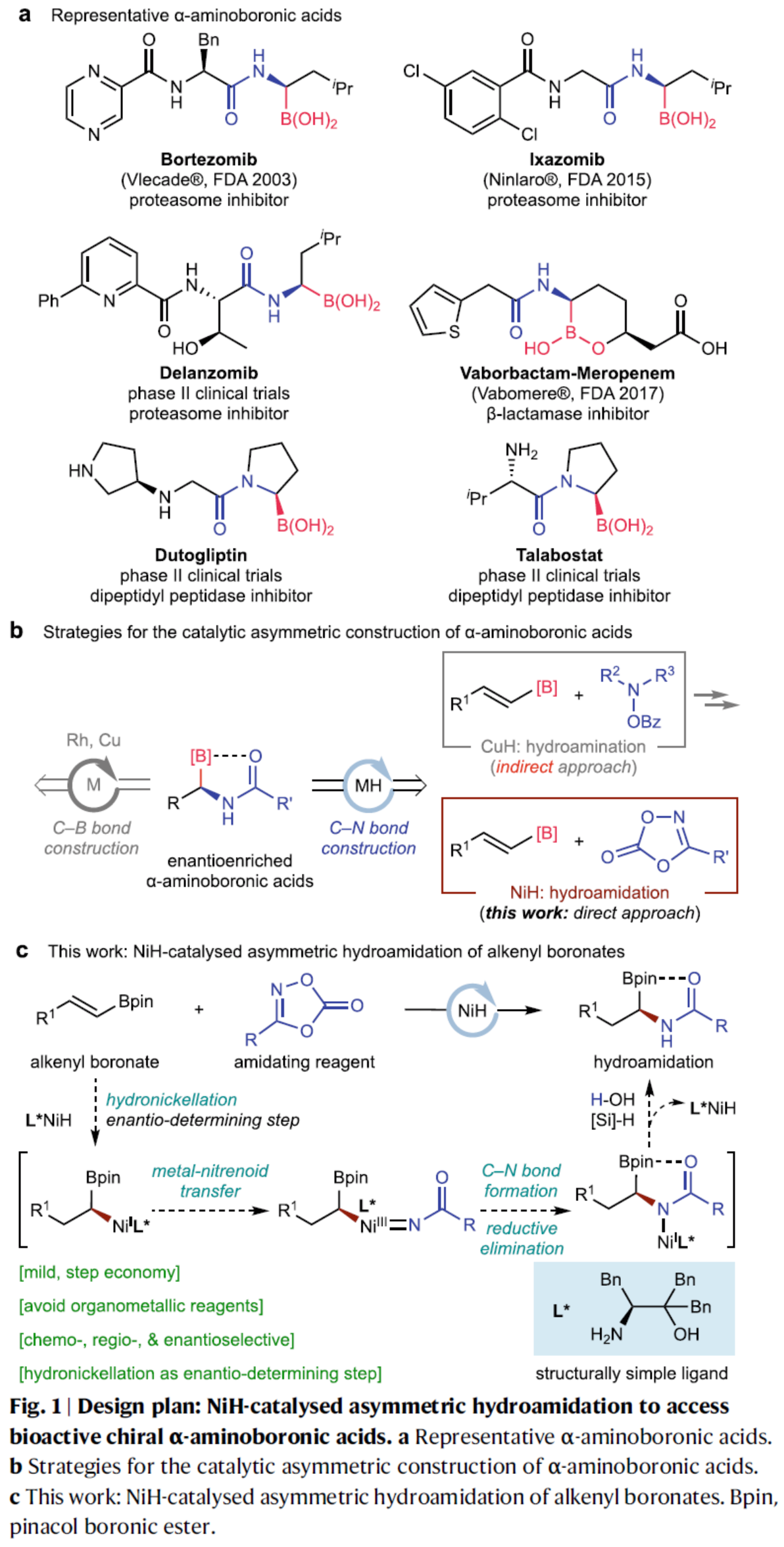
高光學(xué)純的手性α-氨基硼酸酯及其衍生物是一類重要的結(jié)構(gòu)單元,廣泛存在于材料和藥物分子結(jié)構(gòu)中(Fig. 1a),同時(shí)也是偶聯(lián)化學(xué)中常用的手性砌塊。因此,通過(guò)簡(jiǎn)單易得的起始原料,直接高效地合成含該結(jié)構(gòu)單元的分子,一直備受合成化學(xué)家的關(guān)注。除了傳統(tǒng)的手性輔基方法外,化學(xué)家們還開(kāi)發(fā)了一系列不對(duì)稱催化合成手性α-氨基硼酸酯的方法,如芳香醛亞胺的硼化、烯酰胺的硼氫化和氫化反應(yīng)(Fig. 1b)。2015年,Hirano和Miura課題組報(bào)道了一種CuH催化烯基Bdan(dan,1,8-二氨基萘)的氫胺化反應(yīng);2020年,Liu與Engle報(bào)道了一種CuH-催化炔烴的氫硼化/氫胺化的串聯(lián)反應(yīng),合成了一系列手性α-氨基硼酸酯。然而,此類反應(yīng)得到的烷基胺產(chǎn)物轉(zhuǎn)化為上述藥物分子的酰胺結(jié)構(gòu)過(guò)程較為繁瑣,一定程度上降低了該類反應(yīng)的實(shí)用性。因此,仍需開(kāi)發(fā)一種更為高效的手性α-酰胺基硼酸骨架的合成方法。
朱少林課題組利用鎳氫催化策略,使用手性NiH催化劑,烯烴作為親核試劑,開(kāi)發(fā)了烯烴的系列不對(duì)稱氫官能團(tuán)化反應(yīng)。在該策略中,可使用多種親電試劑作為偶聯(lián)底物,從而立體化學(xué)可控的構(gòu)建了各種碳–碳和碳–雜原子鍵。最近,化學(xué)家們還證明二噁唑酮是NiH催化還原氫酰胺化反應(yīng)中合適的親電酰胺化試劑。近日,南京大學(xué)朱少林團(tuán)隊(duì)報(bào)道了一種NiH催化烯基硼酸酯與二噁唑酮的不對(duì)稱氫酰胺化反應(yīng),直接合成了一系列高光學(xué)純的手性α-氨基硼酸酯(Fig. 1c)。
(圖片來(lái)源:Nat. Commun.)
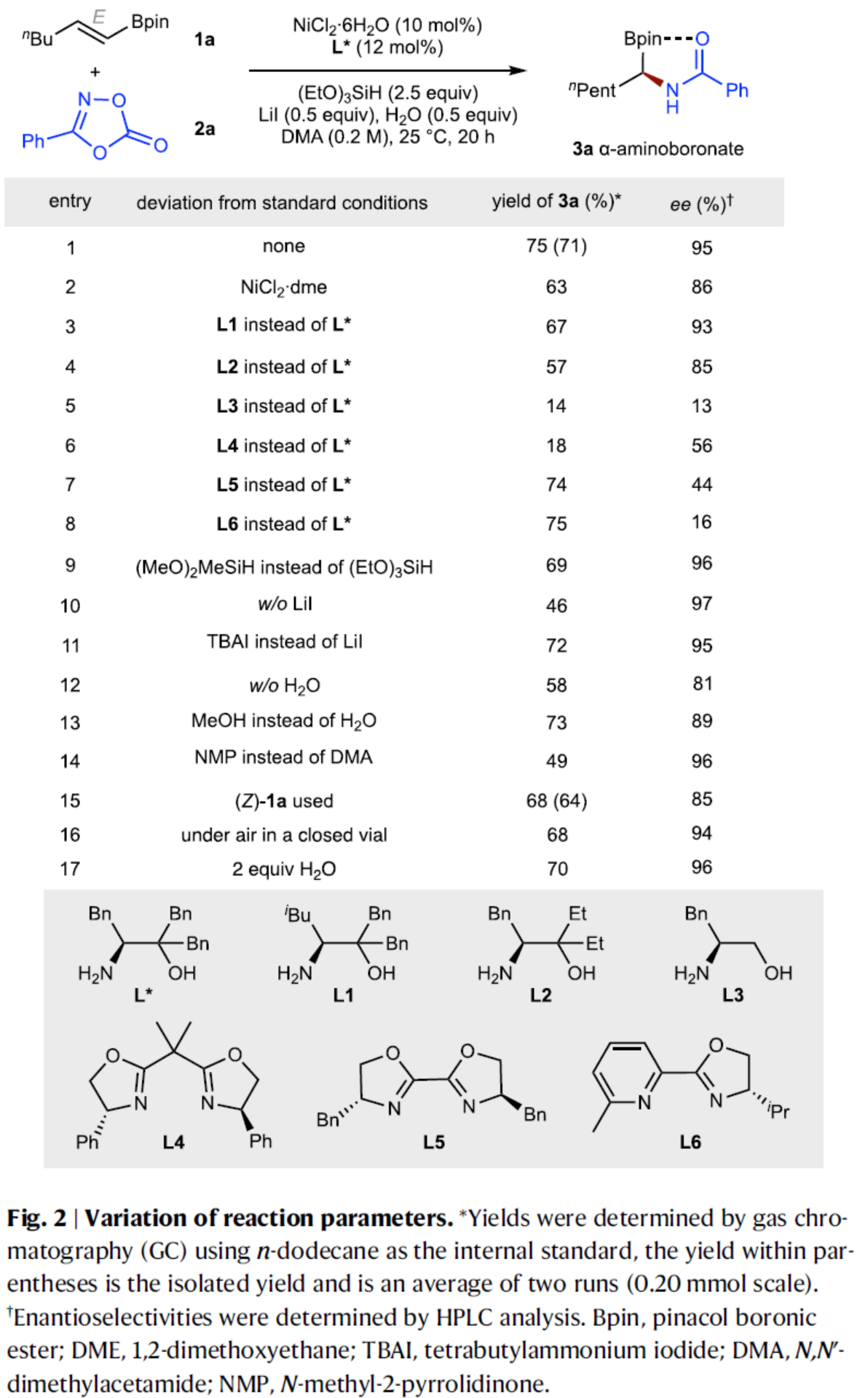
首先,作者以烯基硼酸酯1a與3-苯基-1,4,2-二噁唑-5-酮2a作為模型底物,進(jìn)行了相關(guān)不對(duì)稱氫酰胺化反應(yīng)條件的篩選(Fig. 2)。當(dāng)以NiCl2?6H2O作為催化劑,氨基醇L*作為手性配體,(EtO)3SiH作氫源,LiI與H2O作為添加劑,在DMA溶劑中25 oC反應(yīng)20 h,可以75%的收率得到產(chǎn)物3a,ee為95%。
(圖片來(lái)源:Nat. Commun.)
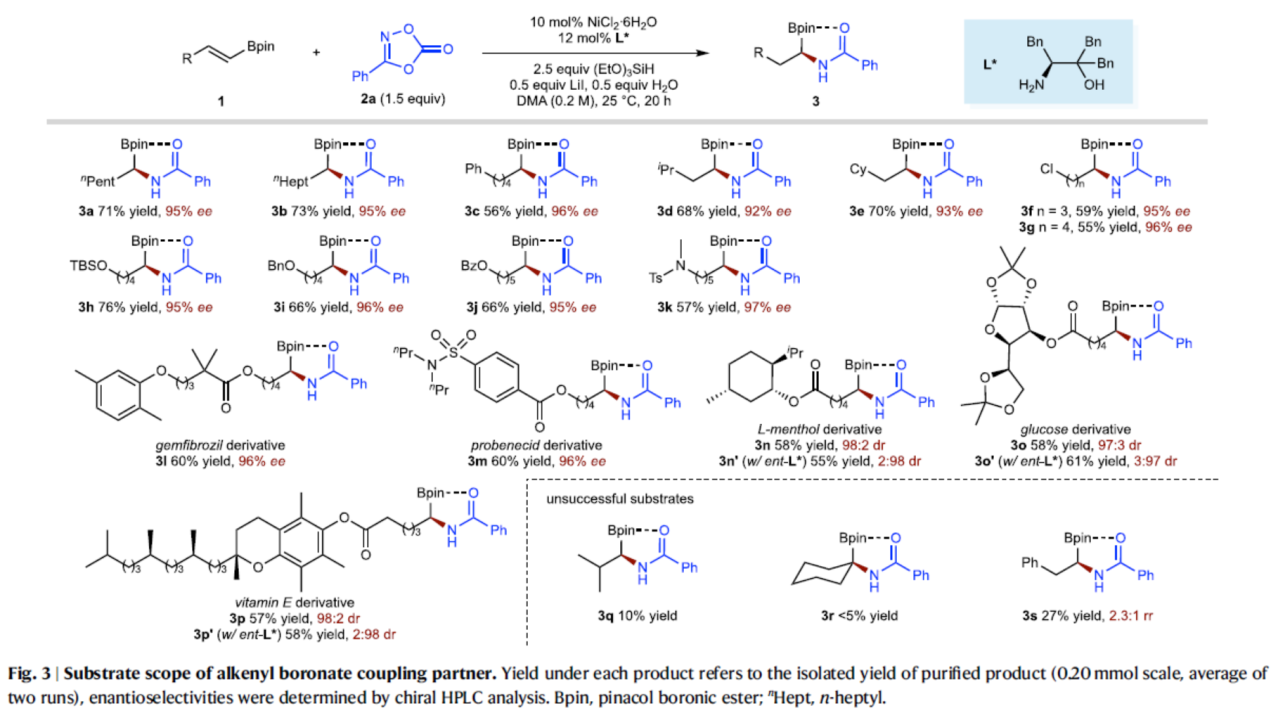
在獲得上述最佳反應(yīng)條件后,作者對(duì)烯基硼酸酯底物1的范圍進(jìn)行了擴(kuò)展(Fig. 3)。首先,一系列烷基取代的烯基硼酸酯,均可順利與2a進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物3a–3k,收率為55–76%,ee為92–97%。其次,該策略還可用于一些生物活性和藥物分子的后期修飾,如吉非貝齊(3l),丙磺舒(3m),薄荷醇(3n),葡萄糖(3o)和維生素E(3p)。然而,對(duì)于β,β-二取代的和α,β-二取代的烯基硼酸酯,反應(yīng)性極低,如3q和3r。當(dāng)使用β-芳基取代的烯基硼酸酯(3s)時(shí),在硼酸酯的α-位和芐位都發(fā)生了酰胺化,獲得2.3:1的混合物。
(圖片來(lái)源:Nat. Commun.)
緊接著,作者對(duì)二噁唑酮底物2的底物范圍進(jìn)行了擴(kuò)展(Fig. 4)。首先,當(dāng)?shù)孜?/span>2中的R為一系列不同電性取代的芳基以及雜芳基時(shí),均可順利與1a反應(yīng),獲得相應(yīng)的產(chǎn)物4a–4h,收率為60–74%,ee為84–98%。其次,當(dāng)?shù)孜?/span>2中的R為一系列一級(jí)、二級(jí)和三級(jí)烷基取代時(shí),均可順利與1a反應(yīng),獲得相應(yīng)的產(chǎn)物4i–4s,收率為47–63%,ee為83–98%。此外,該策略還可用于復(fù)雜分子的后期衍生化實(shí)驗(yàn),如伊索克酸(4t)、奧沙普秦(4u)和吲哚美辛(4v)。
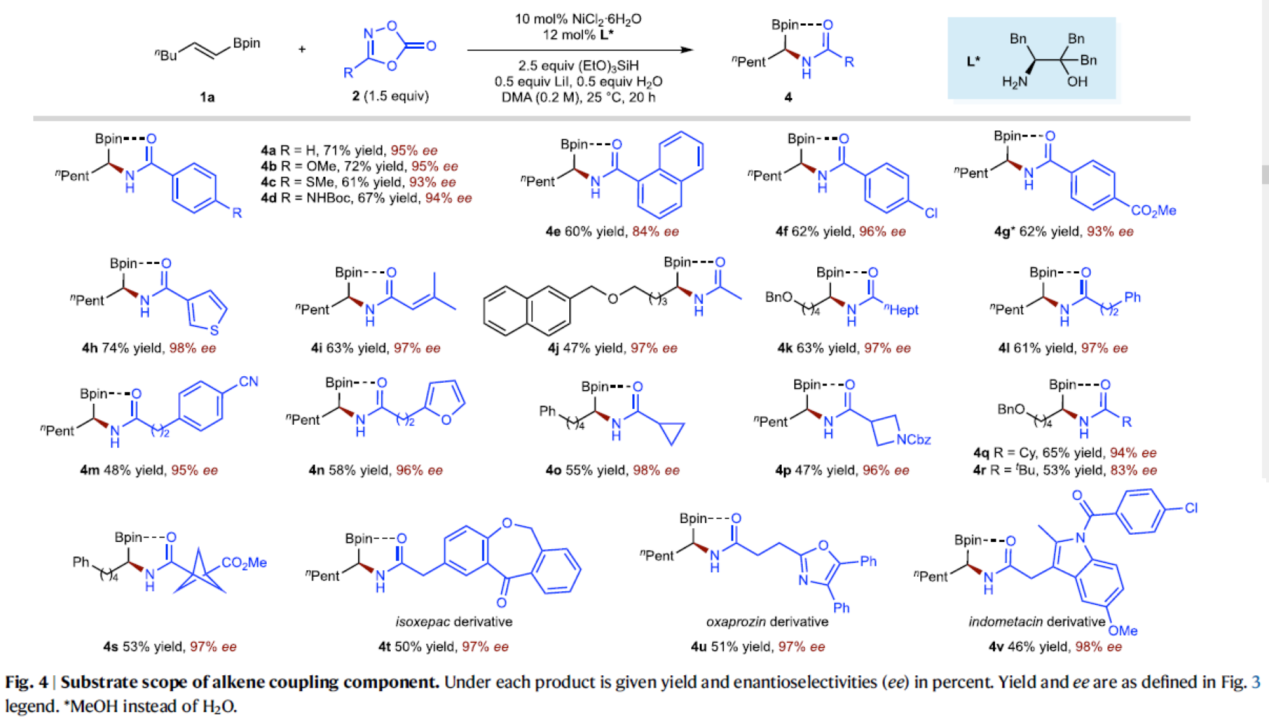
(圖片來(lái)源:Nat. Commun.)
隨后,作者還對(duì)反應(yīng)的實(shí)用性進(jìn)行了研究(Fig. 5)。首先,克級(jí)規(guī)模實(shí)驗(yàn)同樣能夠以74%收率和94%ee得到產(chǎn)物3a。其次,以炔烴為底物,通過(guò)一鍋法反應(yīng),可直接合成最終的氫化酰胺化產(chǎn)物3a,收率為61%,ee為94%,且無(wú)需分離氫硼化中間體1a。此外,以炔烴衍生物5為底物,經(jīng)三步反應(yīng)(Zr催化氫硼化反應(yīng)、NiH催化的不對(duì)稱氫酰胺化反應(yīng)以及HCl介導(dǎo)的脫保護(hù)過(guò)程),可合成β-內(nèi)酰胺酶抑制劑法硼巴坦(Vaborbactam)。
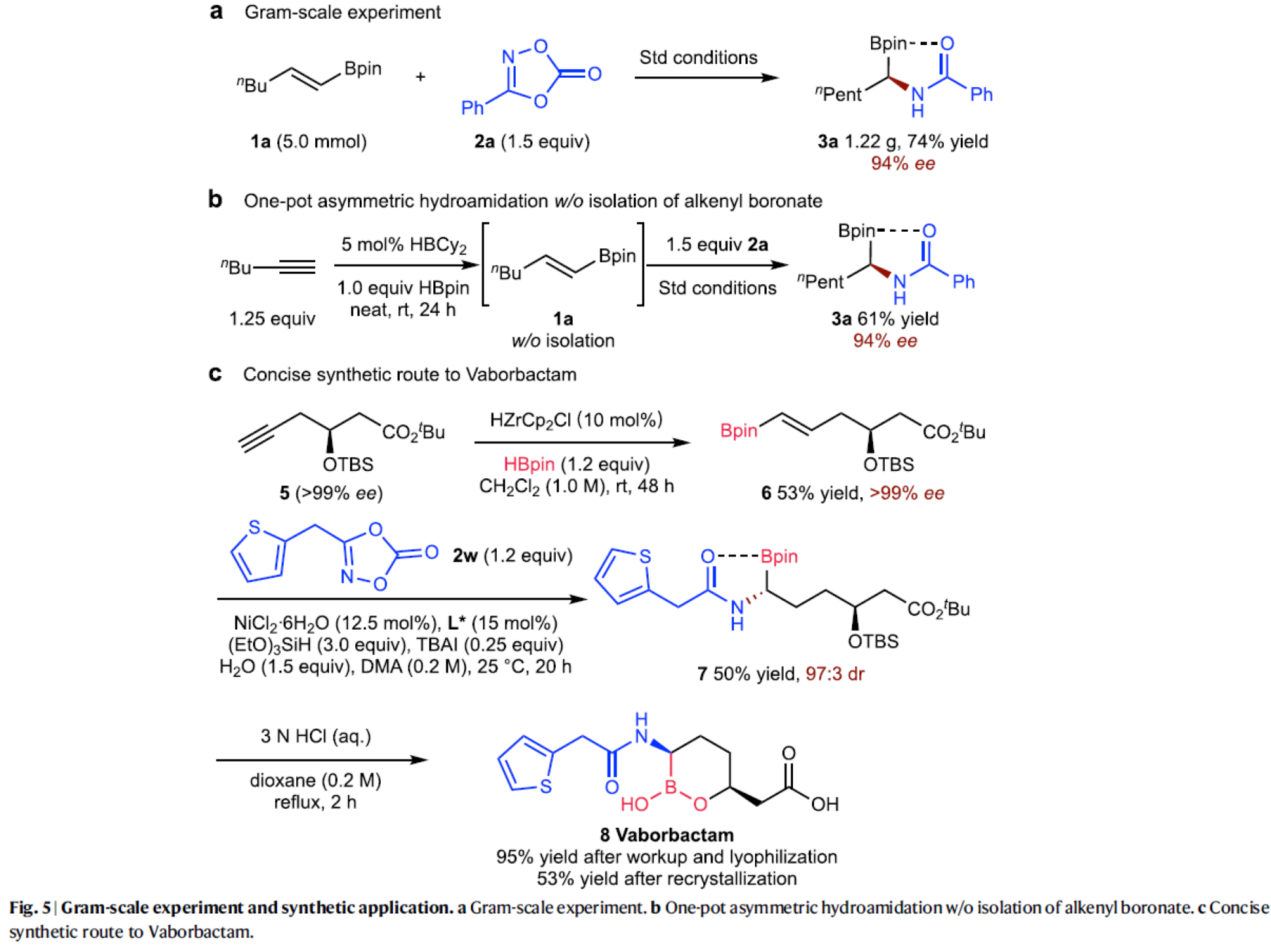
(圖片來(lái)源:Nat. Commun.)
最后,作者對(duì)反應(yīng)機(jī)理進(jìn)行了研究(Fig. 6)。首先,氨基醇配體L*與產(chǎn)物3a中的ee值之間存在一定的線性相關(guān)性,這一觀察結(jié)果和反應(yīng)過(guò)程中單個(gè)活性鎳催化劑形式上只配一個(gè)手性配體一致(Fig. 6a)。由于H2O和氫硅烷都可以作為氫源,因此作者使用D2O進(jìn)行同位素標(biāo)記實(shí)驗(yàn)(Fig. 6b,top)。在產(chǎn)物(3a)中未觀察到氘摻入,排除了水作為鎳氫物種氫源的可能性。同時(shí),使用1b-D進(jìn)行同位素標(biāo)記實(shí)驗(yàn),可獲得非對(duì)映異構(gòu)體純的3b-D,從而表明順式氫鎳化(syn-hydronickellation)是反應(yīng)的對(duì)映選擇性決定步驟。因此,烯基硼酸酯的E-或Z-構(gòu)型對(duì)于產(chǎn)物對(duì)映選擇性具有顯著的影響(cf. Fig. 2, entry 1 vs. entry 15)。為了進(jìn)一步了解隨后的酰胺化過(guò)程,作者將三苯基膦(PPh3)與二噁唑酮(2a)在標(biāo)準(zhǔn)條件下進(jìn)行反應(yīng),可以捕獲到氮賓中間體,不加鎳則幾乎不生成產(chǎn)物,從而表明鎳-氮賓配合物的形成可能是酰胺化過(guò)程的一種可能途徑(Fig. 6c)。

(圖片來(lái)源:Nat. Commun.)
總結(jié) 南京大學(xué)朱少林團(tuán)隊(duì)報(bào)道了一種NiH催化烯基硼酸酯與二噁唑酮的不對(duì)稱氫酰胺化反應(yīng),使用簡(jiǎn)單的手性氨基醇作配體,合成了一系列高光學(xué)純的手性α-氨基硼酸酯。該反應(yīng)條件溫和,底物范圍廣泛,作者通過(guò)對(duì)藥物分子法硼巴坦(Vaborbatam)的高效合成,進(jìn)一步證明了反應(yīng)的實(shí)用性。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn