

液相多肽合成(LPPS)還是固相多肽合成(SPPS)?這是多肽工業化學家在工藝開發前都會問到的問題。這兩種合成策略都有著各自天然的優勢與劣勢。液相多肽合成適合大體量的多肽藥物或者多肽化妝品的生產,在生產規模和生產成本上都有明顯的優勢,但它的工藝開發比較復雜,生產周期較長,需要結晶或者純化中間體,而這些問題卻都是固相合成的優勢所在。
所謂的多肽制備第三波,是建立在多肽合成兩大傳統策略的基礎之上而闡述的 (圖1):第一波: Classic solution peptide synthesis (傳統液相多肽合成,CSPS),意指諾貝爾化學獎得主,Bruce Merrifeld教授在上世紀60年代發明固相多肽合成之前,業界人士所采用的液相多肽合成策略。第二波:SPPS (固相多肽合成)。
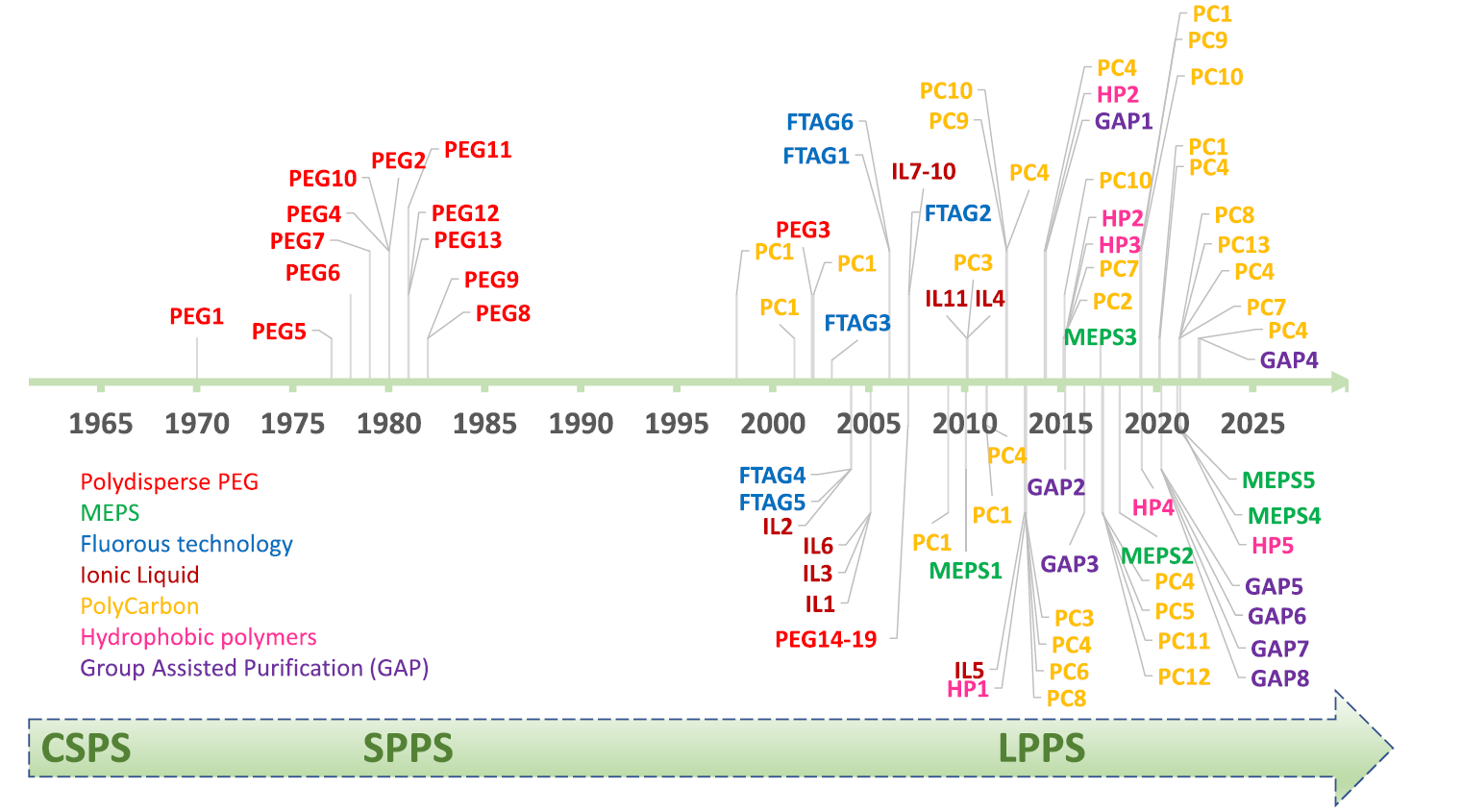
圖1. 上世紀以來多肽化學發展圖譜(圖片來源:Chem. Rev.)
盡管固相合成方法在目前的工業界大行其道,但其也存在不可逾越的自身缺點,比如需要使用過量的試劑與溶劑。從綠色化學的角度來看,液相合成被重新加以重視。不同于經典的液相多肽合成,如今的液相手段增加了可溶性C-端標簽(Tag)策略,類似于樹脂,將增長的多肽鏈固化其上。但因為標簽巨大的親脂性,形成的多肽-標簽加合物可以溶于有機溶劑,并且溶解性顯著異于試劑和副產物,可以通過簡單的沉淀、過濾或萃取得到這些多肽-標簽的加合物中間體,從而實現類似于固相合成的洗脫法去除過量試劑和副產品的目的。LPPS可以公斤或噸級規模生產,可以自動化,生產過程中的能量輸入低;勞動力少;能源和材料消耗成本低。
近年來,液相多肽合成的C-端標簽的發展實現了飛躍,通過全氟烷基、離子液體、聚碳、疏水聚合物和含磷標簽,從多分散聚乙二醇 (PEG) 到單分散 PEG。Albericio的這篇綜述涵蓋了以下范疇:(i) 基于 PEG 的肽合成; (ii) 膜技術支持的肽合成;(iii) 氟技術; (iv) 離子液體 (IL); (v)聚碳化合物; (vi) 疏水聚合物 (圖 2)。 每個部分涵蓋肽合成的最通用方案,包括肽的規模、產量和純度。
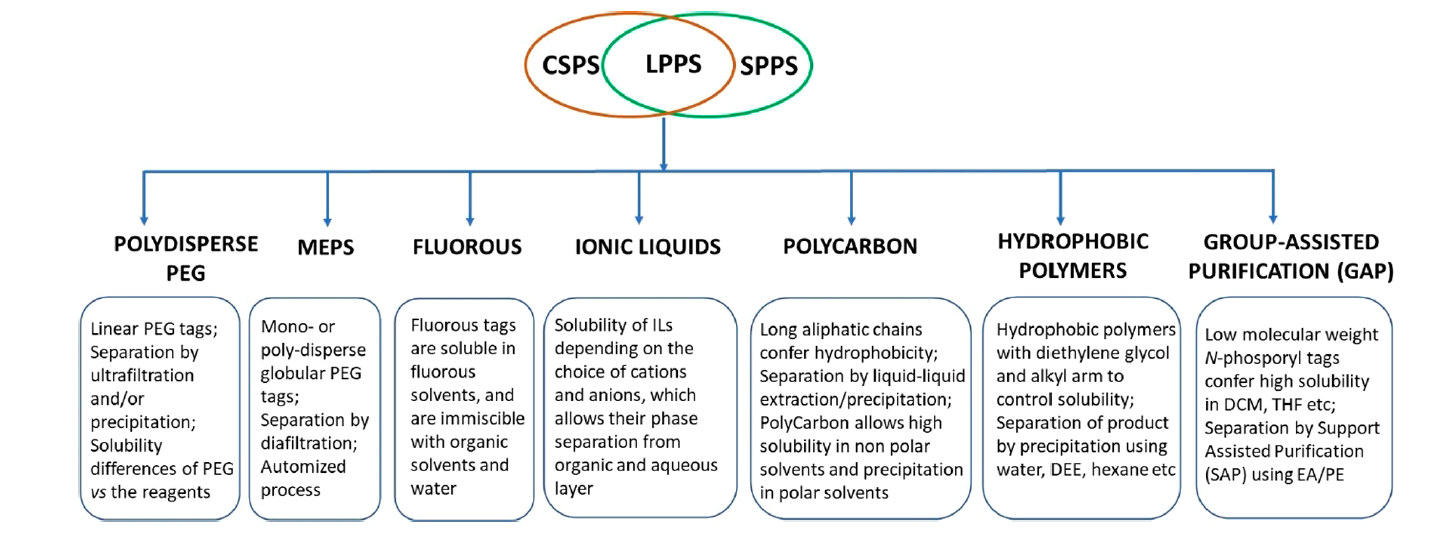 圖2. 液相多肽合成的各種策略(圖片來源:Chem. Rev.)
圖2. 液相多肽合成的各種策略(圖片來源:Chem. Rev.)
2. PEG標簽LPPS
在 PEG-LPPS 中,PEG 類型的標簽在二甲基甲酰胺(DMF)、二氯甲烷(DCM)、甲苯、乙腈 (ACN)和水中具有較高的溶解度,但難溶于叔丁基甲基醚(MTBE),乙醚(DEE)、己烷和異丙醇(IPA)。這種溶解度的差異可以為肽-PEG LPPS技術所利用,通過沉淀或過濾的方法純化中間體,并可以在肽增長過程中洗滌掉不需要的試劑和副產物。LPPS 的常用PEG標簽如圖 3 所示。
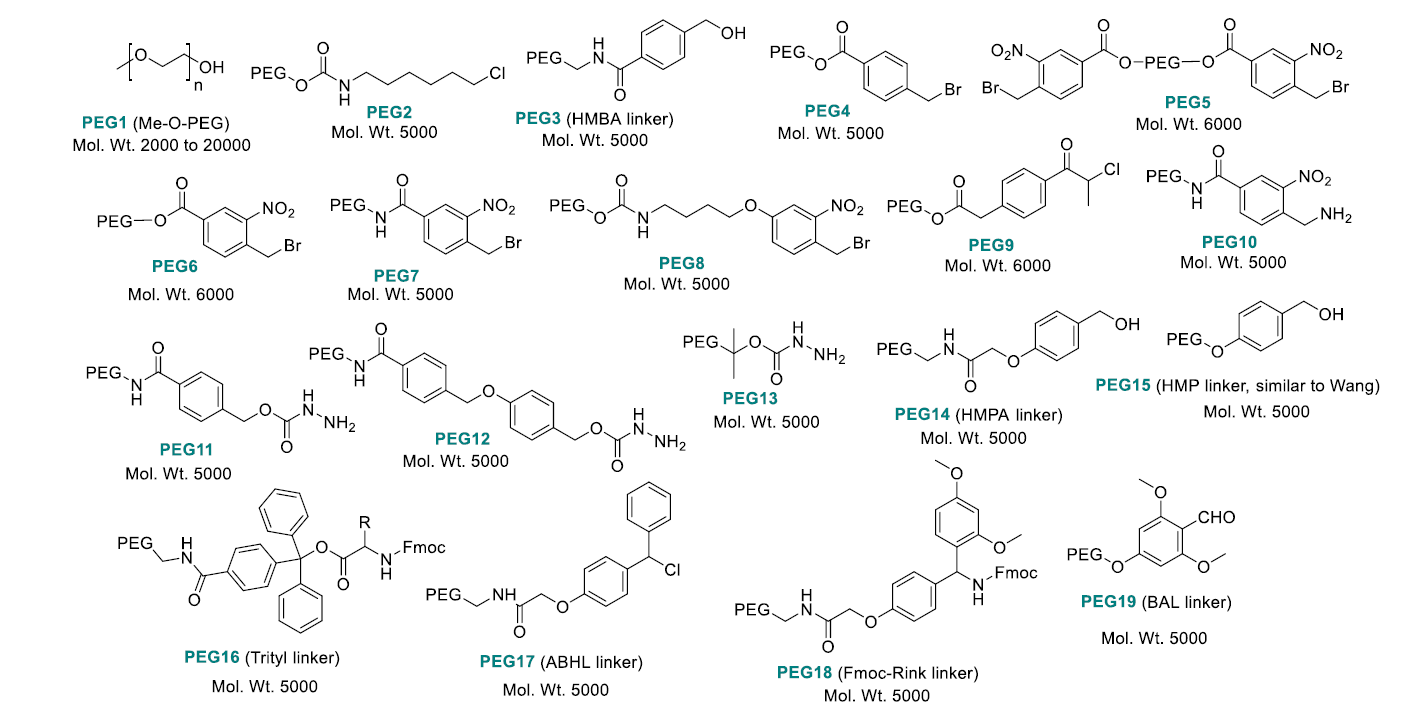
圖3. LPPS的常用PEG類型標簽結構(圖片來源:Chem. Rev.)
C-端肽羧酸的PEG 標簽包括,PEG14-PEG15 ,類似于 Wang 樹脂(使用高濃度TFA 切割),PEG16(trityl 手臂)和 PEG17(二苯甲基手臂),后兩者可以使用低濃度的TFA進行切割。 應用于C-端酰胺肽的標簽包括,PEG18(Rink amide手臂)和PEG19(BAL 手臂),用高濃度TFA切割。 這些PEG-LPPS標簽與以前在SPPS中使用的任何手臂都相吻合。
如同SPPS一樣,最先應用于PEG標簽LPPS技術的也是Boc/Bzl 化學。本世紀初,適用于Fmoc/tBu的相應技術逐漸流行開來,分子量5000的PEG標簽被使用在這一過程中。每一個氨基酸縮合步驟得到的多肽-標簽中間品通過乙醚沉淀的方式得到分離。標簽切割則通過TFA溶液得以實現。Fmoc 的去保護可以通過TBAF·H2O /1-辛硫醇(捕獲試劑)的 DMF 溶液實現,或者使用常規的20% piperidine/DMF溶液處理。中間品在乙醚中沉淀,并使用MTBE、異丙醇和乙醚進行淋洗。氨基酸縮合則由PyBOP或TPTU介導,在HOAt/DIPEA的存在下完成。在TFA切割和整體去保護后,PEG可在硅膠柱上通過固相萃取的方法上分離,使用DCM/DEE 或者 DCM/MeOH做為洗脫液,得到最終的多肽產物。PEG-標簽LPPS的技術特點歸納見表1。

表1. 多分散PEG-標簽LPPS路線的特征歸納
3. 膜技術LPPS(MEMBRANE-ENHANCED PEPTIDE SYNTHESIS,MEPS)
膜技術多肽合成MEPS本質上是PEG-標簽LPPS的一個衍生技術,反應中的試劑通過有機溶劑納米過濾(OSN)的方法實現與多肽中間產物的分離。有機溶劑納米過濾依靠壓力動力過濾的方式分離溶液中的分子(分子量200-2000 kDa)。過濾膜可以是聚合物 (Vicote PEEK, DuraMem 500, DuraMem 900),也可以是陶瓷材質 (Inopore 450 或 Inopore 750)。溶質截留和滲透通量兩個參數決定了膜的選取。膜功效由截留分子量(MWCO)表征,高于MWCO的溶質分子可以獲得超過90%的溶質截留。MEPS路線通常使用分子量2000-8000的PEG作為標簽,標簽可以是線性結構,也可以是球形結構。支鏈球形標簽可以獲得更高的溶質截留。通常來說,MEPS合成策略分為以下幾個步驟:1)酰胺聚合反應;2)使用定容滲濾(CVD)的方法洗滌反應液;3)Fmoc去保護;4)再次使用CVD洗滌反應液。圖4顯示了這四個步驟。目標多肽縮合完畢后,使用切割液進行切割和去保護。
MEPS的兩種方案在圖4中系統顯示。第一種方案執行兩次滲濾(一次在氨基酸縮合后,另一次在Fmoc去保護后,圖4(1))。第二種方案(PEPSTAR)僅在Fmoc去保護后進行滲濾操作(圖4(2))。圖5總結了MEPS方案中常用的PEG標簽的化學結構。
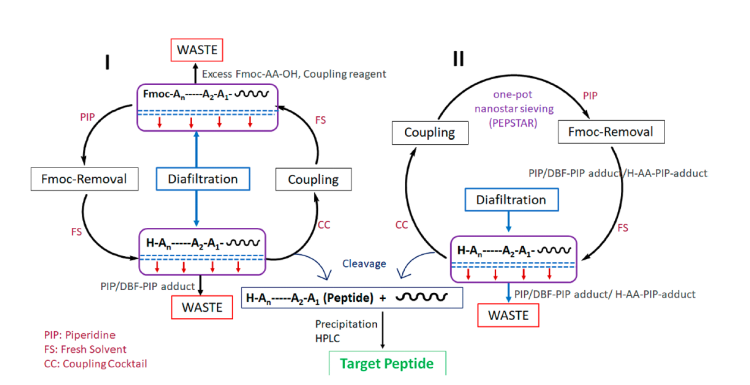
圖4. MEPS多肽合成路線圖(I)雙滲濾方案;(2)單滲濾方案(PEPSTAR)(圖片來源:Chem. Rev.)
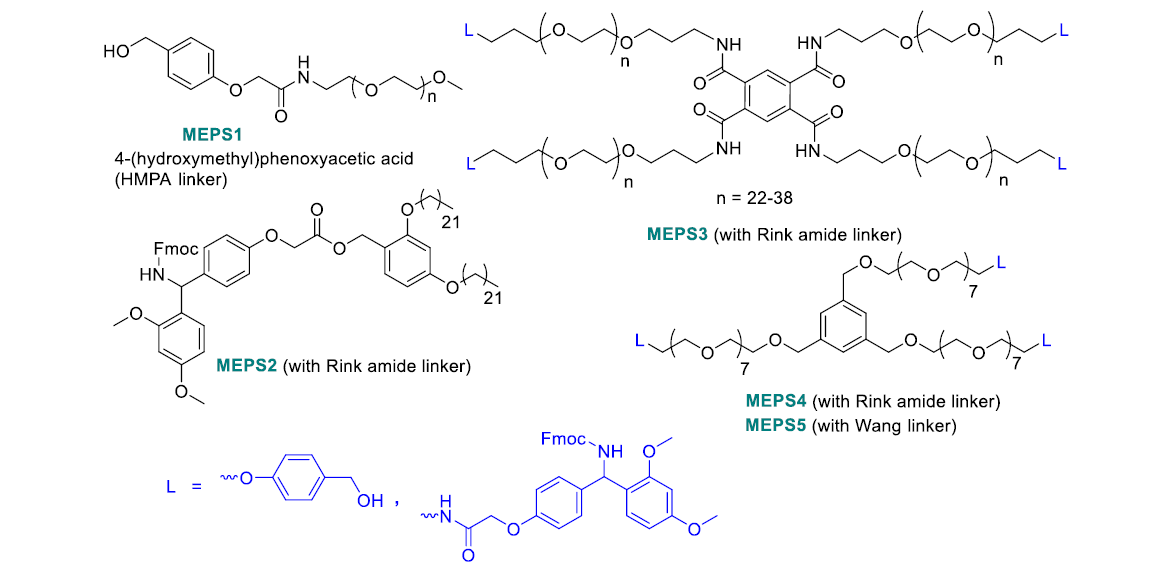
圖5. MEPS常用可溶性標簽(圖片來源:Chem. Rev.)
在一項五肽H-Tyr-Ala-Tyr-Ala-Tyr-OH 和 H-Arg-Lys-Asp-Val-Tyr-OH 的MEPS合成中,MEPS1(4-(羥甲基)苯氧乙酸)被使用做標簽。第一個氨基酸與標簽的縮合酯化反應通過DIC/HOBt在DMF中完成(15分鐘預活化,2小時縮合)。過量的試劑通過10體積的CVD被排除出反應體系。20% piperidine/DMF 30分鐘去Fmoc保護基,接下來是12體積的CVD。氨基酸縮合由PyBOP控制并在1小時內完成,緊接著進行滲濾步驟。如此的縮合→CVD→Fmoc去保護→CVD的循環進行多輪反復,直到目標多肽合成完畢。多肽-MEPS1復合物首先在乙醚中沉淀分離,然后使用TFA/苯酚/水(10:0.7:1)進行3小時的切割和去保護。多肽產物再次在乙醚中沉淀分離,并用液相色譜純化。兩個5肽的總體產率均為94%。而在PEPSTAR策略中,執行的是氨基酸縮合 →Fmoc去保護 → CVD的循環。
4. 氟標簽LPPS
全氟烷基標簽可以同時具有親氟性,親脂性,和疏水性的特征。這些屬性使得氟標簽易于從水相或有機相中得到分離,并應用于LPPS。一旦反應進行,這些氟標簽(輕含氟物或重含氟物)可以比較容易地通過氟固相萃取(F-SPE)或含氟液-液萃取(FLLE)的方式與其他非氟化合物分離。這種分離的概念展現于圖6。常用的氟標簽總結在圖7中。
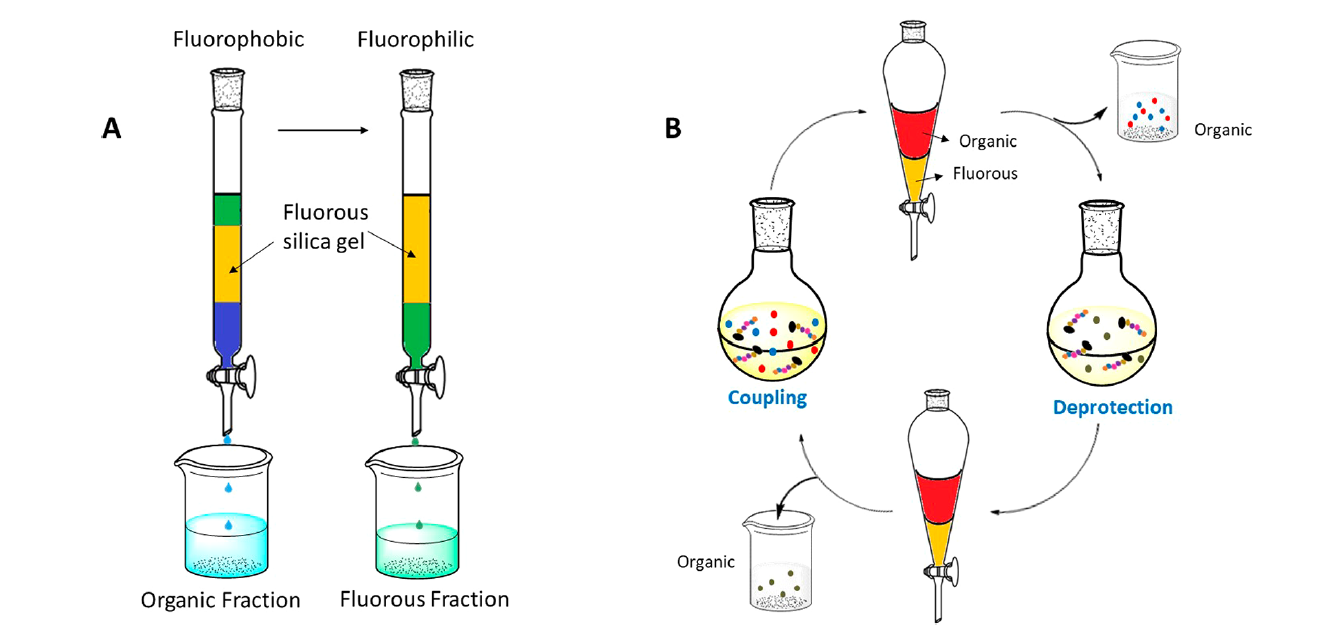
圖6. 通過A) 輕含氟物的氟固相萃取(F-SPE)和B)重含氟物的含氟液-液萃取(FLLE)的方式實現純化效果的概念圖(圖片來源:Chem. Rev.)
FTAG3 被用作促甲狀腺素釋放激素(pGlu-His-Pro-NH2)的LPPS的氟標簽。5% piperidine/FC72-DMF (FC72是全氟己烷,與有機溶劑和水都不互溶)完成Fmoc去保護。反應溶液用檸檬酸水溶液和NaHCO3水溶液洗滌。氨基酸縮合反應使用PyBOP作為縮合試劑,并使用C4F9OEt/DMF作為溶劑。反應結束后,反應體系用MeOH萃取。中間體多肽-標簽在FC72相中,并進入下一輪的Fmoc去保護和氨基酸縮合循環。縮合好的多肽被TFA/H2O/1,4-丁二硫醇切割去保護。反應體系分為FC72, 水,和甲苯三相,多肽進入水相,經過液相色譜純化后得到最終產品, 產率為62%。氟標簽進入FC72相,有機試劑則進入甲苯相。
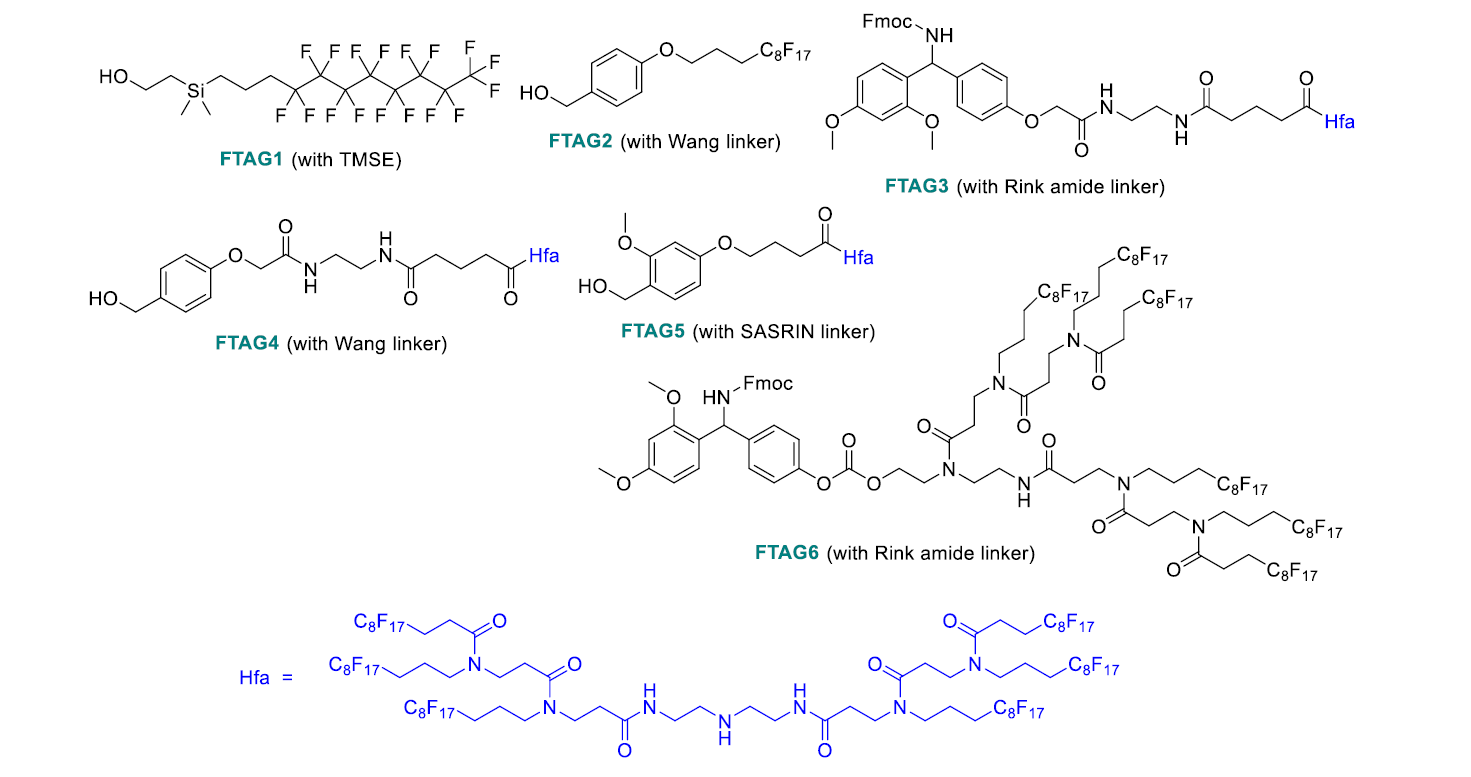
圖7. 常用的氟標簽化學結構(圖片來源:Chem. Rev.)
5. 離子液體標簽LPPS
離子液體也可以作為標簽在液相多肽合成中使用,該綜述列舉了圖8中的幾種常見的離子液體LPPS標簽。
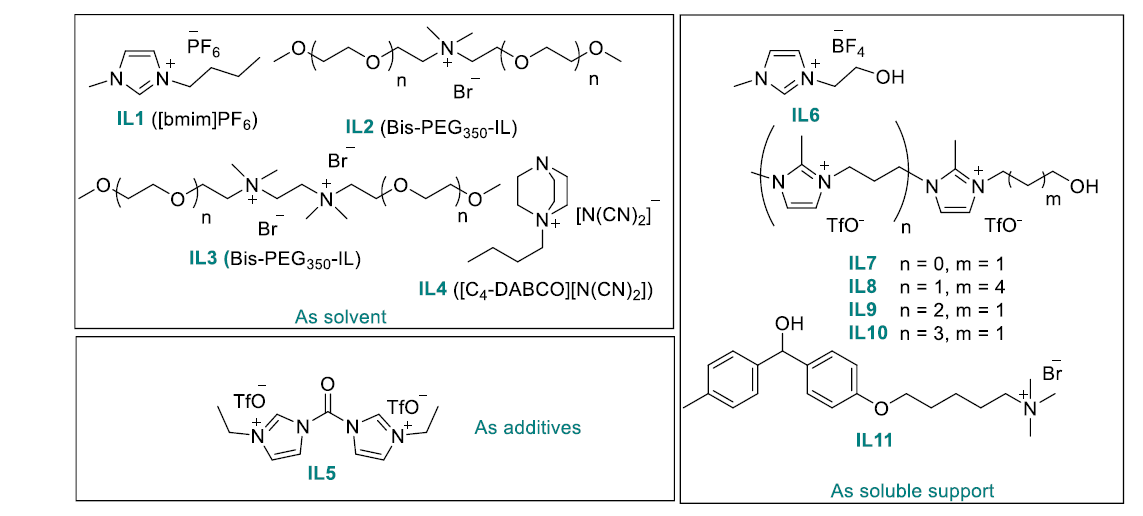
圖8. 常見的離子液體LPPS標簽(圖片來源:Chem. Rev.)
6. 碳基標簽LPPS
長脂肪鏈的存在可以顯著增加多肽-標簽的疏水性,而這種高疏水性可以不受多肽鏈增長影響,因此,以長脂肪鏈為基質的標簽也在LPPS中得到了應用。這些碳基標簽可以在諸如乙腈或甲醇的極性溶劑中沉淀,因此為中間品在氨基酸縮合和Fmoc 去保護的分離提取提供了基礎,這種過程被成為沉淀/萃取過程(precipitation/extraction)。常用的碳基LPPS標簽如圖9所示。圖10顯示了碳基標簽LPPS的流程示意。

圖9. 常用碳基LPPS標簽化學結構(圖片來源:Chem. Rev.)
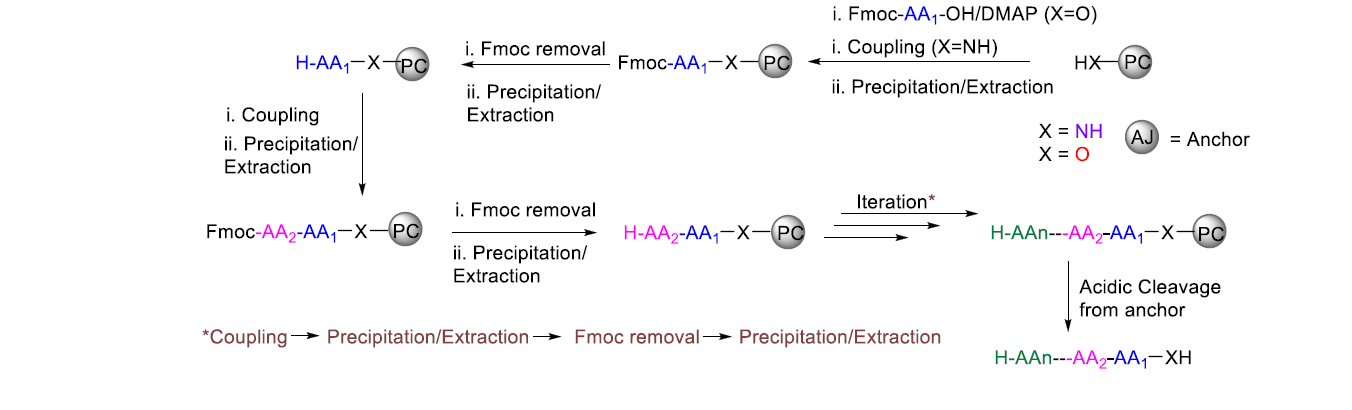
圖10. 碳基標簽法介導的LPPS示意圖。(圖片來源:Chem. Rev.)
以PC1為例,苯環上的給電子基團可以增加多肽與標簽之間的酸敏感性(穩定酯鍵酸解后芐基陽離子),而拉電子基團則增加其穩定性。第一個氨基酸縮合到標簽的酯化反應由EDC-HOBt-三乙胺(2當量)的DCM溶液實現。反應液在經過鹽水萃取后,有機相由MgSO4干燥并在甲醇中沉淀分離。得到的產物溶解于DCM,并加入piperidine脫Fmoc。反應結束后加入甲醇,沉淀H-AA-O-PC1產物。接下來Fmoc-Xaa-OH/EDC/HOBt (1:1.1:1, 2 當量) 的DCM溶液進行氨基酸縮合反應。反應結束后,反應液先經鹽水萃取,有機相干燥并在甲醇中沉淀。這樣的脫Fmoc/氨基酸縮合的循環一直進行到多肽的縮合完畢。切割和去保護由4 N HCl/乙醇溶液過夜反應完成。溶劑被真空蒸干,殘留物經正己烷沉淀后得到目標產物Fmoc-Leu-Phe-Ala-OH。圖11展示了碳基標簽法LPPS的中間品分離過程。除了DCM之外,THF或者THF/DMF (9:1)也可以作為氨基酸縮合或脫Fmoc的溶劑,而乙腈也常被用作沉淀中間品的反溶劑。對于在合成過程中容易產生分子間聚合,從而引發反應溶液粘稠并降低縮合效率的情況,也可使用環己烷/THF的混合液作為溶劑。在這種情況下,氨基酸縮合和脫Fmoc將在雙相條件下進行。遇到中間品形成凝膠而難以沉淀的情況,可以在反應體系中加入矽藻土(diatomite)協助產物沉淀,沉淀物經洗滌后加入非極性溶劑萃取多肽-標簽產物,并分離矽藻土。這種策略被研究者命名為“捕獲-釋放”手段(capture and release)。
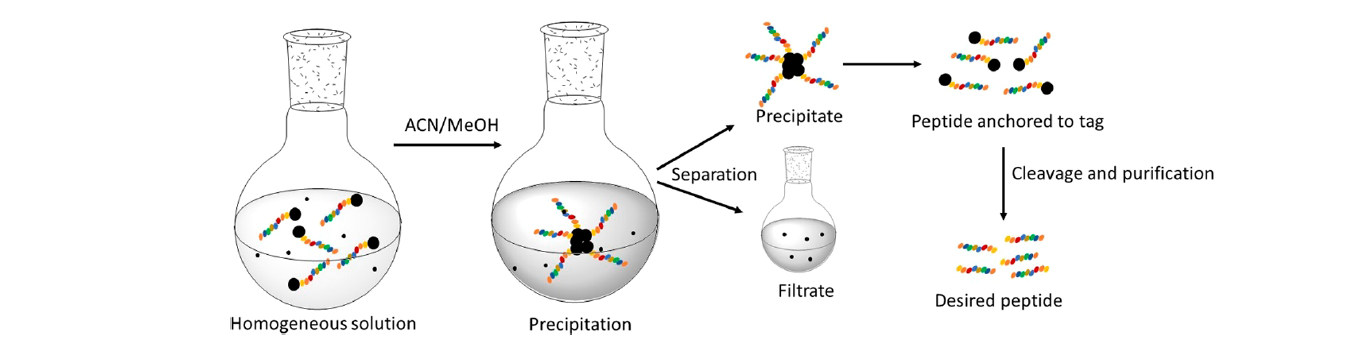
圖11.碳基標簽法LPPS中間品分離示意圖。(圖片來源:Chem. Rev.)
PC4作為標簽通過Fmoc/tBu化學合成了兩個長肽bivalirudin (H-D-Phe-Pro-Arg-Pro-Gly-Gly-Gly-Gly-Asn-Gly-Asp-Phe-Glu-Glu-Ile-Pro-Glu-Glu-Tyr-Leu-OH) 和 h-ghrelin [H-Gly-Ser-Ser(n-octanoyl)-Phe-Leu-Ser-Pro-Glu-His-Gln-Arg-Val-Gln-Gln-Arg-Lys-Glu-Ser-Lys-Lys-Pro-Pro-Ala-Lys-Leu-Gln-Pro-Arg-OH] (bivalirudin和h-ghrelin分別使用了3和4個片段進行最終的液相片段縮合)。HATU/HOAt/THF在這個合成中引導了氨基酸縮合反應, 1% DBU/1% PIP/THF負責脫Fmoc反應。最終分別以64% 和68%的產率得到了bivalirudin 和 h-ghrelin。
Ajinomoto 公司開發的PC11-PC12標簽,通過脂肪鏈的側鏈分支,大大增加了標簽的疏水性,使得LPPS過程中,中間品的分離擺脫了傳統的沉淀手段,而采用兩相萃取的方式,含有中間品多肽-標簽的相直接進入下一步的反應步驟,從而避免了沉淀,洗滌,重新溶解的步驟,不僅縮短了生產時間,而且顯著地降低了溶劑的用量。
Degarelix (10肽,C-端酰胺)和bivarulirudin(20肽,C-端羧酸)分別使用PC11和PC12標簽, 通過LPPS手段實現了成功合成。標簽-氨基酸偶聯反應:PC11: Fmoc?AA-OH?EDC-HOBt (1.1:1.2:1); PC12: Fmoc?AA-OH?EDC-DMAP (1.3:1.4:0.06),室溫下過夜反應,反應溶劑為氯仿。反應液經過20% NaCl萃取。有機相加入硫代蘋果酸(作為dibenzofulvene的捕獲劑)/DBU (3:8),室溫下2小時脫Fmoc。反應液加入甲磺酸后經NaHCO3水溶液 和 DMF萃取以去除脫Fmoc過程中產生的dibenzofulvene加合物。有機相繼續用于下一部分反應而無需濃縮,干燥或者沉淀。氨基酸縮合反應由Fmoc?AA-OH/EDC/HOBt (1.2:1.2:x) (PC11 x=1, PC12 x=0.3)室溫下過夜完成。脫Fmoc和氨基酸縮合就按照以上的循環進行,直至目標多肽合成完畢。之后將反應液濃縮,并在乙腈中沉淀目標多肽-標簽加合物。切割和去保護反應通過TFA?TIS?H2O (95:2.5:2.5)在室溫下2小時完成。Degarelix和bivalirudin分別獲得89%/84%的粗品純度和85%/79%的產率。硅烷基化的標簽PC13在LPPS中可以實現更低的粘度和更好的疏水效果,可以被用作合成含義有N-甲基氨基酸的復雜多肽的液相合成。
7. 疏水性聚合物
PEG標簽通常受困于較低的負載率,而且多肽-PEG加合物在中間品分離過程中時常會與反應試劑產生共沉淀,而無法實現更好的分離副產品的效果。與此同時,PEG標簽的溶解度也不令人滿意。這種現實催生了聚降冰片烯類標簽的誕生。這類標簽具有更高的負載率和溶解度,相較PEG更適合LPPS的應用。其結果示意圖參見圖12。常見的聚合物類LPPS標簽如圖13所示。
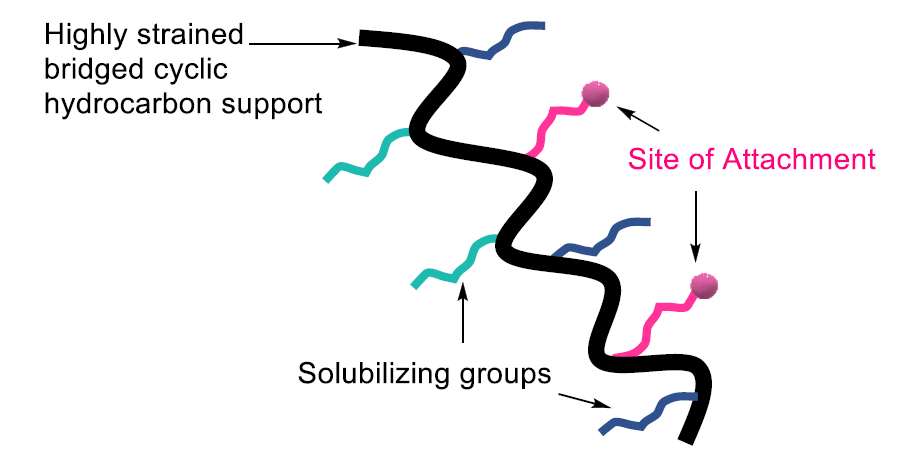
圖12. 聚降冰片烯類標簽結構參考圖。(圖片來源:Chem. Rev.)
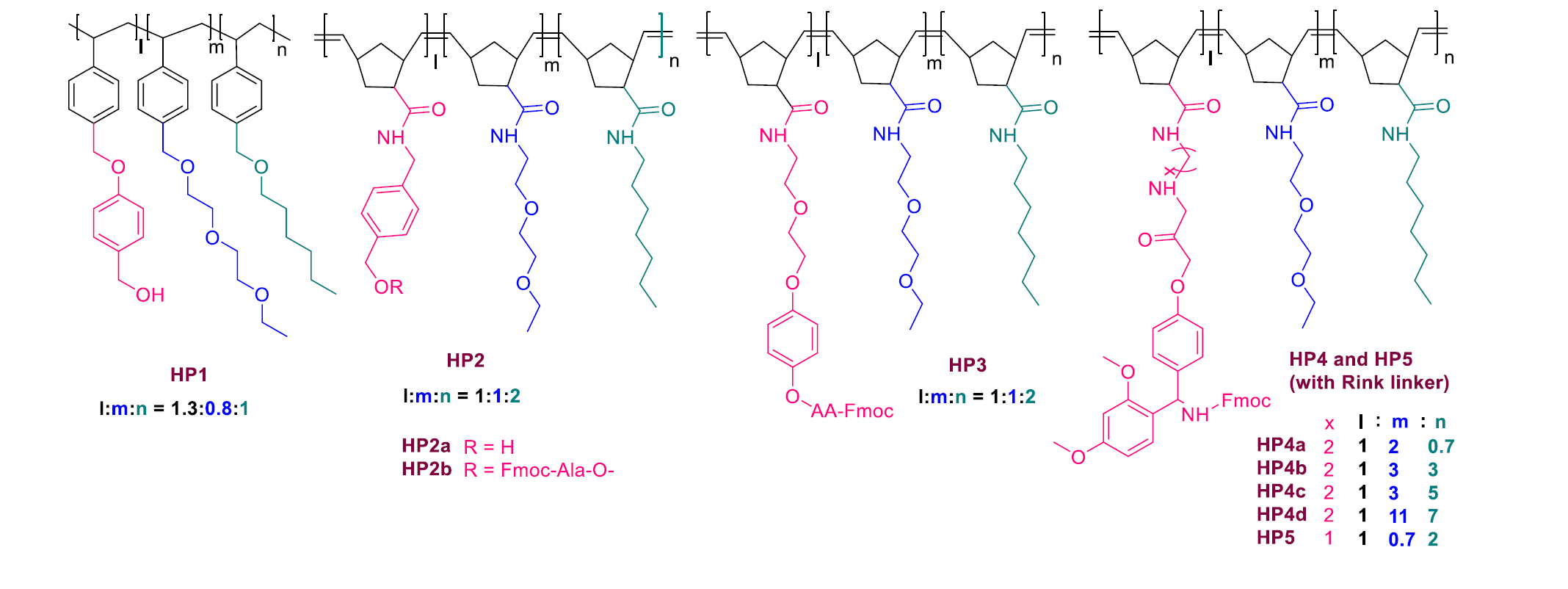
圖13. 常見的聚合物類LPPS標簽(圖片來源:Chem. Rev.)
結論與展望
截至目前,上市的多肽類藥物已經超過100種,有將近170種多肽類藥物在不同的臨床階段,并由400-600種處于前臨床期。LPPS所展現的綠色化學的潛質,相比于固相合成來說更有可能成為未來大規模多肽藥物合成的有效手段。SPPS的PMI (process mass intensity)大約80-90%來源于溶劑的使用,剩余部分則由過量的試劑和樹脂產生。而LPPS在這些領域都具有明顯的優勢,可以顯著地降低由溶劑,過量試劑和樹脂所產生的PMI。
PEG標簽可以通過有效的超濾或者沉淀引導LPPS的進行,但超濾過程所需的過量溶劑是它無法克服的障礙,所以PEG標簽法并未在工業界中實現應用。膜技術LPPS(MEPS)解決了PEG的這個固有問題,可以實現連續性的生產工藝。PEPSTAR技術的PMI目前與SPPS相當,但有望通過優化進一步降低。
氟標簽的有效性取決于標簽的含氟量,以及與有機溶劑和水都不互溶的全氟溶劑FC72的使用。雖然在分子量較小的多肽上取得成功,但對于大肽來說,氟標簽上的氟載量必須增加,以實現較好的中間品分離,但這對于目前的氟標簽來說難度較大。除此之外,此工藝涉及的氟化試劑和溶劑成本都較高,對大規模工業生產應用是個致命的影響因素。
離子液體標簽法可以通過使用綠色溶劑的手段體現其優勢,但它們尚未在工業界中取得廣泛應用。
碳基標簽可以增加氨基酸的縮合效率以及速率。此項方法目前的最大問題在于需要使用有害溶劑DCM, 氯仿等。Ajiphase工藝實現了通過萃取的手段去除過量試劑,副產品,而無需沉淀中間產物,這樣可以大大縮短生產時間并降低溶劑用量。
聚合物標簽LPPS是近期涌現出的新選擇,它們可以通過自身結構的改性實現更高的負載率和溶解效果。但在工業界尚未涌現出此技術的應用報告。
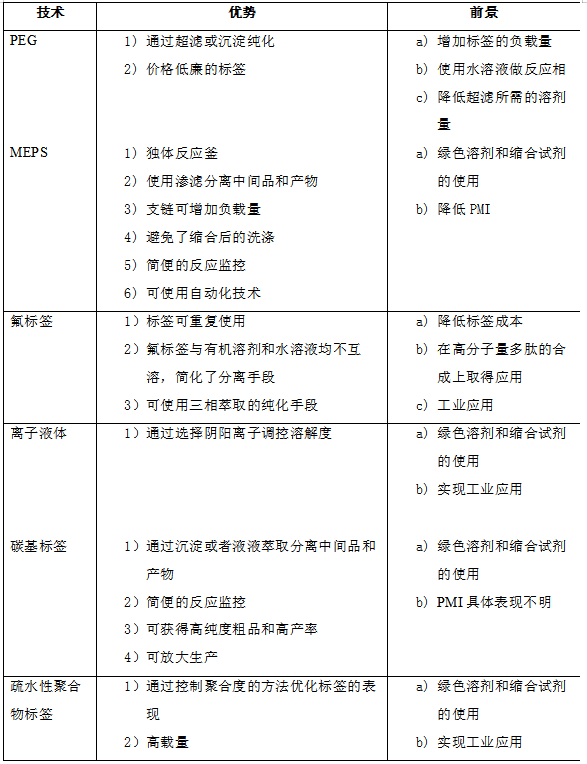
總結
各種LPPS標簽技術的優勢及前景展望
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn