

肺部相關疾病,包括病毒感染、腫瘤和遺傳性疾病等,對人類生命健康構成了巨大的威脅,然而傳統療法通常因為缺乏可成藥的治療靶點等限制性因素無法治愈這些疾病。隨著各類關鍵性技術的發展,mRNA藥物不僅能直接從轉錄水平上實現對疾病的治療,而且僅需修改mRNA序列即可快速開發新藥,為肺部疾病的治愈提供了全新的思路。
脂質納米顆粒(LNP)是迄今為止最成功的核酸藥物遞送平臺之一,它不僅可以促進細胞對mRNA的攝取,同時還能防止其在生物體循環時降解。然而,當前LNP-mRNA藥物制劑的低穩定性影響了相關藥物的發展,如Moderna和BioNTech的mRNA疫苗在4°C僅可儲存1和2.5個月,影響了其產品的推廣和使用,也增加了冷鏈運輸和儲存環節的經濟成本。因此,開發一個穩定性優異的肺特異性mRNA遞送平臺意義重大。
針對以上需求,李劍峰課題組的研究致力于消除LNP-mRNA藥物制劑的諸多不穩定性因素。首先采用凍干技術除去水分子,抑制水解及氧化反應,降低mRNA斷裂的風險。在前期工作的基礎上,將烷基側鏈引入PBAEs中,使之不僅能發揮本身所具有的核酸包封強、溶酶體逃逸強等優勢,還能以烷基側鏈和FNP中的其他脂質的脂肪鏈相互作用,通過納米粒子內部的疏水相互作用來增加納米粒的穩定性。最后在FNP中加入陽離子脂質DOTAP使納米粒的表面電位變為正,一方面能夠通過吸附玻連蛋白特異性靶向于肺,另一方面納米粒子間的電荷排斥作用增大也能進一步強化納米粒的穩定性。
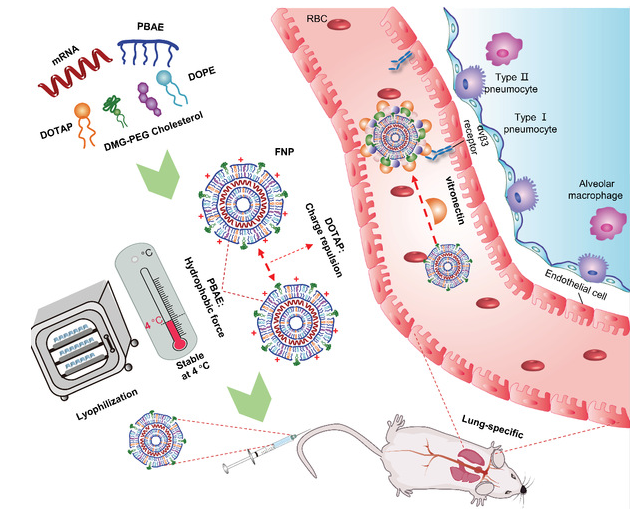
圖1. FNP遞送平臺示意圖
依據上述設計思路,研究團隊構建了具有不同封端基團、側鏈長度以及聚合度的新PBAEs庫,證明了上述三種策略的聯合增強穩定性的可行性,還探索了其器官靶向的機制,肺內細胞遞送的特異性以及質粒DNA遞送的普適性。
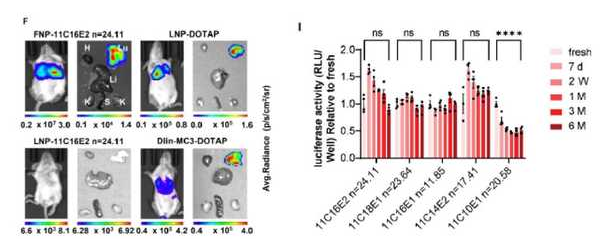
圖2. FNP體內遞送效果及凍干后4℃長期穩定性
該論文題為“Helper-Polymer Based Five-Element Nanoparticles (FNPs) for Lung-Specific mRNA Delivery with Long-Term Stability after Lyophilization” 。李劍峰課題組2021級博士研究生曹燕以及2020級碩士研究生何宗興為本文共同第一作者,李劍峰為本文通訊作者。上海科技大學為第一完成單位。
論文鏈接:https://pubs.acs.org/doi/full/10.1021/acs.nanolett.2c01784
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn