


截圖
鑒定腫瘤微環境中腫瘤抗原特異CD8T細胞的特征及其分化狀態是理解腫瘤免疫治療機制的關鍵。最近相關文章[1,2]在單細胞水平上鑒定了未經治療(treatment-naive)腫瘤中腫瘤抗原特異T細胞以及bystander(非腫瘤特異性T細胞)的特征與區別,發現腫瘤中的腫瘤抗原特異T細胞會上調以PD-1、CTLA4、LAG3、TIGIT為代表的共抑制性受體。相應地,這些共抑制性受體以及CD39等T細胞耗竭(exhaustion)相關基因可以準確地鑒定treatment-na?ve腫瘤中的腫瘤抗原特異T細胞。但是在ICB治療過程中,張澤民課題組之前的研究[3]以及其他相關研究[4]發現腫瘤抗原特異T細胞在治療的作用下可以維持在未耗竭的前體細胞的狀態,因此如何有效地準確鑒定ICB治療前后(1)終末分化且耗竭程度高的腫瘤特異T細胞以及(2)耗竭程度低的腫瘤特異T細胞前體細胞仍然是一個難題。
通過分析包含CD8T細胞基因表達以及對應抗原特異性信息的公共單細胞數據集,并結合發表的具有治療前后配對的腫瘤浸潤CD8T細胞數據集,該研究發現CXCL13的表達既可以準確鑒定終末分化且耗竭程度高的腫瘤特異T細胞克隆,也可以鑒定ICB治療后有響應腫瘤中大量出現的耗竭程度低的腫瘤特異T細胞前體細胞克隆(圖1)。
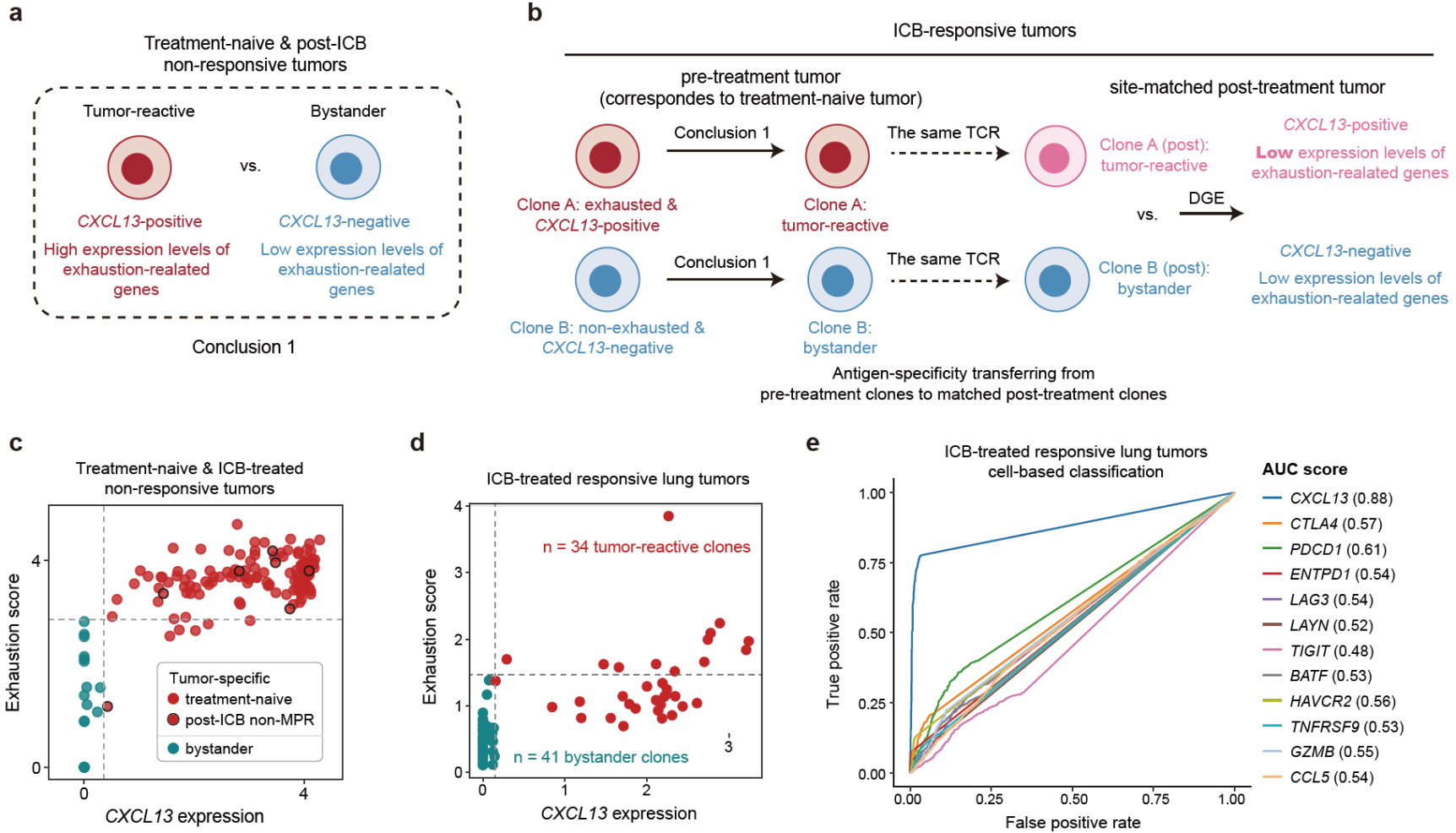
圖1 CXCL13鑒定ICB治療前后腫瘤中不同分化狀態的腫瘤特異CD8T細胞
為了探究ICB在多癌種上對腫瘤特異CD8T細胞的作用機制,研究人員收集了已發表的9個免疫治療單細胞數據集,包括來自102個病人治療前后的205個腫瘤樣本,涵蓋5種癌癥類型(NSCLC, BCC, SCC, breast cancer & RCC)。研究人員基于CXCL13表達量鑒定這些數據集中的腫瘤特異CD8T細胞,發現腫瘤特異性CXCL13+CD8+T細胞顯著富集在對ICB有響應的腫瘤中,并且在有效地治療后顯著增加(圖2),表明了腫瘤特異性CXCL13+CD8+T細胞在治療過程中發揮關鍵作用,且在治療前的浸潤程度可以預測ICB的療效。

圖2 ICB治療前后腫瘤特異性CXCL13+CD8+T細胞變化
之前對于基底細胞癌(BCC)和乳腺癌的研究[5,6]發現ICB有效治療后終末分化且耗竭程度高的腫瘤特異T細胞顯著增加。而在肺癌的研究中,張澤民課題組之前的研究[4]發現有效的ICB治療增加了耗竭程度低的腫瘤特異T細胞前體細胞。腫瘤特異T細胞前體細胞具有更強的增殖能力和整體上更強的抗腫瘤功能[7];而終末分化的腫瘤特異T細胞隨著耗竭程度變強雖然功能有下降,但是這群細胞仍然能夠殺傷癌細胞[8,9],并且,在treatment-na?ve腫瘤中由于前體細胞數量很少[2],終末分化的腫瘤特異CD8T細胞是主要殺傷癌細胞的CD8T細胞類群。此外,研究表明ICB會進一步增加終末分化的腫瘤特異CD8T細胞的殺傷能力[10],因此在不同癌癥類型中觀察到ICB有效治療后顯著增加的(1)終末分化且耗竭信號較強的腫瘤特異T細胞或(2)耗竭程度低的腫瘤特異T細胞前體細胞都可以有效殺傷癌細胞并引起腫瘤的減小。
為了進一步探究這一現象,研究人員對腫瘤特異性CXCL13+CD8+T細胞進行聚類分析,鑒定了前體腫瘤特異性CXCL13+CD8+T細胞(包括IL7R+HAVCR2-以及GZMK+HAVCR2-兩個亞型)以及耗竭信號較強的終末分化腫瘤特異T細胞,并且發現腫瘤特異性CXCL13+CD8+T細胞不同分化狀態亞型在表觀特征上是穩定的(圖3)。研究人員發現在不同癌癥類型中以及治療策略不同時(例如是否與化療聯用),治療引起增加的腫瘤特異T細胞的亞類是不一樣的。當腫瘤微環境整體免疫抑制強度較高時,ICB不足以維持前體腫瘤特異性CXCL13+CD8+T細胞的狀態,觀察到終末分化的腫瘤特異T細胞增加,但治療仍然有效。當腫瘤微環境整體免疫抑制強度較低時,ICB有效阻斷了腫瘤特異性CXCL13+CD8+T細胞前體細胞向耗竭程度較高的終末狀態的分化(圖3)。

圖3 CXCL13+CD8+ T細胞亞型與ICB治療關系
在CD4T細胞中,ICB顯著地增加了CXCL13+CD4+T細胞(圖4),表明了該類群是CD4 T細胞中對ICB響應的主要類群,這與最近相關研究發現CXCL13+CD4+T細胞能夠識別并處理腫瘤抗原特異一致[11]。此外,研究發現同時檢測腫瘤中CXCL13+CD4+T和CXCL13+CD8+T細胞類群的比例可以更準確地預測ICB的療效,在多個癌癥類型中的預測準確率>90%(圖4),性能顯著高于傳統的標志物TMB。

圖4 CXCL13+CD4+T細胞與免疫治療
該研究的科學發現(1)為分析腫瘤中的腫瘤特異T細胞提供了新的思路;(2)為預測ICB療效提供了準確的生物標志物;(3)為設計以TCR-T為代表的細胞療法提供了新的策略,即通過CXCL13表達水平鑒定腫瘤中不同分化階段的腫瘤特異T細胞克隆并設計后續臨床試驗;(4)為進一步提高ICB療效提供了新的見解,即通過ICB與其他療法聯合治療進一步緩解腫瘤微環境中的免疫抑制強度,維持前體腫瘤特異性CXCL13+CD8+ T細胞狀態并阻斷其向終末狀態分化,進而繼續提高治療效果。
北大BIOPIC/生命科學學院博士生劉寶琳為該論文的第一作者,張澤民實驗室張園園博士、王東方博士以及百奧智匯胡學達博士為該論文作出了重要貢獻。張澤民為該論文的通訊作者。該研究得到北京市科委、國家自然科學基金、國家重點研發計劃、ICG、和昌平實驗室的支持和資助。
對應Commentary文章:https://www.nature.com/articles/s43018-022-00432-8
參考文獻:
[1] Lowery, F. J. et al. Molecular signatures of antitumor neoantigen-reactive T cells from metastatic human cancers. Science (2022).
[2]Oliveira et al., Phenotype, specificity and avidity of antitumour CD8+ T cells in melanoma, Nature(2021).
[3] Liuet al. Temporal single-cell tracing reveals clonal revival and expansion of precursor exhausted T cells during anti-PD-1 therapy in lung cancer. Nat. Cancer (2022).
[4] Caushi et al., Transcriptional programs of neoantigen-specific TIL in anti-PD-1-treated lung cancers, Nature(2021).
[5] Yost, K. E. et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nat. Med. (2019).
[6] Bassez, A. et al. A single-cell map of intratumoral changes during anti-PD1 treatment of patients with breast cancer. Nat. Med. (2021).
[7] Eberhardt, C. S. et al. Functional HPV-specific PD-1+ stem-like CD8 T cells in head and neck cancer. Nature (2021).
[8] Thommen, D. S. et al. A transcriptionally and functionally distinct PD-1+ CD8+ T cell pool with predictive potential in non-small-cell lung cancer treated with PD-1 blockade. Nat. Med. (2018).
[9] Duhen, T. et al. Co-expression of CD39 and CD103 identifies tumor-reactive CD8 T cells in human solid tumors. Nat. Commun. (2018).
[10] Clarke, J. et al. Single-cell transcriptomic analysis of tissue-resident memory T cells in human lung cancer. J. Exp. Med. (2019).
[11] Zheng, C. et al. Transcriptomic profiles of neoantigen-reactive T cells in human gastrointestinal cancers. Cancer Cell (2022).
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn