



蛋白質的位點選擇性功能化標記在化學生物學中具有廣泛的應用。通過化學或酶促反應對蛋白質進行位點選擇性修飾對于包括細胞和體內成像、蛋白質組學、藥物釋放和材料科學在內的各個領域都很重要。天然存在的酶經過工程改造,可以接受N-端、C-端和內部標記具有適當氨基酸識別序列的蛋白質的新底物。這些方法對于特定位點標記蛋白質具有革命性意義,但底物特異性、反應動力學甚至試劑穩(wěn)定性的差異可能導致標記不完全以及標記和未標記蛋白質不可分離的混合。使用遺傳編碼的親和標簽純化復雜混合物(例如裂解物或酶催化標記反應)僅限于從混合物中去除單個蛋白質種類。用小分子親和手柄標記的蛋白質也可以通過親和層析選擇性純化。而生物正交化學也已用于將親和標簽共價連接到蛋白質或在樹脂上共價捕獲蛋白質,這種方法將生物正交基團應用在蛋白質純化而不是功能分子與蛋白質靶標的結合。廣泛的位點選擇性蛋白質偶聯(lián)方法可以受益于小分子、雙重用途標簽,其中單個官能團既可以促進蛋白質純化,又可以作為后續(xù)快速和定量生物正交標記。
為此,作者開發(fā)了具有雙重作用的親和生物正交化學標簽(ABC-tags),即促進蛋白質純化以及作為后續(xù)快速和定量生物正交標記的手柄(Fig. 1A)。作者設計了3-甲基-6-(2-吡啶基)四嗪的衍生物,可用于螯合固定化金屬離子親和層析(IMAC)-通常用于蛋白質純化的樹脂(Fig. 1B)。這些小型的兩用標簽可作為工具,與C-端、N-端或內部殘基的位點選擇性蛋白偶聯(lián)方法結合使用。由于四嗪連接的二氫噠嗪產物還保持對亞氨基乙酸鎳(Ni-IDA)樹脂的親和力,因此可以在“樹脂上”進行蛋白質-蛋白質綴合反應,以提供二聚體和異三聚體蛋白質偶聯(lián)物,而無需額外的純化步驟。
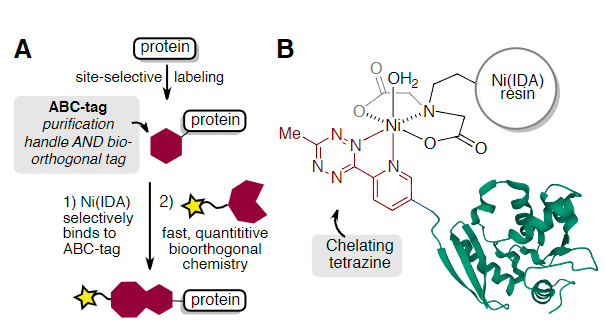
Fig. 1: (A)用于Ni(IDA)純化標記蛋白和生物正交反應的ABC標記(B)與Ni(IDA)樹脂螯合的吡啶基四嗪標記蛋白(PDB_ID 3KZY)(圖片來源:Angew. Chem. Int. Ed.)
首先,作者設計并評估了一系列潛在的ABC標標簽在連接到模型蛋白時與Ni-IDA瓊脂糖樹脂結合的能力(Fig. 2)。通過ESI-MS確認綠色熒光蛋白(GFP)用每個標簽進行位點特異性標記,并通過紫外-可見光譜測定總結合蛋白(Fig. 2)。初步研究結果表明吡啶基取代基的重要性(Fig. 2)。附加雙吡啶基-Tz標簽(1g)將結合能力提高到9 mg/mL,相對于1d增加了2.6倍,這表明使用多價吡啶基-Tz附件的方法可用于提高結合能力。
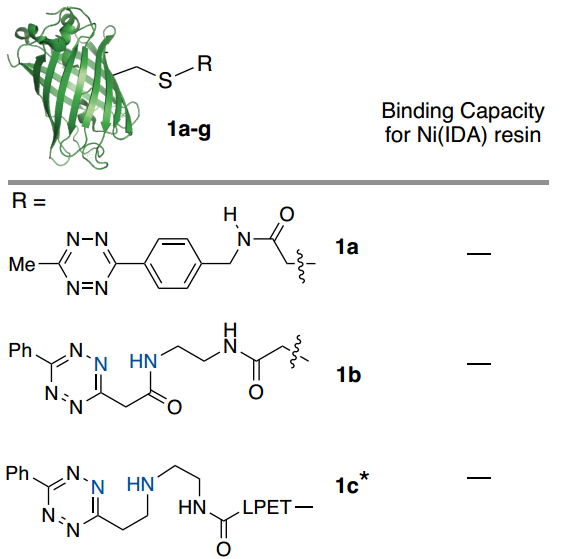
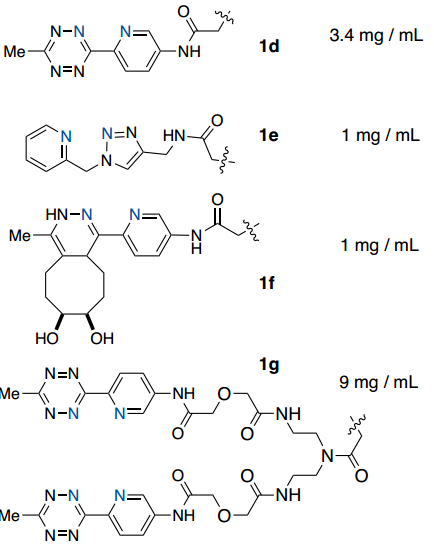
Fig. 2: GFP(PDB_ID 2B3P)用一組四嗪化合物在半胱氨酸處進行了位點特異性修飾并評估了與Ni(IDA)樹脂的結合能力(圖片來源:Angew. Chem. Int. Ed.)
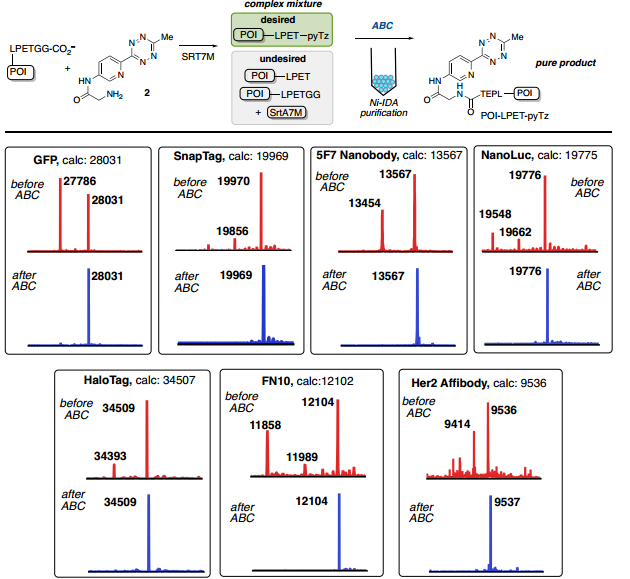
Fig. 3: 從復雜混合物中純化:C-末端分選酶連接(圖片來源:Angew. Chem. Int. Ed.)
在蛋白質位點特異性標記研究方面,對C-末端標記和純化酶催化的生物交聯(lián)已成為一種用于將生物正交手柄與蛋白質進行位點特異性結合有效且簡單的方法。與先前關于SrtA7M生物偶聯(lián)的報道一致,每種蛋白質反應混合物都以良好的收率獲得了所需的偶聯(lián)物(POI-LPET-pyTz);對于除GFP和Her2-affibody之外的所有蛋白質,通過ESI-MS分析,標記蛋白質的百分比大于50%。反應混合物中還存在與蛋白質起始原料(POI-LPETGG)、SrtA7M酶和/或水解蛋白質(POI-LPET)一致的雜質(Fig. 3)。經過洗柱、洗脫,通過UV-Vis確定蛋白質回收率,并通過ESI-MS評估純度。對于每次洗脫,僅觀察到POI-LPET-pyTz偶聯(lián)物,回收率范圍為72-95%(Fig. 3)。此外,還使用GFP、SnapTag、5F7納米抗體和NanoLuc熒光素酶進行了測試,對于通過FPLC純化的每種蛋白質,回收率都很高(>85%)。同時,作者也表征了ABC標記策略在N-端直接標記的應用效果。為此,作者合成了ABC標記的CBT配體(3),用于證明N-端直接標記單體鏈霉親和素2(mSA2),并通過ESI-MS確定標記蛋白質的百分比(Fig. 4B)。純化后蛋白的ESI-MS包含一個對應于mSA2-四嗪偶聯(lián)物的峰和一個由于單次氧化引起的小峰。mSA2-四嗪偶聯(lián)物的回收率為88%(Fig. 4)。
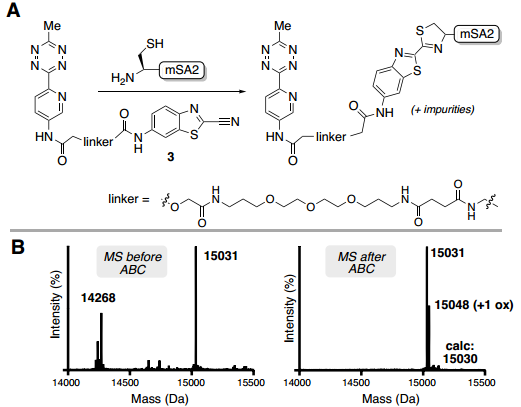
Fig. 4: 使用CBT連接純化N端修飾的mSA2(圖片來源:Angew. Chem. Int. Ed.)
此外,為了驗證ABC標簽是否能夠從復雜混合物中實現(xiàn)目標蛋白質的純化,作者從未知蛋白質的復雜混合物中測試了ABC純化能力,將確定量的GFP-pyTz以低豐度摻雜到細菌細胞裂解混合物中(Fig. 5E)。通過Ni-IDA純化細菌裂解物,并以83%的收率回收純GFP-pyTz(>90%,凝膠)。
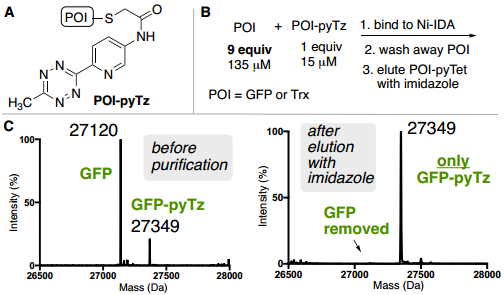
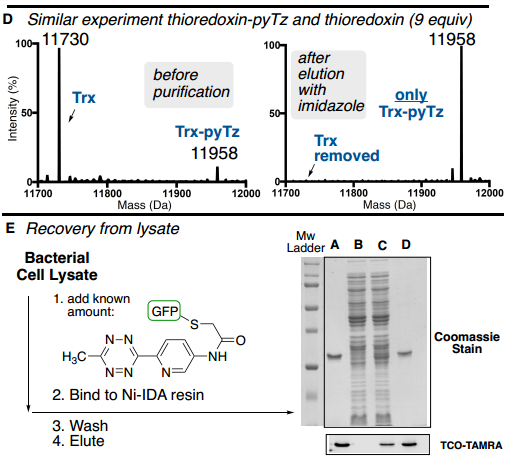
Fig. 5: ABC標簽蛋白質混合物中對低豐度目標蛋白的純化表征(圖片來源:Angew. Chem. Int. Ed.)
最后,pyTz蛋白原位結合Ni-IDA樹脂用于純化目的的能力使作者考慮樹脂結合蛋白是否可以促進與游離sTCO蛋白對應物的反應以實現(xiàn)有效的蛋白偶聯(lián)。ABC標記的蛋白質偶聯(lián)物是在幾分鐘內形成,通過二氫噠嗪接頭保持樹脂結合,并將雜質沖走,用于實現(xiàn)高效的蛋白質-蛋白質結合和純化。作者通過分選酶連接制備帶有sTCO(5)或pyTz(6)的C-末端Snap標簽的偶聯(lián)物。成功的C-末端連接的SnapTag偶聯(lián)物(7)通過二氫噠嗪接頭與樹脂保持結合,并通過ESI-MS和SDS-PAGE確定其完全洗脫(Fig. 6A)。證實了使用合成接頭不僅可以實現(xiàn)蛋白質二聚體偶聯(lián),還可以擴大異三聚體的使用范圍。同時,使用合成接頭不僅可以實現(xiàn)直接蛋白質-蛋白質結合,還可以擴大獲得蛋白質異源三聚體的途徑(Fig. 6B)。
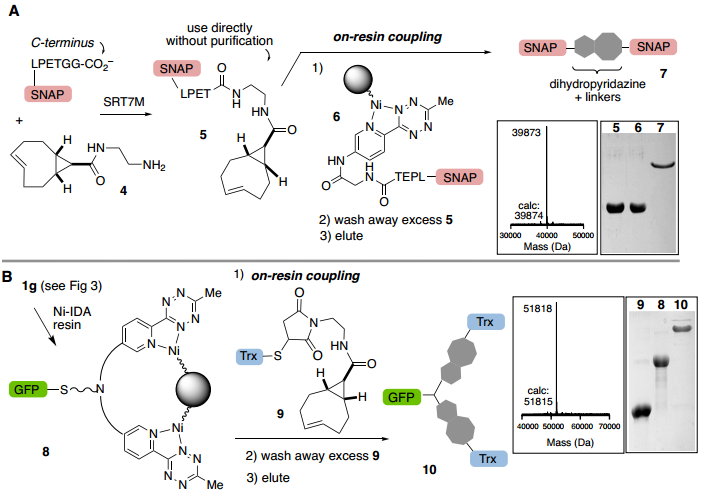
Fig. 6: 樹脂上的蛋白質偶聯(lián)反應(圖片來源:Angew. Chem. Int. Ed.)
總結
Samuel L. Scinto和Joseph M. Fox團隊開發(fā)了具有雙重功能的2-吡啶基-四嗪ABC標簽,可通過與Ni(IDA)樹脂的原位配位實現(xiàn)蛋白質純化和生物正交化學反應。ABC標記蛋白和互補sTCO標記蛋白之間的樹脂上反應通過二氫噠嗪接頭保持結合,從而能夠在數(shù)分鐘內以高純度一步構建具有確定幾何形狀的二聚體和異源三聚體蛋白偶聯(lián)物。同時,作者預計ABC標簽將普遍用于需要純生物偶聯(lián)物和快速體外蛋白質組裝。
聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn