

(圖片來源:Nature Catalysis)
光合作用是利用光能使二氧化碳(CO2)和水轉化為有機化合物和氧氣的重要過程。一個多世紀以來,化學家們一直在效仿大自然,利用光催化來實現其它策略難以實現的化學轉化。除了紫外光驅動的反應過程外,可見光催化由于具有條件溫和、官能團兼容性好等特點,是實現惰性鍵活化的有力工具。
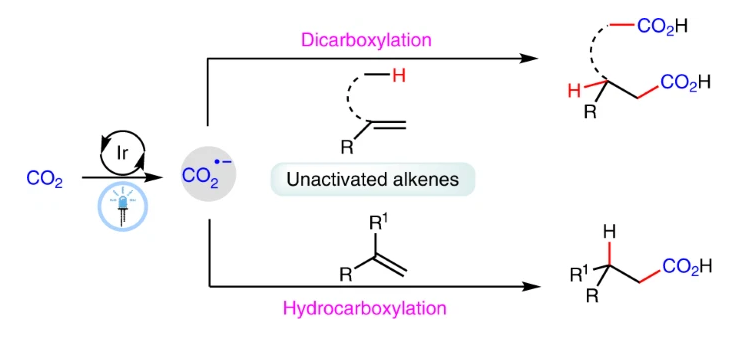
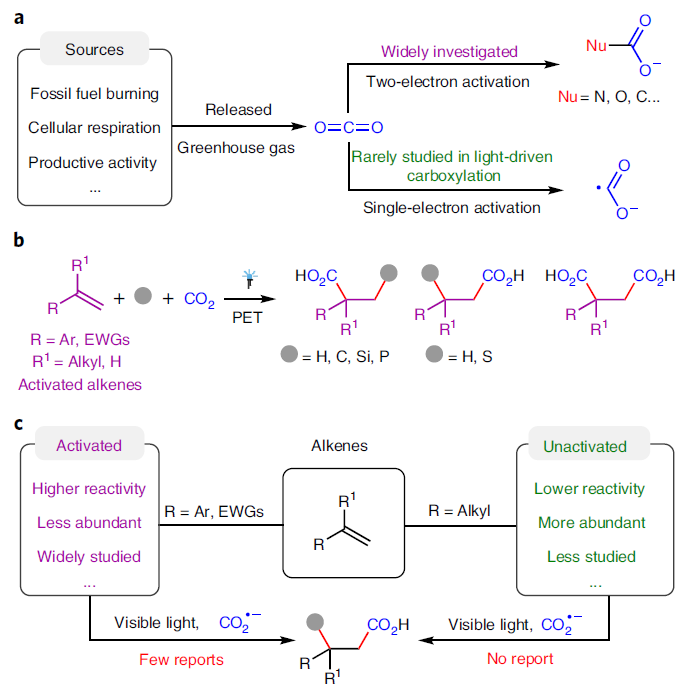
由于CO2具有含量豐富、簡單易得、毒性低等特點,目前已經成為化學合成中理想的碳源。近些年,利用可見光催化實現二氧化碳的合成轉化引起了化學家們的廣泛關注。除了利用燃料分子和大宗化學品的還原之外,使用可見光催化二氧化碳參與的羧基化反應(雙電子活化模式)是合成具有較高實用價值的羧酸及其衍生物的有效手段,并在制藥和高分子工業中具有廣泛的應用。雖然通過CO2的直接單電子還原生成的CO2自由基陰離子(CO2??)可以為多樣的化學選擇性和區域選擇性轉化提供新的策略,但由于CO2具有較高的還原電位以及CO2??的不穩定性,使得其很少應用在在光催化的羧基化反應中(Fig. 1a)。
由于烯烴可以從大宗化學品中獲得且碳碳雙鍵為有機化合物中最常見的官能團,因此烯烴是在可見光催化CO2參與的羧基化反應中研究最多的分子。目前,化學家已經發展了多種光催化體系,以不同化學選擇性和區域選擇性實現了從烯烴到多樣羧酸的制備。然而,這些反應大多僅限于活化烯烴,如苯乙烯和丙烯酸酯等(Fig. 1b,1c)。相反,烷基烯烴(非活化烯烴)由于具有低活性和難以控制選擇性等問題則很少應用在可見光催化的CO2參與的羧基化反應中。
最近,四川大學余達剛課題組實現了可見光催化CO?與非活化烯烴的雙羧基化和氫-羧基化反應。在溫和的反應條件下,多種非活化烯烴可以經歷此選擇性羧基化過程,以中等至良好的產率實現相應的羧酸、二羧酸以及非天然α-氨基酸衍生物的合成。反應機理涉及CO2通過連續光誘導的電子轉移過程被還原為CO2??,隨后此物種進攻非活化烯烴以及后續的氫原子轉移等相關過程得到相應的產物(Fig. 1e)。此外,DFT計算表明,無論是從熱力學還是動力學上來看,CO2??與活化烯烴的自由基加成比與非活化烯烴自由基加成無論在熱力學還是動力學上均更有利,因此證明此過程具有一定的挑戰性(Fig. 1d)。
(圖片來源:Nature Catalysis)
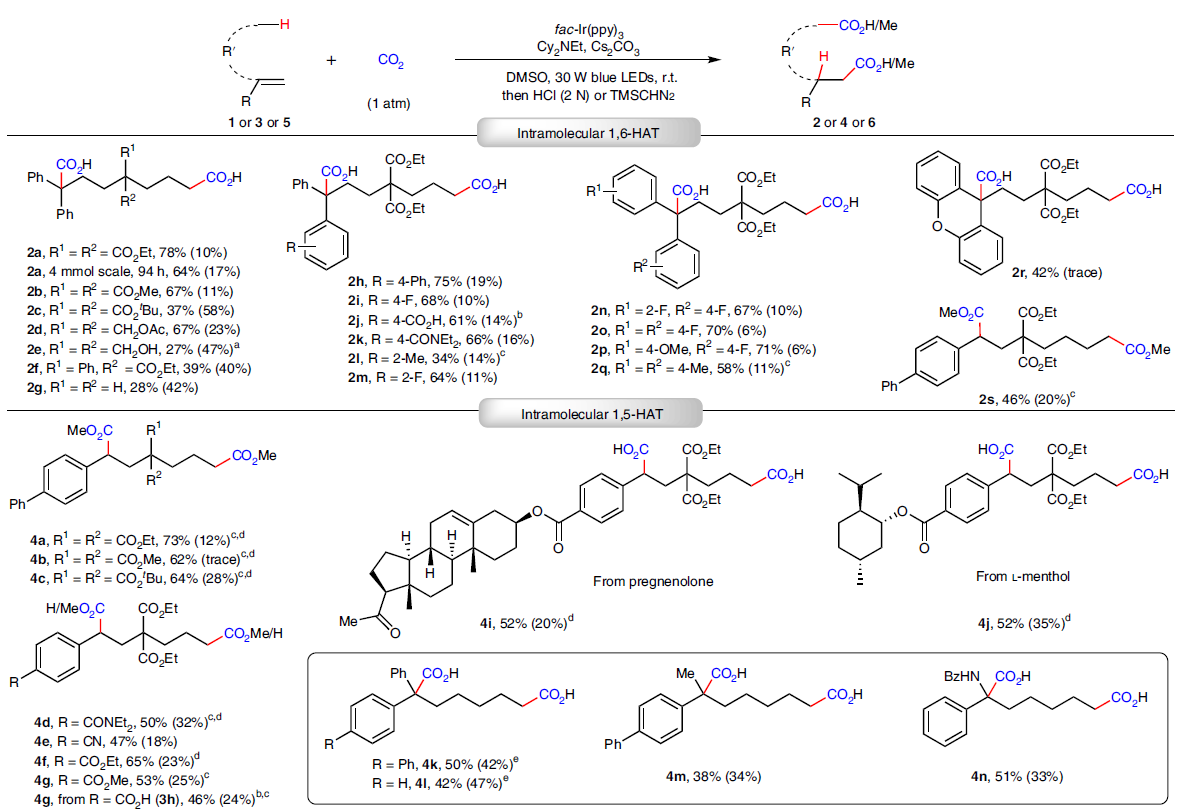
首先,作者以非活化烯烴1a作為模板底物進行條件篩選。發現當使用fac-Ir(ppy)3(1 mol%)作為光催化劑,Cs2CO3(4.5 equiv)作堿,Cy2NEt(2.5 equiv)作為電子給體,DMSO(0.1M)作溶劑,在1 atm CO2存在下,藍光引發,室溫反應48小時可以以78%的產率得到目標1,7-雙羧基化產物2a。且控制實驗表明,體系中的可見光、光催化劑、Cy2NEt、Cs2CO3以及CO2均為高產率實現產物合成的重要因素。
在得到了最優條件后,作者對此1,7-雙羧基化反應中非活化烯烴1的底物范圍進行了探索(Fig. 2)。實驗結果表明,一系列烷基鏈上的不同取代均可兼容,且具有偕二乙氧基羰基的產物(2a)產率最佳(78%)。并且當反應放大至4.0 mmol規模時仍可以以64%的產率得到產物。芳環上具有不同吸電子基和給電子基的底物(1h-1q)也均可兼容此體系,以中等至良好的產率得到相應的產物。值得注意的是,一些具有重要應用價值的官能團,如C-F鍵(1i, 1m-1p)、羧酸(1j)、酰胺(1k)等均可兼容,這為產物的進一步轉化提供了機會。遺憾的是,可能是由于立體位阻的影響,芳環上含有鄰位取代基時產物的產率較低(1l, 1m, 1n)。除此之外,含有氧雜蒽骨架的原料1r也可以順利實現轉化,以42%的產率得到產物。
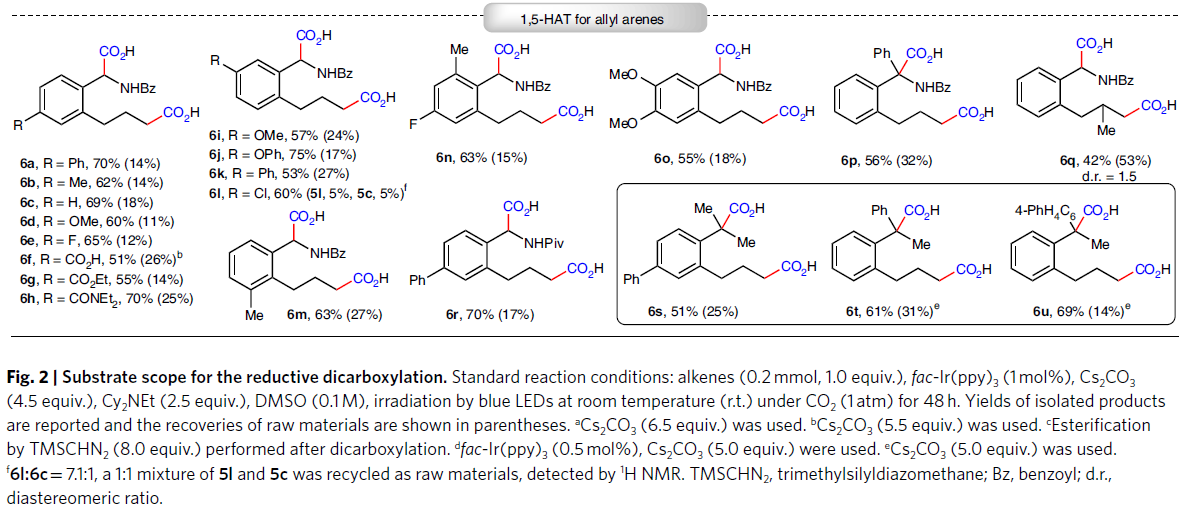
隨后,作者利用含有芐位C-H的非活化烯烴3,通過分子內1,5-HAT過程可以順利實現1,6-雙羧基化產物的合成。并且此雙羧基化過程并不受烷基鏈取代的影響(3a-3c)。此外,芳基上的不同官能團,如酰胺(3d)、腈(3e)、酯(3f, 3g, 3i, 3j)以及羧酸(3h)均可兼容。值得注意的是,具有復雜天然產物骨架的底物,如pregnenolone (3i)和L-menthol (3j)也可以分別以52%的產率得到相應的產物。接下來,基于非天然α-氨基酸衍生物的重要性,作者還實現了鄰位烯丙基取代的芐胺衍生物(5a-5r)的雙羧基化反應。且此過程可以同樣具有良好的官能團兼容性,如甲氧基(5d, 5i, 5o)、羧酸(5f)、酯(5g)、酰胺(5h)、苯氧基(5j)、C-F鍵(5e, 5n)等均可兼容此反應。值得注意的是,此轉化不受芳環鄰位取代基的限制(5m, 5n)。除了α-氨基酸衍生物外,利用此方法還可以以中等至良好的產率實現含有季碳中心羧酸(6s-6u)的合成,并且此類化合物用其它方法較難獲得(Fig. 2)。
(圖片來源:Nature Catalysis)
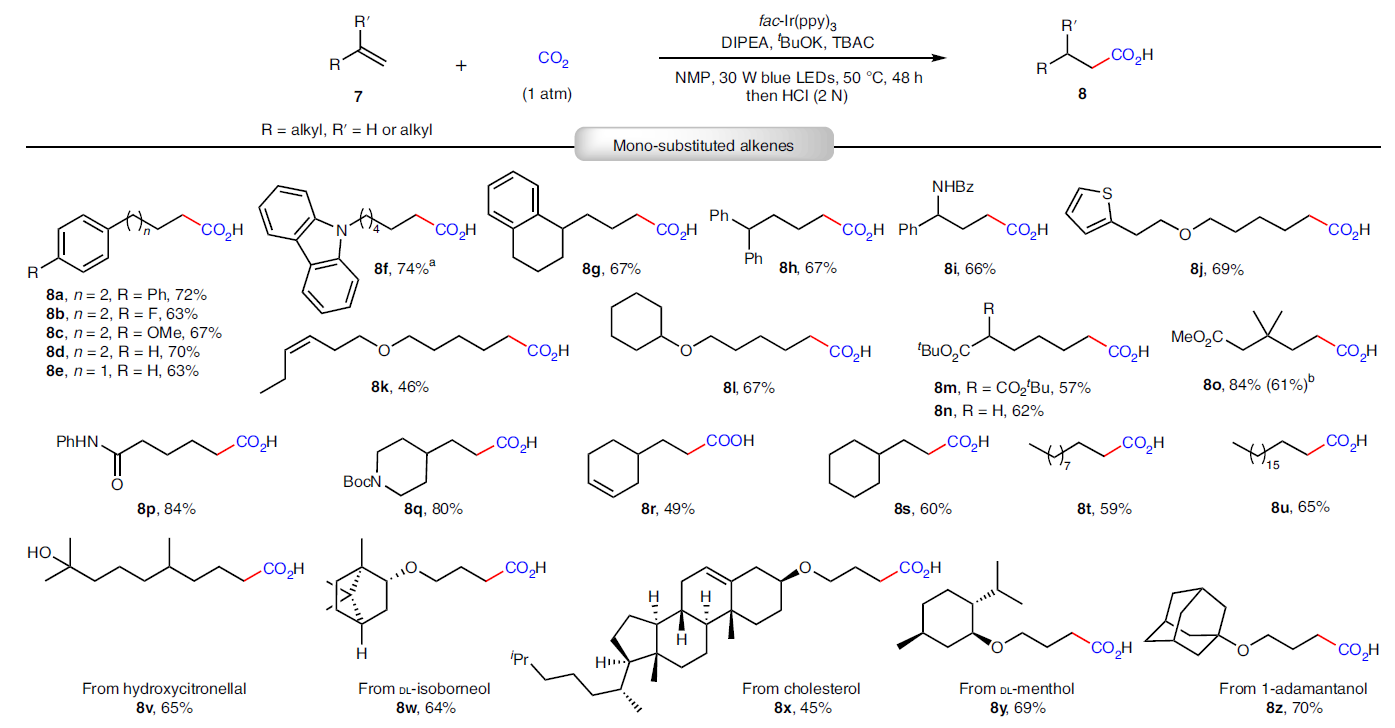
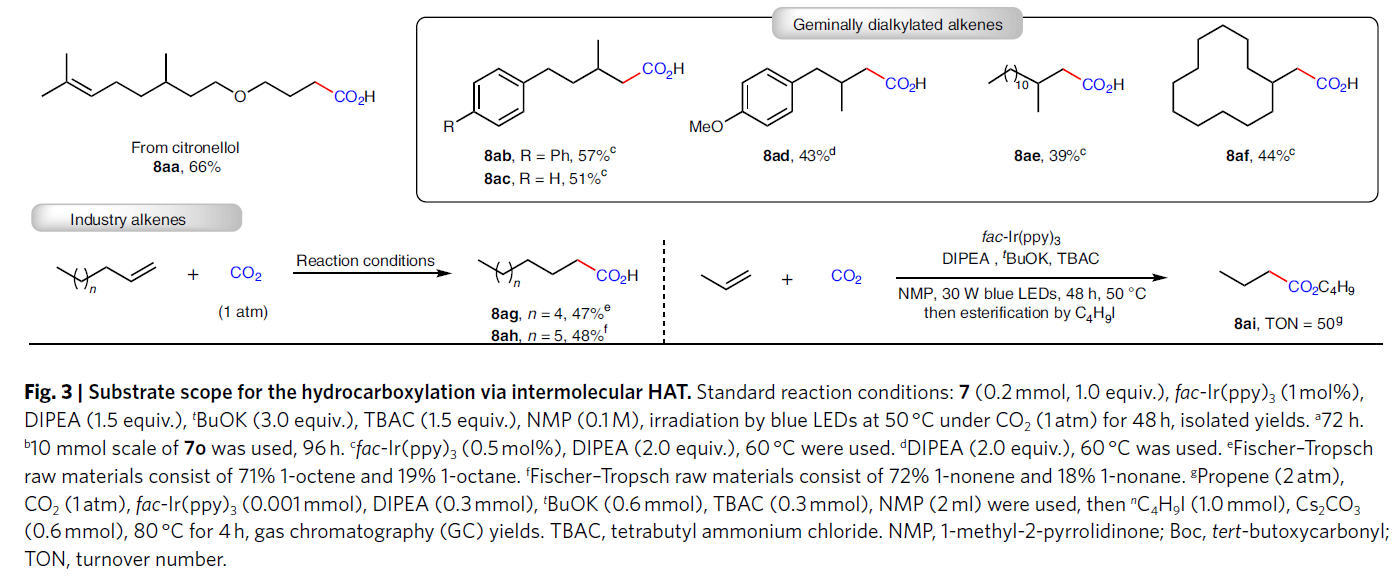
除了利用分子內的HAT過程實現雙羧基化以外,作者還進一步探索了非活化烯烴的氫-羧基化反應(Fig. 3)。高興的是,稍微改變一下反應條件,作者可以順利實現可見光催化非活化烯烴與CO2的氫-羧基化過程,以中等至良好的產率得到相應的反馬氏規則(anti-Markovnikov)產物。反應可以兼容不同鏈長和取代的非活化烯烴。此外,一些具有較大應用價值的官能團,如酰胺(7i, 7p, 7q)、酯(7m-7o)、羥基(7v)以及雜環(7f, 7j, 7q)等均可兼容。值得注意的是,此反應可以高選擇性的實現端烯的轉化,而分子內存在的內烯部分則可以在此還原體系內兼容(7r, 7x, 7aa)。此外,此反應策略還可以實現藥物衍生物的后期修飾,得到產物8v-8aa。除了單取代烯烴之外,偕二烷基烯烴也可以作為合適的底物實現此轉化,以中等產率得到相應的羧酸(8ab-8af)。為了進一步證明此方法的通用性,作者利用工業上得到的混合烯烴和烷烴參與反應,其可以選擇性的實現端烯的轉化得到產物8ag和8ah。對于廣泛應用的大宗化學品丙烯也可以利用此方法實現重要的丁酸衍生物8ai的合成。此外,對于7o,當將反應放大至10.0 mmol規模時,仍可以以61%的產率得到8o。
(圖片來源:Nature Catalysis)
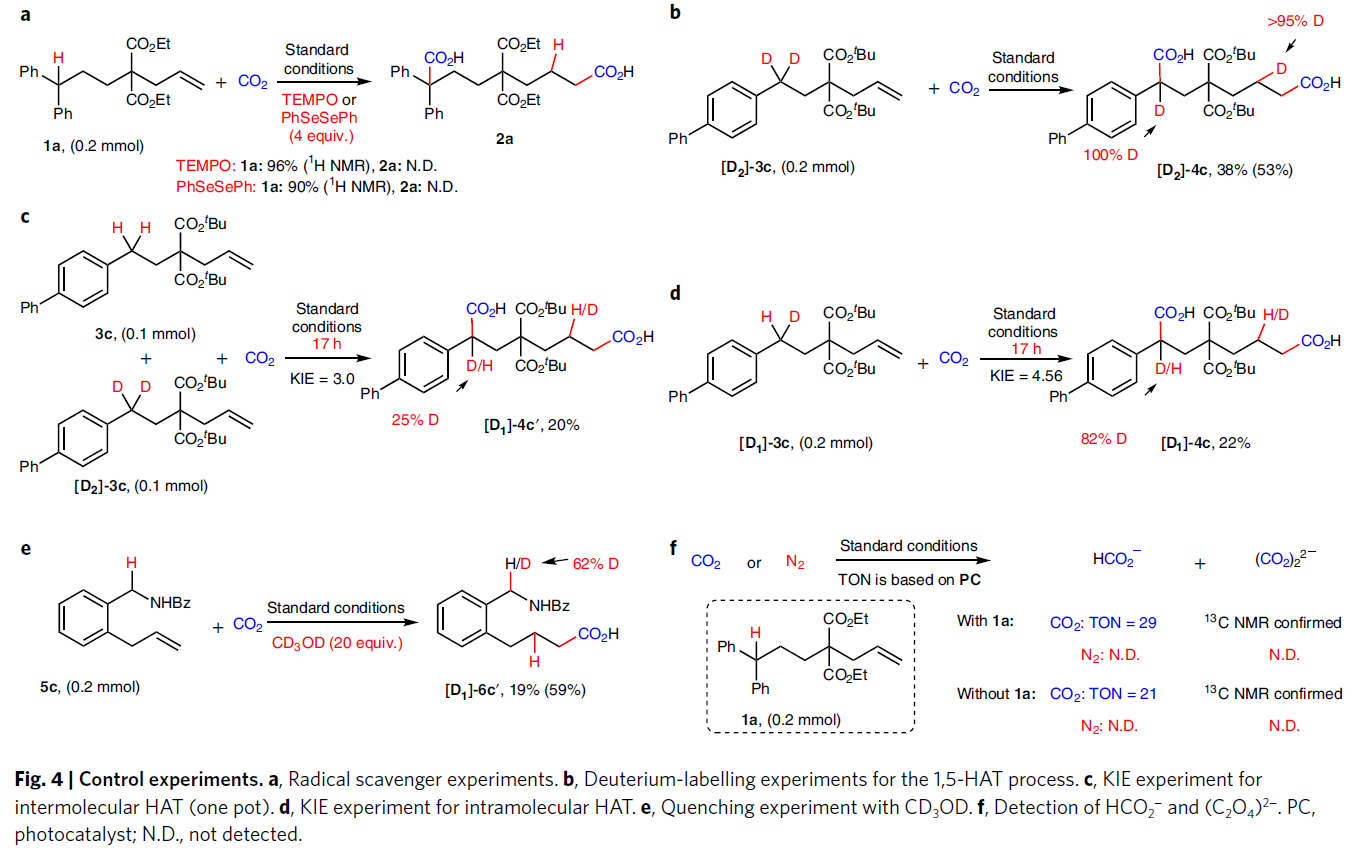
為了深入理解反應機理,作者進行了一系列控制實驗(Fig. 4)。首先,在自由基捕獲劑TEMPO或PhSeSePh存在下,作者并未觀察到目標產物的生成并幾乎全部回收起始原料1a,表明反應中可能涉及自由基中間體(Fig. 4a)。隨后,作者利用[D2]-3c參與反應,可以發生全部的氘原子轉移,得到相應的產物[D2]-4c。這表明反應中涉及分子內的HAT過程(Fig. 4b)。接下來, 分子間(KIE = 3.0)和分子內(KIE = 4.56)KIE(kinetic isotope effect)實驗表明分子內的HAT可能為反應的決速步驟(Fig. 4c, 4d)。當在標準條件下加入氘代甲醇時可以觀察到芐位的氫被部分氘代,表明反應中可能涉及芐位碳負離子中間體(Fig. 4e)。此外,作者通過在存在或不存在烯烴1a的條件下分別監測HCO2?與(C2O4)2?的形成,得出CO2可能會在還原條件下被還原,由此也進一步證明了CO2??的形成(Fig. 4f)。
(圖片來源:Nature Catalysis)
總結
四川大學余達剛課題組實現了可見光催化CO?與非活化烯烴的雙羧基化和氫-羧基化反應。在溫和的反應條件下,多種非活化烯烴可以經歷此選擇性羧基化過程,以中等至良好的產率實現相應的羧酸、二羧酸以及非天然α-氨基酸衍生物的合成。反應具有良好的底物適用性和官能團兼容性并且能夠兼容一系列復雜藥物和天然產物分子骨架。反應機理涉及CO2通過連續光誘導的電子轉移過程被還原為CO2??,隨后進攻非活化烯烴以及后續的氫原子轉移等相關過程從而得到相應的產物。此策略的發展為二氧化碳在羧基化反應中的利用開辟了新的方向。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn