

研究背景—Cas9蛋白遞送的瓶頸
基于CRISPR/Cas9的基因編輯技術以其特異性高,具備多重基因編輯能力等優勢在遺傳性疾病的基因治療中展現了極大的潛力。就在去年,Intellia Therapeutics公司與Regeneron公司合作在新英格蘭醫學雜志(NEJM)上發表了第一個基于CRISPR/Cas9的靜脈注射藥物NTLA-2001的1期臨床試驗中期數據,顯示包裹Cas9 mRNA/sgATTR(針對轉甲狀腺素蛋白點洋洋變性疾病)的脂質納米顆粒(Lipid Nanoparticle, LNP)能夠在單次注射后將患者血清中TTR水平下降87%。盡管如此,直接遞送Cas9/sgRNA核糖核蛋白(RNP)而非mRNA仍然具有極強的挑戰性,這包括:1)Cas9/sgRNA RNP具有極大的尺寸,其單復合物分子量高達近170 kDa,難以被病毒及傳統非病毒材料有效負載;2)Cas9蛋白易降解及變性,Cas9/sgRNA RNP面臨蛋白酶及核酸酶降解的雙重壓力;3)與核酸類藥物類似,Cas9/sgRNA RNP遞送的組織特異性差,遞送效率低。
研究亮點—本文的解決思路
目前,實現肝靶向的主要途徑有以下兩種:1)利用LNP包裹核酸藥物,LNP在進入血液循環后表面吸附載脂蛋白E(ApoE),ApoE能夠將LNP轉運到表達低密度脂蛋白受體(LDLR)的肝細胞表面,由LDLR介導LNP內吞進入肝細胞中;2)在遞送系統表面修飾半乳糖(Galactose)以靶向肝細胞表達的去唾液酸糖蛋白受體(ASGPR)。然而,無論是使用脂質還是在表面修飾半乳糖,都將導致一定程度的免疫原性及肝毒性。為了在實現肝特異性靶向的同時降低免疫原型及毒性,本文作者提出,使用從人肝星狀細胞中分離得到的外泌體為載體,以電穿孔的方式將Cas9/sgRNA RNP負載到外泌體內,通過攜帶靶向不同基因的Cas9/sgRNA RNP實現對多種肝臟疾病(如:急性肝損傷、慢性肝纖維化、原位肝癌等)的基因治療。
外泌體的制備及表征
首先,作者選擇了具有高增殖率的非轉化人肝星狀細胞LX-2作為外泌體的供體細胞,通過差速離心的方法分離與收集LX-2細胞所分泌的外泌體。收集的外泌體再用超速離心法進一步純化,并經0.22 μm濾膜過濾后得到外泌體重懸液。純化所得的外泌體重懸液與Cas9/sgRNA RNP以5:1(質量比)的比例混合,然后通過電穿孔的方法將RNP負載到外泌體內部,最后再次通過超速離心法對其進行純化,得到負載RNP的外泌體ExosomeRNP (圖1)。
動態光散射(DLS)顯示制備所得ExosomeRNP 的粒徑為50至200 nm,透射電子顯微鏡(TEM)下呈現碟形的納米囊泡結構,通過蛋白免疫印跡法(western blot)計算,ExosomeRNP的Cas9蛋白包封率約為20%。細胞水平實驗表明,ExosomeRNP能夠有效的將Cas9 RNP遞送到人肝星狀細胞(LX-2)及人肝癌細胞(Huh-7)的細胞質與細胞核中,并成功對多個疾病的靶基因進行了敲除。此外,小鼠體內實驗顯示,ExosomeRNP在尾靜脈注射后主要分布于小鼠的肝臟部位,其分布半衰期為10.52 min,消除半衰期為154.5 min,且具備優良的生物相容性及低免疫原性。
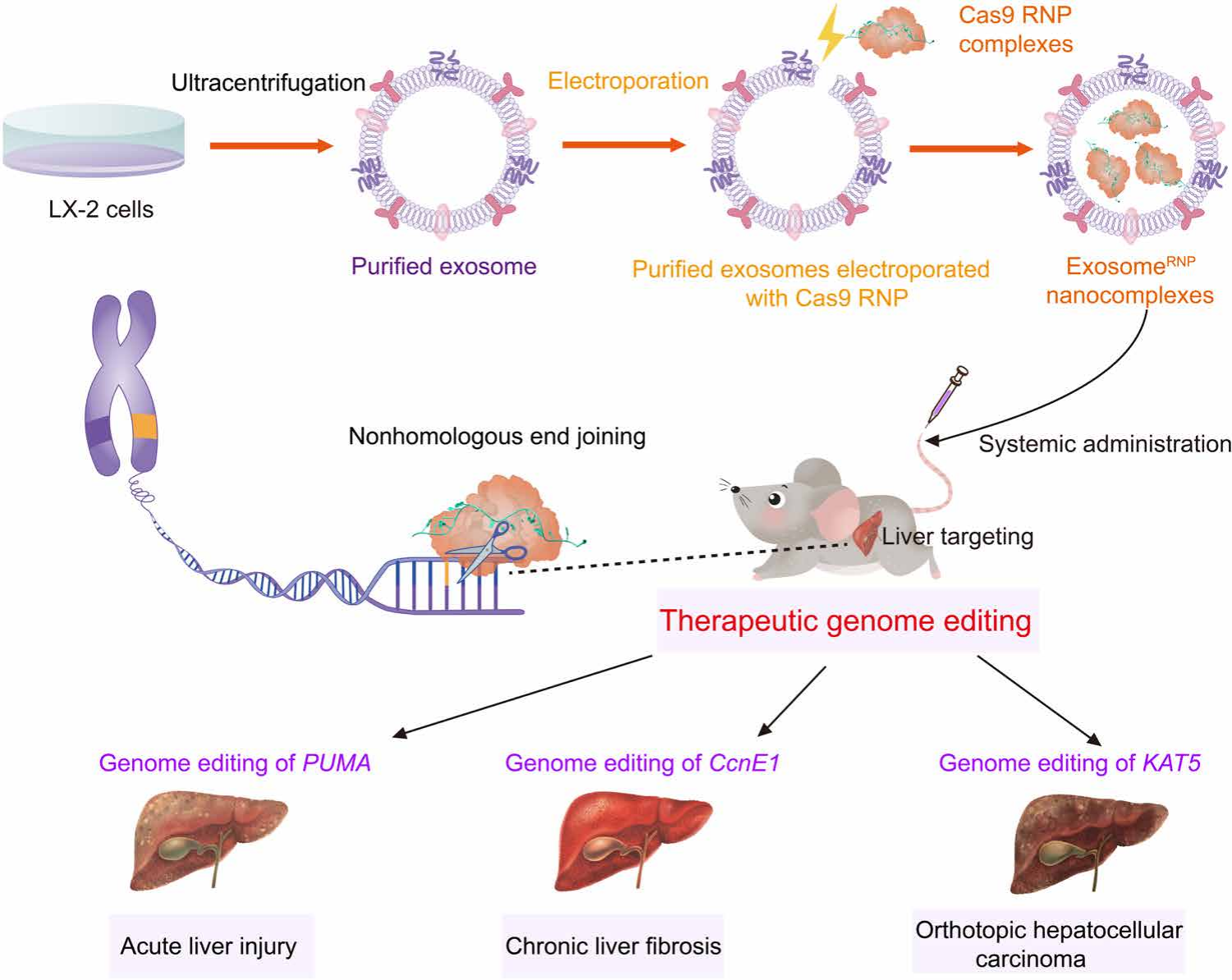
圖1. 肝靶向Cas9蛋白外泌體的制備及其在肝疾病基因治療中的應用(圖片來源:Sci. Adv.)
多種肝臟疾病的基因治療
疾病模型1:急性肝損傷,靶基因:p53上調的凋亡調節劑(PUMA)。在對乙酰氨基酚誘導的小鼠急性肝損傷模型中,間隔48 h的兩次給藥后,ExosomeRNP實現了小鼠肝部位PUMA基因約26.1%的敲除效率,并且顯著抑制了對乙酰氨基酚導致的血清丙氨酸轉氨酶(AST)和天冬氨酸轉氨酶(ALT)水平的升高。蘇木精-伊紅(H&E)染色結果顯示ExosomeRNP治療組小鼠的肝部位小葉中心細胞壞死和充血狀況得到顯著緩解,TUNEL細胞凋亡檢測表明ExosomeRNP顯著降低了小鼠肝部位細胞凋亡的比例,進而提高了小鼠72 h的存活率。
疾病模型2:慢性肝纖維化,靶基因:細胞周期蛋白E1(CcnE1)。CcnE1蛋白是周期蛋白依賴性激酶家族的一員,它能夠促進肝星狀細胞的增殖,在肝纖維化形成過程中發揮著重要的作用,抑制CcnE1蛋白的表達能夠抵抗肝臟的纖維化。在四氯化碳誘導的小鼠實質性肝纖維化模型中,每周兩次共計八次給藥后,ExosomeRNP實現了小鼠肝部位CcnE1基因約9.7%的敲除效率,并顯著抑制了四氯化碳誘導的CcnE1蛋白及α-平滑肌肌動蛋白的高表達,阻止了肝纖維化的發生。天狼星紅和馬森染色(評價肝纖維化水平)結果顯示,ExosomeRNP治療組小鼠肝部位天狼星紅和馬森陽性區域顯著小于其他對照組,表明ExosomeRNP能夠有效抑制四氯化碳導致的慢性肝纖維化進程(圖2)。
疾病模型3:原位肝癌,靶基因:賴氨酸乙酰轉移酶5(KAT5)。賴氨酸乙酰轉移酶5在肝癌的發生與進展中發揮著重要的作用,敲除編碼賴氨酸乙酰轉移酶5的基因能夠抑制腫瘤的生長。在原位肝癌(Huh-7細胞)小鼠模型中,每周兩次共計八次給藥后,ExosomeRNP實現了小鼠原位肝腫瘤KAT5基因約21.3%的基因敲除效率,并降低了賴氨酸乙酰轉移酶5的表達水平,抑制了腫瘤的生長,進而顯著提高了小鼠的存活率,展現了ExosomeRNP在原位肝癌治療中的極大潛力。
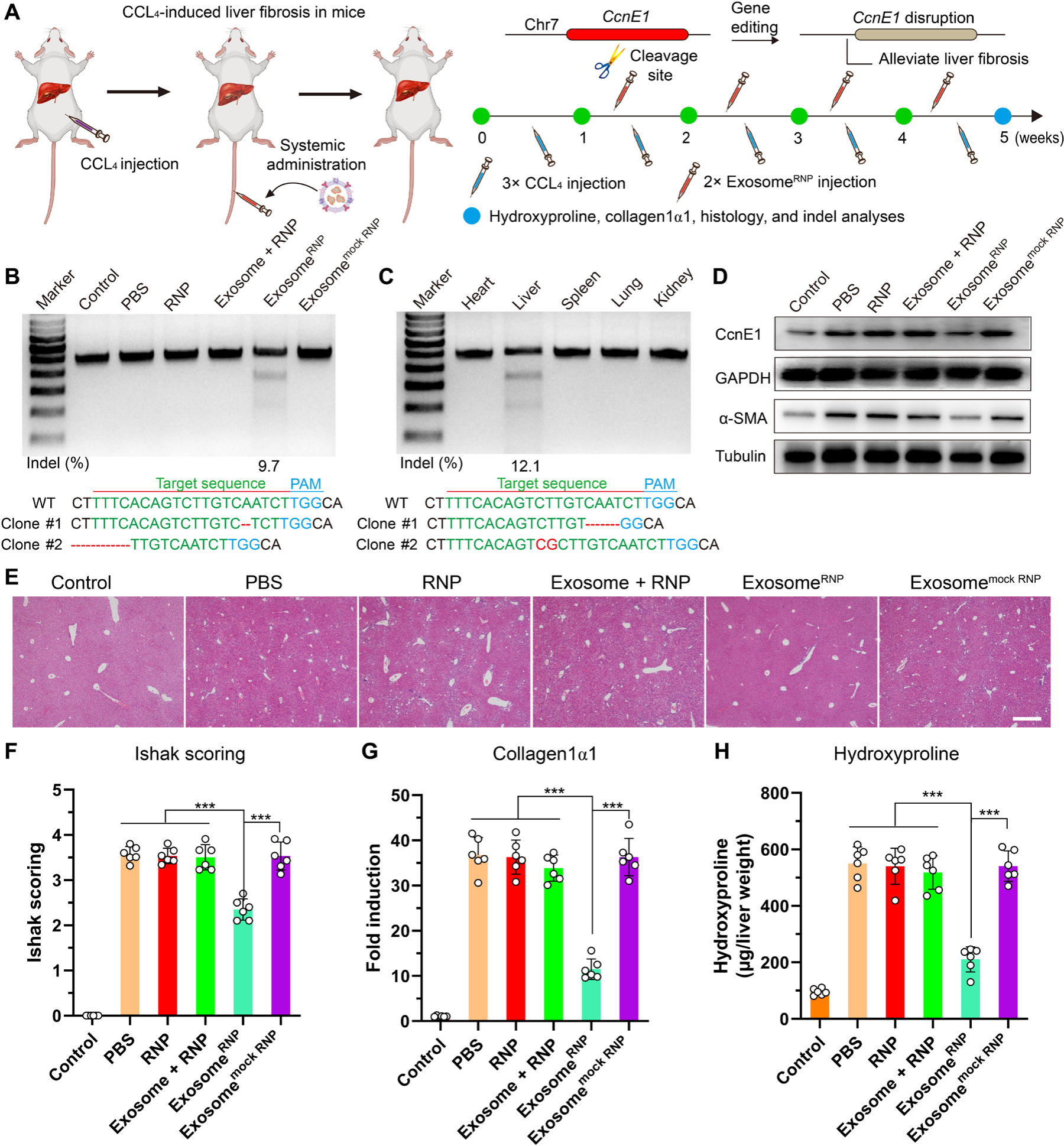
圖2. ExosomeRNP介導的基因編輯抑制四氯化碳誘導的肝纖維化(圖片來源:Sci. Adv.)
總結 本文中,作者通過差速及超高速離心法制備并純化了來源于人肝星狀細胞LX-2的外泌體,以電穿孔的方式將基因編輯蛋白Cas9/sgRNA RNP負載到外泌體內部,通過包裹靶向不同肝疾病基因的RNP制備得到一系列具有肝靶向的治療性外泌體ExosomeRNP。在急性肝損傷、慢性肝纖維化、及原位肝癌小鼠模型中,ExosomeRNP能夠特異性敲除肝臟部位相關疾病基因,抑制相關疾病的發生與發展,在肝疾病治療中展現了極大的潛力。此外,該方法還能夠用于負載其它蛋白質藥物,是一個通用且高效的非病毒蛋白質載體。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn