

圖片來源:J. Am. Chem. Soc.
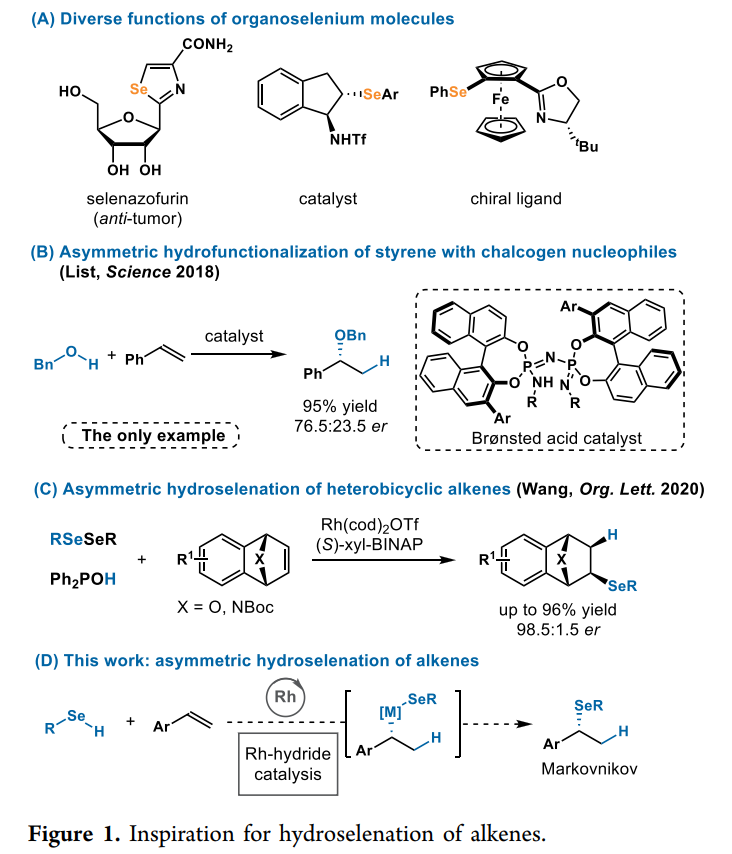
自1818年Berzelius發現硒以來,硒在藥物、催化劑和材料等方面均有廣泛的應用(Fig. 1A)。盡管硒是人類健康的基本元素,但與硫族元素氧和硫相比,對于硒的化學反應研究仍然很少。此外,雖然硫族親核試劑加氫官能化反應是一種原子經濟性高的策略,比如從容易獲得的烯烴(例如二烯烴、簡單烯烴和苯乙烯)構建各種結構單元,但對其研究并不廣泛。2018年,通過使用有機催化,List課題組實現了醇不對稱加成烯烴,然而,其僅報道了一個利用苯乙烯反應生成手性芳基醚的例子(Fig. 1B)。而加州大學爾灣分校Vy M. Dong課題組與北京理工大學楊小會課題組報道了首例使用 Rh-H催化實現硒醇與苯乙烯的對映選擇性偶聯。
在此之前,作者已經開發了1,3-二烯的氫硫醇化,其中Rh催化劑與硫醇發生氧化加成形成Rh-氫化物。與硫醇相比,硒醇的pKa較低(苯硒醇和苯硫酚的pKa 分別為5.9和6.6)和較弱的X?H鍵(分別為 67?74和78 kcal/mol)。眾所周知,硒醇很容易添加到邁克爾受體中,包括 α,β-不飽和酮、乙烯基磺酰胺、硝基烯烴和N-乙烯基內酰胺。雖然之前烯烴也出現了雙官能團化以形成硒化物,但并未考察對映選擇性的情況。2020年,汪君課題組首次考察了雜雙環烯烴的硒化反應,其反應主要通過Rh-催化下不對稱結合二硒化物和氧化膦進行(Fig. 1C)。由此,本文作者提出了Rh催化劑對硒氫鍵進行氧化加成,產生具有硒化物配體的高反應性Rh-氫化物,隨后將烯烴插入Rh-氫化物中,然后經過還原消除,從相對簡單的烯烴轉變為結構新穎的有機硒化物(Fig. 1D)。
圖片來源:J. Am. Chem. Soc.
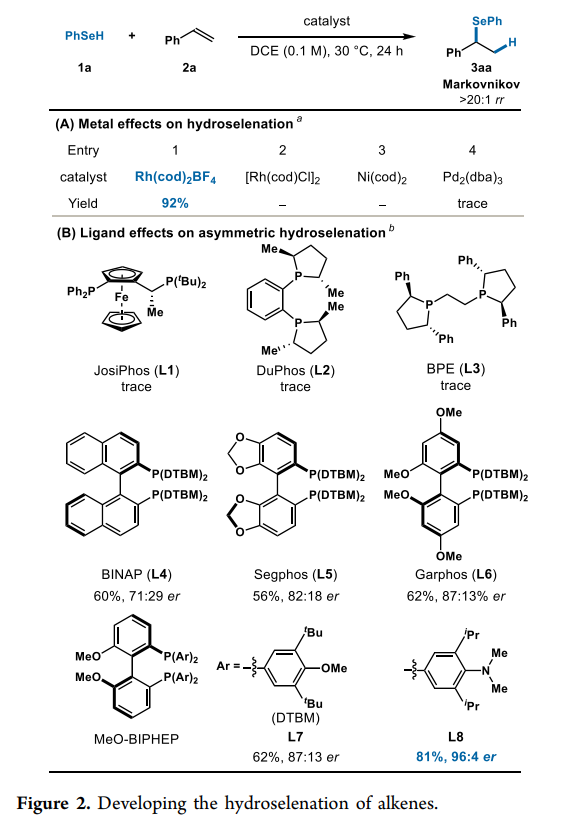
作者基于這種機制,著手確定一種有利于形成手性支鏈異構體(Markovnikov產物)的催化劑。為了開展研究,作者首先選擇了苯硒醇(1a)和苯乙烯(2a)作為模型底物,在作者的氫硫醇化研究中,發現Rh中心相關的平衡離子的選擇在區域選擇性中發揮了重要作用。在此基礎上,作者評估了中性[Rh(cod)Cl]2和陽離子 Rh(cod)2BF4(Fig. 2A)。作者發現Rh(cod)2BF4催化硒醇烯以92%的收率生成所需的Markovnikov異構體,且 rr >20:1(Entry 1)。相比之下,[Rh(cod)Cl]2催化的反應卻未見產物(Entry 2)。作者還考察了其它金屬催化劑,如Ni(cod)2和Pd2(dba)3,也沒有顯示出反應性(Entry 3,4)。作者最終選擇使用Rh(cod)2BF4作為預催化劑,同時進一步研究了苯硒醇(1a)和苯乙烯(2a)與各種手性雙齒膦配體的反應(Fig. 2B)。使用JosiPhos (L1)、DuPhos (L2)和BPE (L3)配體,其3aa產率均為痕量。而使用具有空間位阻龐大的阻轉異構雙膦配體L4-L7,以中等產率(56-62%)和對映選擇性(71:29-87:13 er)生成支鏈硒化物產物。最終,作者發現帶有富電子膦基的MeO-BIPHEP配體L8以81%的產率生成3aa,具有96:4 er和>20:1 rr。
圖片來源:J. Am. Chem. Soc.
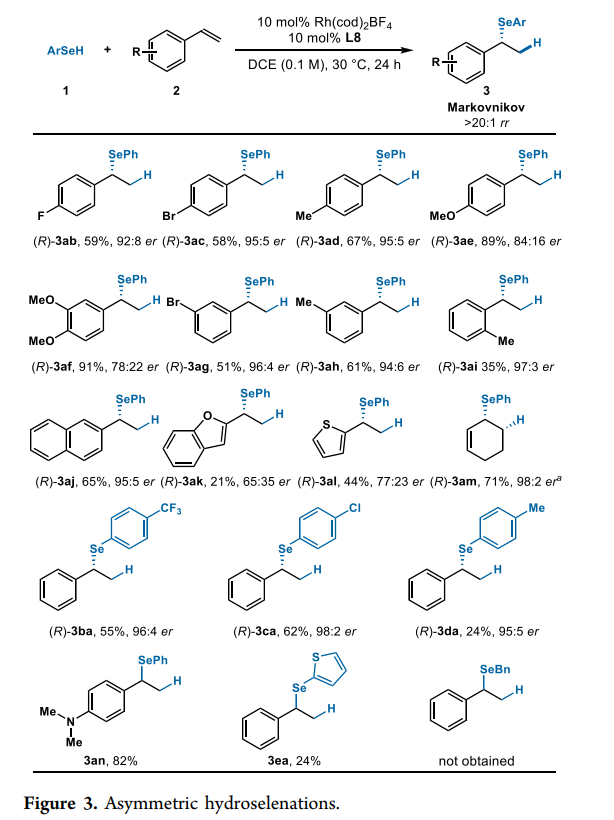
接下來,作者對底物的普適性進行了考察。研究發現烯烴取代基的電性對反應性和對映選擇性有很大影響(Fig. 3)。與富電子烯烴(2d-2f)相比,具有缺電子取代的烯烴(2b, 2c, 2g)表現出更高的對映選擇性但反應性較低。由于空間效應,硒醇與鄰位取代的苯乙烯(2i)的偶聯會使產率(35%)降低,但對映選擇性良好(97:3 er)。雜環苯乙烯也可以進行該反應,但是產率和對映選擇性均有下降((R)-3ak,(R)-3al)。此外,環己二烯的反應可以以高產率(71%)得到手性烯丙基硒化物((R)-3am),并具有良好的對映選擇性(98:2 er)。3aa和3am的絕對構型是根據文獻中報道的旋光度推定的。作者還研究了幾種其它硒醇與苯乙烯2a的反應,結果為硒醇苯環上的取代基對對映選擇性和區域選擇性的影響可以忽略不計。在所有例子中,作者均觀察到具有高對映選擇性(95:5 er-98:2 er)的Markovnikov產物。不僅如此,與具有給電子基團的硒醇(1d)相比,苯環上具有吸電子基團的硒醇(1b, 1c)顯示出更高的反應性。盡管苯胺取代的烯烴2n表現出較高的反應性,以82%的收率得到3an,但沒有觀察到催化劑的不對稱誘導。同樣,雜環硒醇也在手性條件下起作用,并以>20:1 rr 的24%產率得到外消旋產物3ea。而烷基硒醇在相同條件下沒有表現出反應性。總的來說,突出顯示的示例代表了苯乙烯的首次不對稱氫化硒化。
圖片來源:J. Am. Chem. Soc.
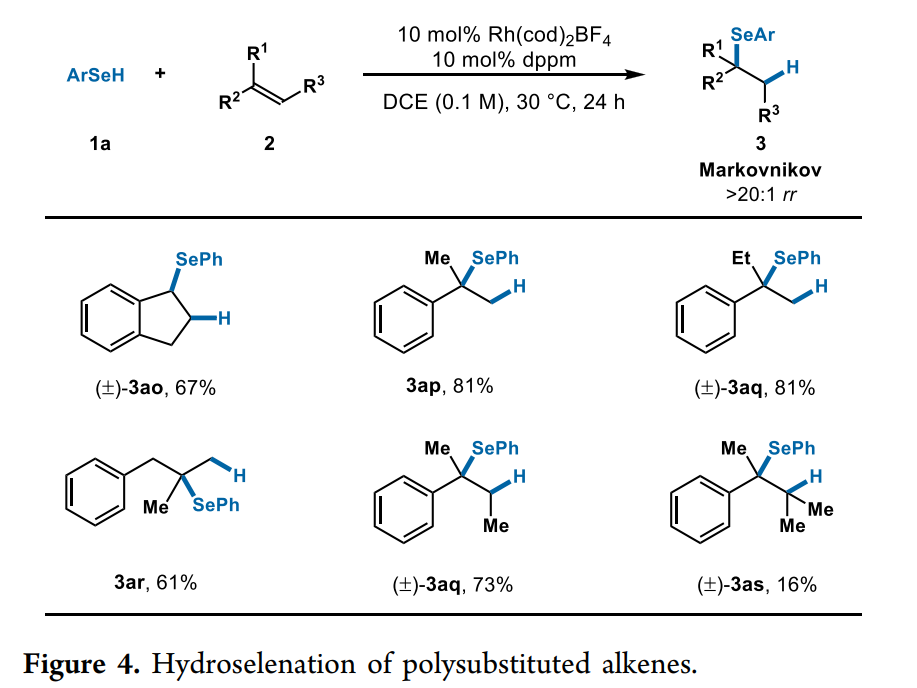
對于一些其它多取代烯烴,作者也進行了考察。如茚、α-甲基和乙基苯乙烯以及 2-甲基-3-苯基-1-丙烯,帶有手性配體L1-L8的Rh催化劑沒有顯示出反應性, 然而,使用雙二苯基膦甲烷配體,則具有一定的反應性(Fig. 4)。苯硒醇(1a)與茚(2o) 的偶聯得到硒化物(3ao),產率為 67%。1,1-二取代烯烴的氫化硒化以中等至高產率(61-81%產率)和優異的區域選擇性(>20:1 rr)得到相應的叔硒化物(3ap-3ar)。三取代和四取代烯烴以73%和16%的產率進行硒化反應生成相應的硒化物產物(3aq和3as)。用這種非手性配體觀察到的反應性對于該反應未來的發展是也是令人鼓舞的。
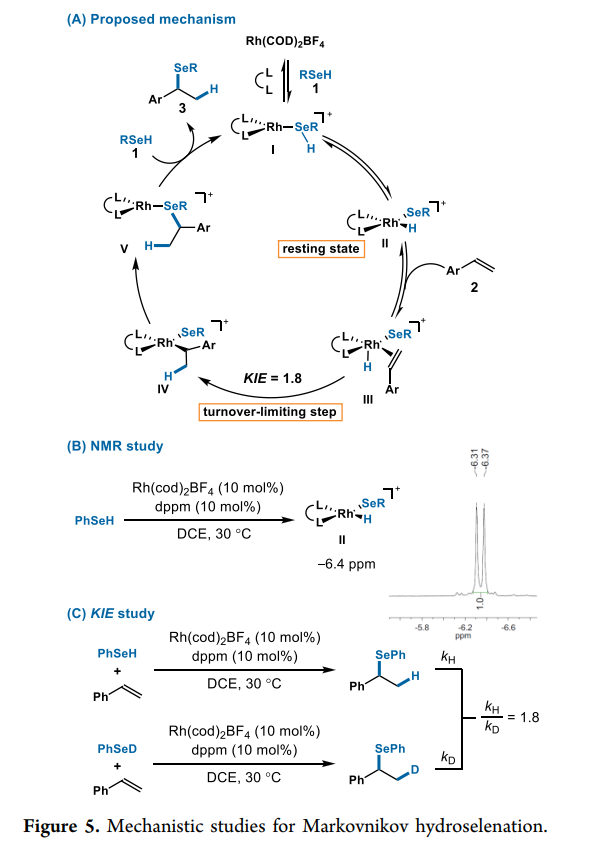
圖片來源:J. Am. Chem. Soc.
作者還提出了該反應可能的機理(Fig. 5A)。在作者之前關于氫硫醇化的研究中,其觀察到Rh(I)催化劑可以對S-H鍵進行氧化加成以生成Rh-氫化物。在本研究中,作者觀察到硒醇1與Rh-配合物I的氧化加成得到Rh-H II,NMR研究進一步證實了該催化循環。在室溫條件下,混合的苯硒醇 (1a)、Rh(cod)2BF4 (10 mol %)和雙二苯基膦甲烷(10 mol %)在DCE-d4中不到10分鐘, NMR譜中出現-6.4 ppm(d, J = 34 Hz)(Fig. 5B),推測形成中間體II,作者假設中間體II的烯烴配位形成III,然后將烯烴遷移插入Rh-H鍵形成中間體IV。基于文獻,因為過渡態的空間相互作用,Rh-H插入很可能決定了分支選擇性。通過兩個平行的初始速率研究,作者確定了一個初步KIE (kH/kD= 1.8,Fig. 5C),這與Rh-H插入是限速步驟的結論是一致的。由于觀察到氫化物(II)的穩定狀態,作者排除了氧化加成作為限速步驟的可能性。當使用氘代硒醇時,作者并沒有觀察到在苯乙烯中摻入氘,這進一步支持了烯烴遷移插入Rh-H是限速步驟。最后,作者推測中間體IV 經還原消除得到中間體V,然后分解產物3和再生Rh催化劑I, 完成循環。
總結 加州大學爾灣分校Vy M. Dong課題組與北京理工大學楊小會課題組提供了一種將烯烴轉化為有機硒化合物的合成方法。通過使用Rh-催化,首次實現了苯乙烯與硒醇的對映選擇性氫化。這項研究為未來使用硫族親核試劑對烯烴進行功能化提供了指導。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn