

(圖片來源:J. Am. Chem. Soc.)
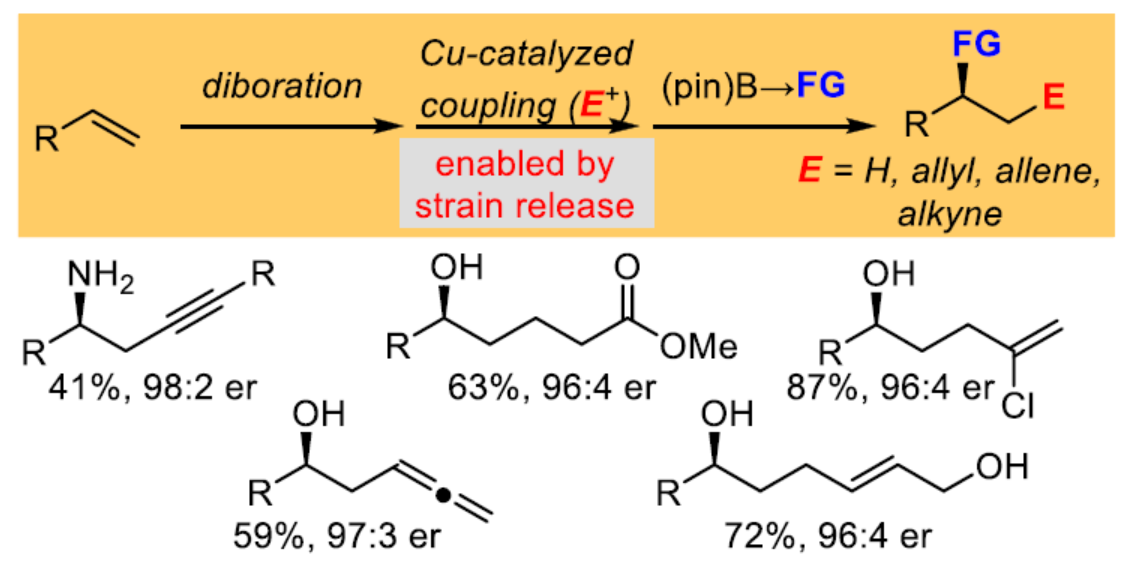
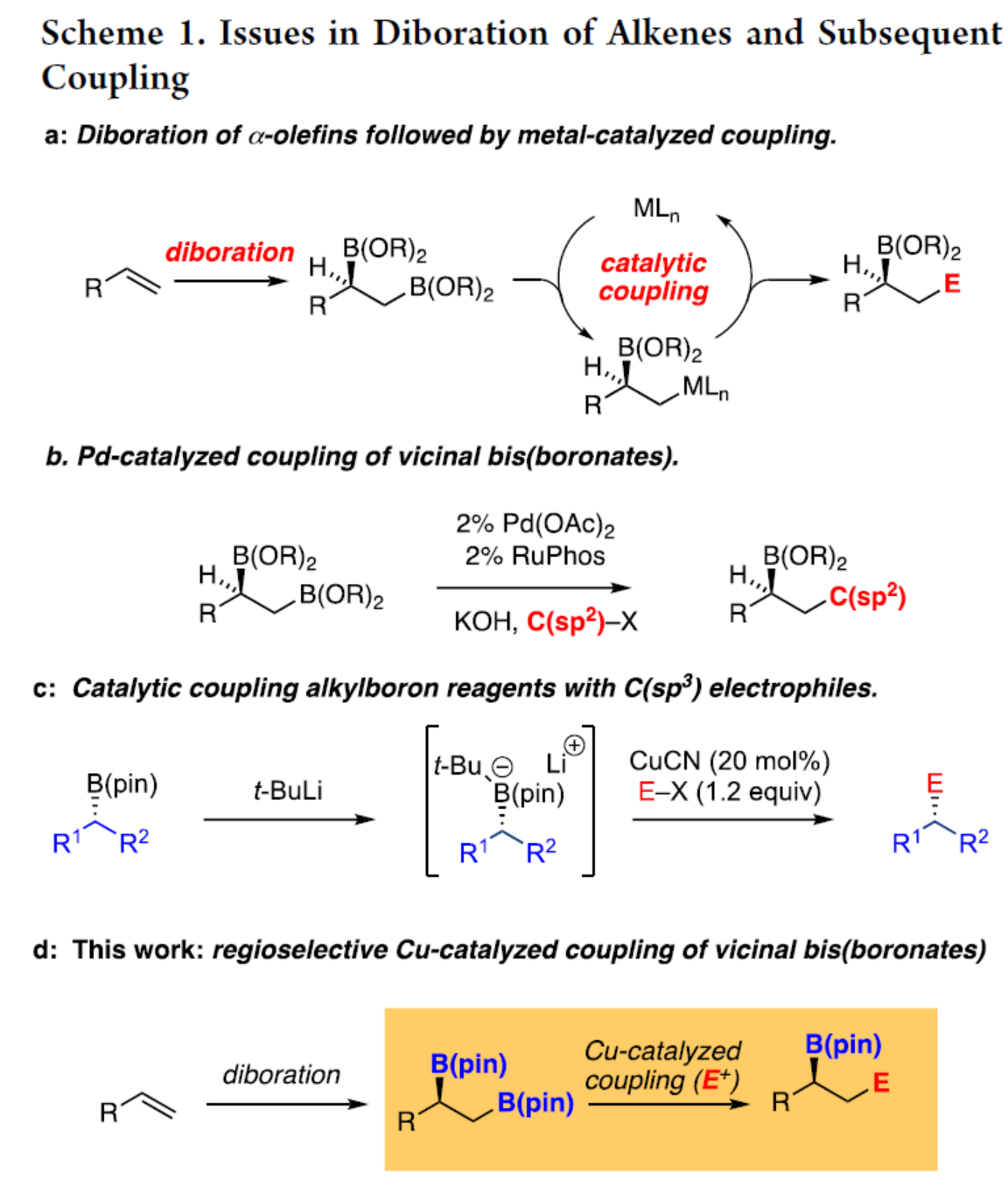
非活化烯烴的催化對映選擇性雙官能團化反應是當代有機合成中的一個具有挑戰的課題。其中,催化不對稱烯烴的雙硼化反應以及隨后對鄰位雙金屬中間體進行后續轉化是解決這一挑戰的一種策略(Scheme 1a)。例如,通過對鄰位二硼中間體進行區域選擇性鈀催化Suzuki-Miyaura偶聯或基于類卡賓的同系化,可完成碳鏈的延伸,剩余的二級硼酸酯可單獨進行相應的轉化(Scheme 1b)。然而,該策略僅限于C(sp2)親電試劑。為了使烷基親電試劑參與Suzuki-Miyaura反應,化學家們已開發了各種鈀、銅、鎳和鐵催化劑。然而,這些方法通常需要三烷基硼烷衍生物來進行反應。雖然銅催化體系可擴展到烷基硼酸酯,但直到最近,該過程同樣僅限于C(sp2)親電試劑。最近,Morken課題組報道了一種銅催化烷基硼酸酯與一系列非C(sp2)親電試劑之間的偶聯反應,其中烷基硼酸酯需使用叔丁基鋰進行活化(Scheme 1c)。近日,Morken課題組報道了一種使用簡單的醇鹽活化,1,2-雙(硼酸酯)在銅催化反應中表現出顯著的反應性,可與碳基親電試劑進行區域選擇性偶聯(Scheme 1d)。
(圖片來源:J. Am. Chem. Soc.)
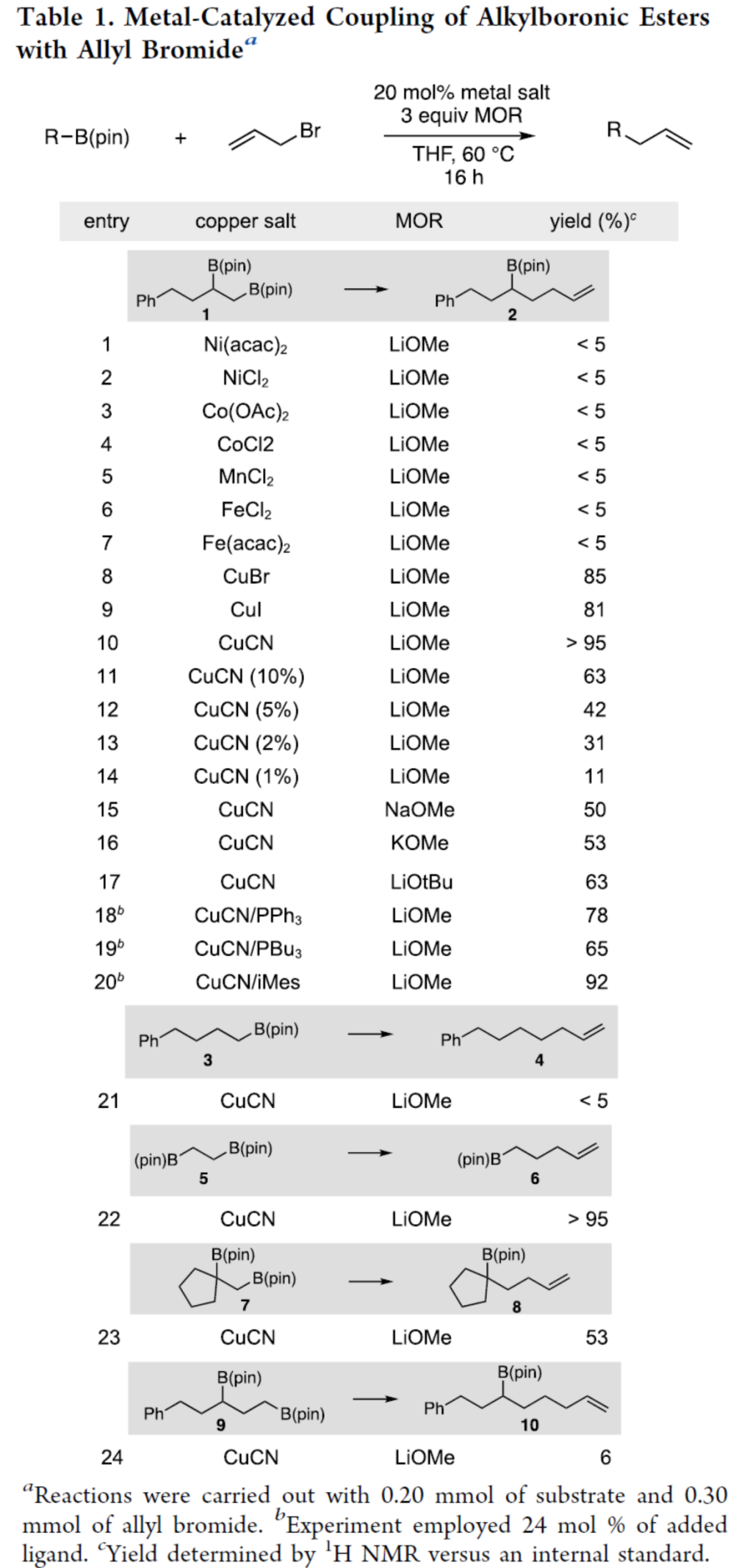
首先,作者以1,2-雙(硼酸酯)衍生物1與烯丙基溴作為模型底物,進行了相關偶聯反應條件的篩選(Table 1)。當以CuCN作為催化劑,LiOCH3作為活化劑,在THF溶劑中60 oC反應16 h,可以>95%的收率得到產物2。同時,在上述最佳條件下,僅有鄰位二硼酸酯底物(5和7)能夠順利進行反應。
(圖片來源:J. Am. Chem. Soc.)
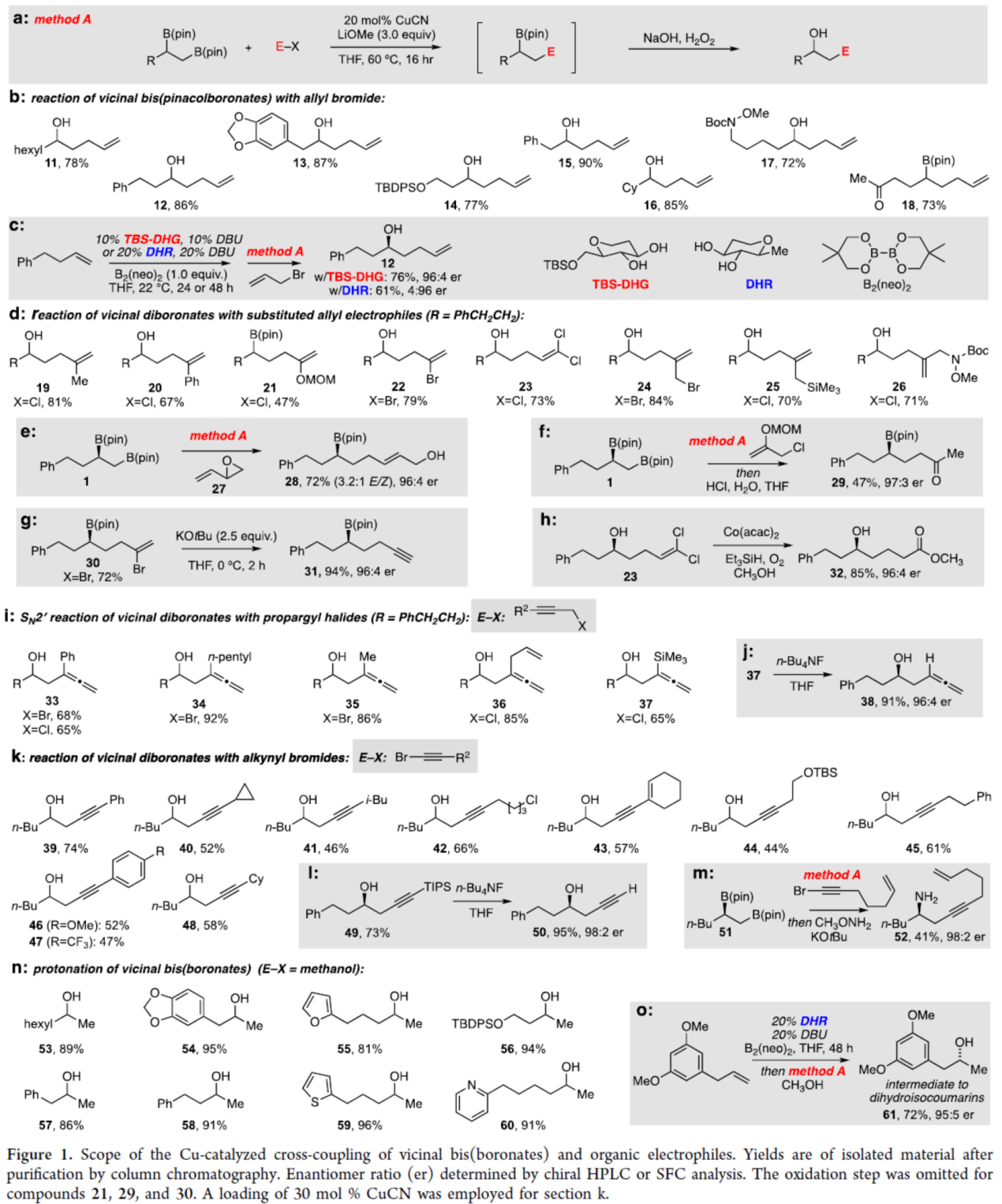
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Figure 1)。首先,一系列不同取代的鄰位二硼酸酯底物,均可與烯丙基溴順利反應,獲得相應的產物11-18,收率為72-87%(Figure 1b)。同時,若將對映選擇性雙硼化與銅催化偶聯反應相結合,可分別以76%與61%的收率獲得手性醇產物12,是一對對映異構體(Figure 1c)。其次,一系列官能團化的烯丙基親電試劑,均為合適的底物,如19-26,收率為47-84%(Figure 1d)。乙烯基環氧化物27也是一種有效的親電試劑,可以72%的收率得到產物28,且對映體純度保持不變(Figure 1e)。同時,通過該策略還可合成手性γ-硼基羰基化合物29(Figure 1f)、含有末端炔基的手性硼基化合物31(Figure 1g)與含有烷氧羰基的手性醇化合物32(Figure 1h)。取代的一級炔丙基鹵化物以SN2'方式進行交叉偶聯,以良好的收率獲得取代的聯烯產物33-37(Figure 1i)。其中,聯烯產物37中的硅基在n-Bu4NF/THF條件下很容易去除,獲得高聯烯醇產物38,這是其它方法不易制備的(Figure 1j)。炔基溴化物也可與鄰位雙(硼酸酯)進行偶聯反應,以良好的收率得到高炔丙基醇產物39-48(Figure 1k)。值得注意的是,簡單的末端炔烴衍生物50很容易通過49的有效脫硅基化獲得(Figure 1l)。同時,偶聯產物中的硼基還可進行立體專一性胺化反應,獲得高炔丙基胺產物52(Figure 1m)。此外,當使用甲醇作為親電試劑時,反應同樣可順利進行,獲得相應的產物53-60,這是其它方法不易實現的(Figure 1n)。此外,通過雙硼化/質子化的串聯過程,可以良好的收率以及選擇性得到化合物61,這是幾種二氫異香豆素天然產物合成的中間體(Figure 1o)。
(圖片來源:J. Am. Chem. Soc.)
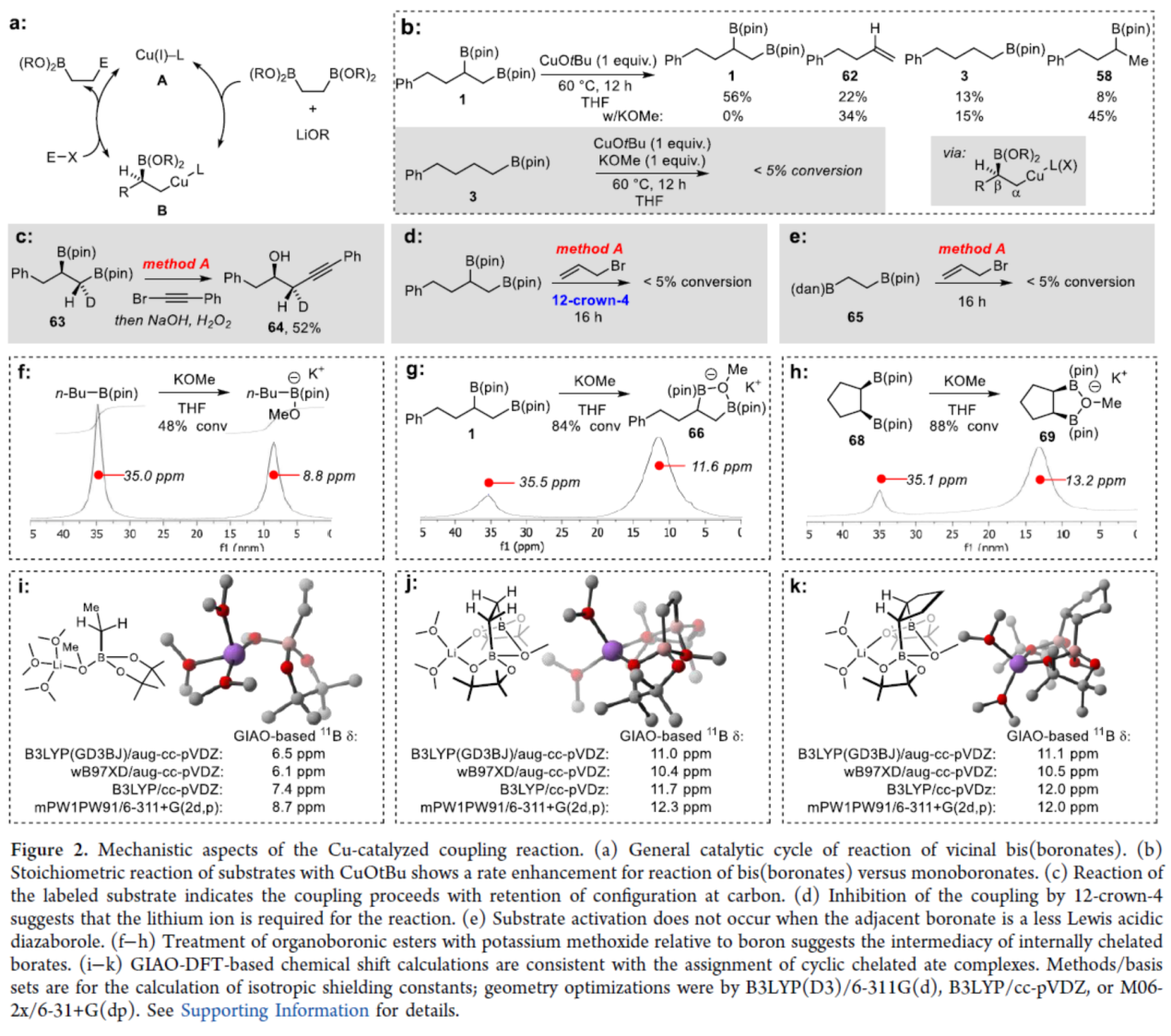
緊接著,作者還對反應機理進行了進一步的研究(Figure 2)。首先,作者提出了鄰位雙(硼酸酯)反應的一般催化循環過程(Figure 2a)。其中,轉金屬化可能直接與CuCN、Cu(I)醇鹽、烷氧基衍生的銅酸鹽或相關的Cu(I)鹽(A)反應,以在親電阱之前得到中間體B,從而釋放銅鹽和目標產物。為了進一步了解轉金屬化反應的性質,作者進行了一系列實驗研究。通過底物與CuOtBu的化學計量反應表明,CuOtBu可加速雙(硼酸酯)1到單硼酸酯58的轉化,涉及中間體B的形成。同時,單硼酸酯3在與CuOtBu和KOMe進行化學計量反應時,未能進行,從而表明鄰位硼酸酯基團的活化作用(Figure 2b)。其次,氘標記實驗表明,一級硼酸酯反應在碳中心的構型保持不變的情況下進行,可能是通過立體保留的轉金屬化過程(Figure 2c),鄰位硼酸酯對轉金屬化的活化作用可能由許多不同的機理引起。同時,12-crown-4 (一種鋰清除劑)對偶聯反應具有抑制性,從而表明反應需要鋰離子(Figure 2d)。當相鄰的硼酸酯是弱Lewis酸性二氮雜硼烷時,底物不會發生活化(Figure 2e)。上述實驗表明,底物活化的機理可能涉及兩個硼酸酯基團在與金屬醇鹽鍵合時的協同作用。因此,作者通過11B NMR譜研究了醇鹽與幾種有機硼化合物的配位(Figures 2f-2h)。研究表明,反應涉及底物中兩個硼原子的鍵合模式。此外,基于GIAO-DFT的化學位移計算與環狀螯合配合物的分配一致(Figures 2i-2j)。
(圖片來源:J. Am. Chem. Soc.)
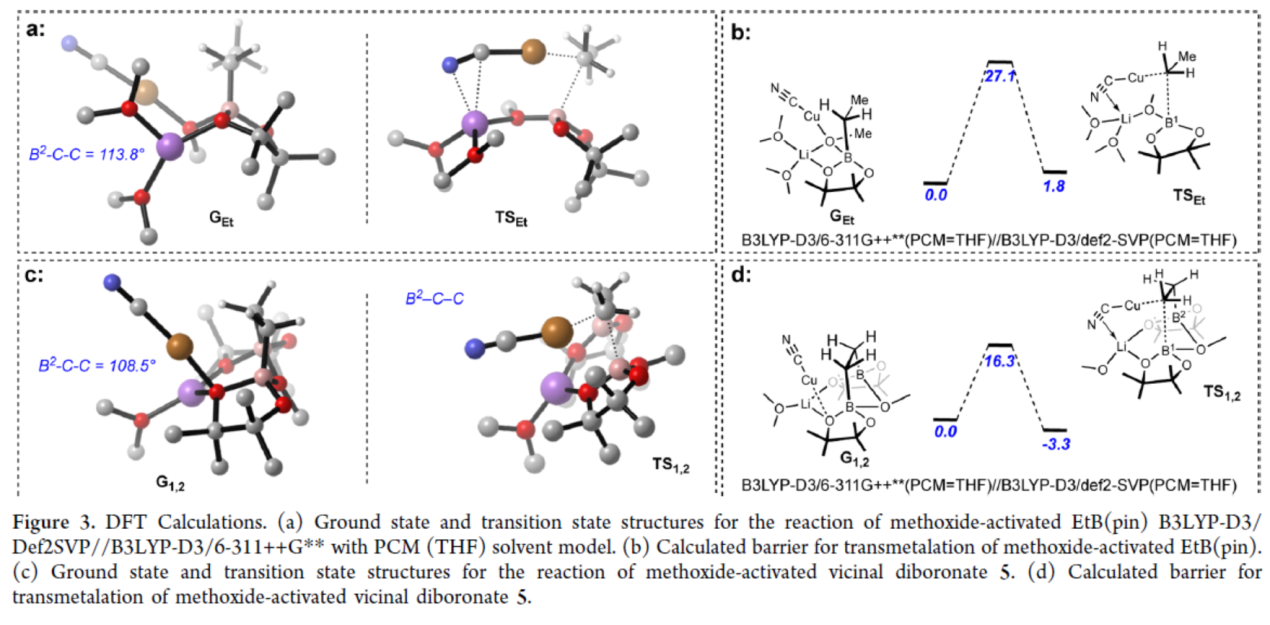
為了進一步了解1,2-二硼酸酯反應性增強的原因,作者進行了相關的DFT計算研究,以比較反應性1,2-二硼酸酯與反應性較低的單硼酸酯(Figure 3)。
(圖片來源:J. Am. Chem. Soc.)
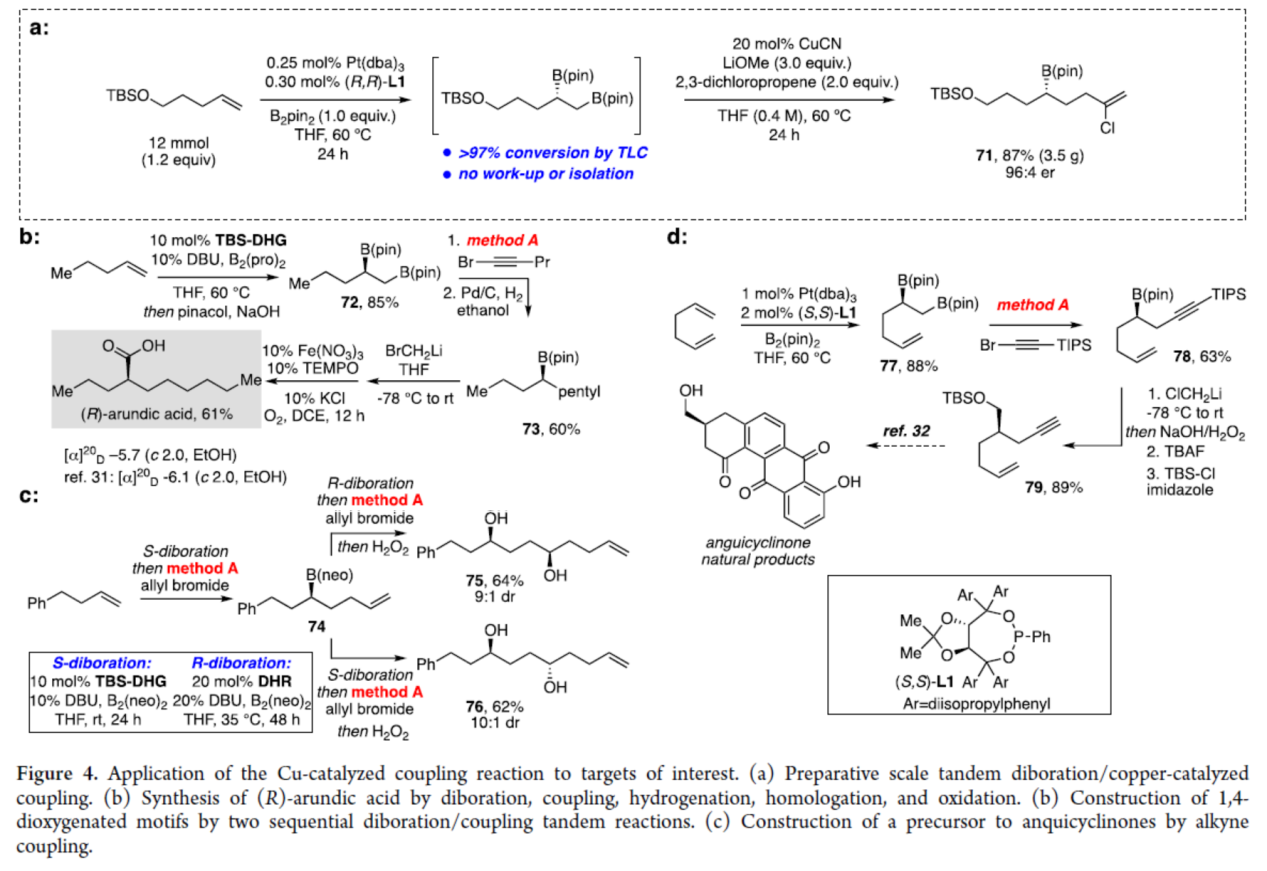
最后,作者對反應的實用性進行了研究(Figure 4)。首先,克級規模實驗(串聯雙硼化與銅催化偶聯反應),可以87%的收率得到手性硼化合物71,er為96:4(Figure 4a)。其次,通過兩步法可以52%的總收率得到細胞活化抑制劑(R)-arundic acid(ONO-2506),涉及雙硼化、偶聯、氫化、同系化和氧化反應的過程(Figure 4b)。同時,通過兩個連續的雙硼化/偶聯串聯反應,可以立體選擇性的方式構建手性1,4-二醇衍生物75和76,為一對非對映異構體(Figure 4c)。此外,通過不對稱雙硼化、銅催化偶聯以及同系化/保護三步反應還可合成化合物 79,這是合成anquicyclinones的前體(Figure 4d)。
(圖片來源:J. Am. Chem. Soc.)
總結
美國波士頓學院James P. Morken課題組報道了一種鄰位二硼酸酯參與銅催化偶聯反應的全新策略,可實現簡單的烯烴前體直接合成具有價值的手性有機硼酸酯。同時,該策略具有反應條件簡單、底物范圍廣泛、官能團兼容性高等特點。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn