- 首頁
- 資訊
JACS:Aza-Heck-引發C(sp3)-H鍵的官能團化串聯反應
來源:化學加原創 2022-10-03
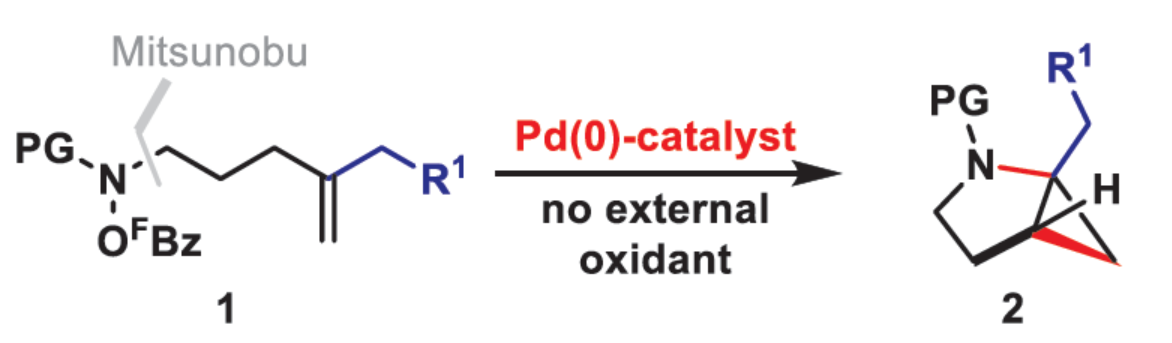
導讀:近日,英國利物浦大學John F. Bower課題組報道了一種基于aza-Heck的 C(sp3)-H鍵的官能團化串聯反應。其中,在Pd(0)催化下,N-(五氟苯甲酰氧基)氨基甲酸酯的aza-Heck型環化可生成烷基-Pd(II)中間體,該中間體在生成環丙烷產物過程中影響C(sp3)-H鍵的鈀化過程。此外,作者還闡明了控制環丙烷化過程中位點選擇性的關鍵因素,從而實現了環-或螺-稠合體系的構建。
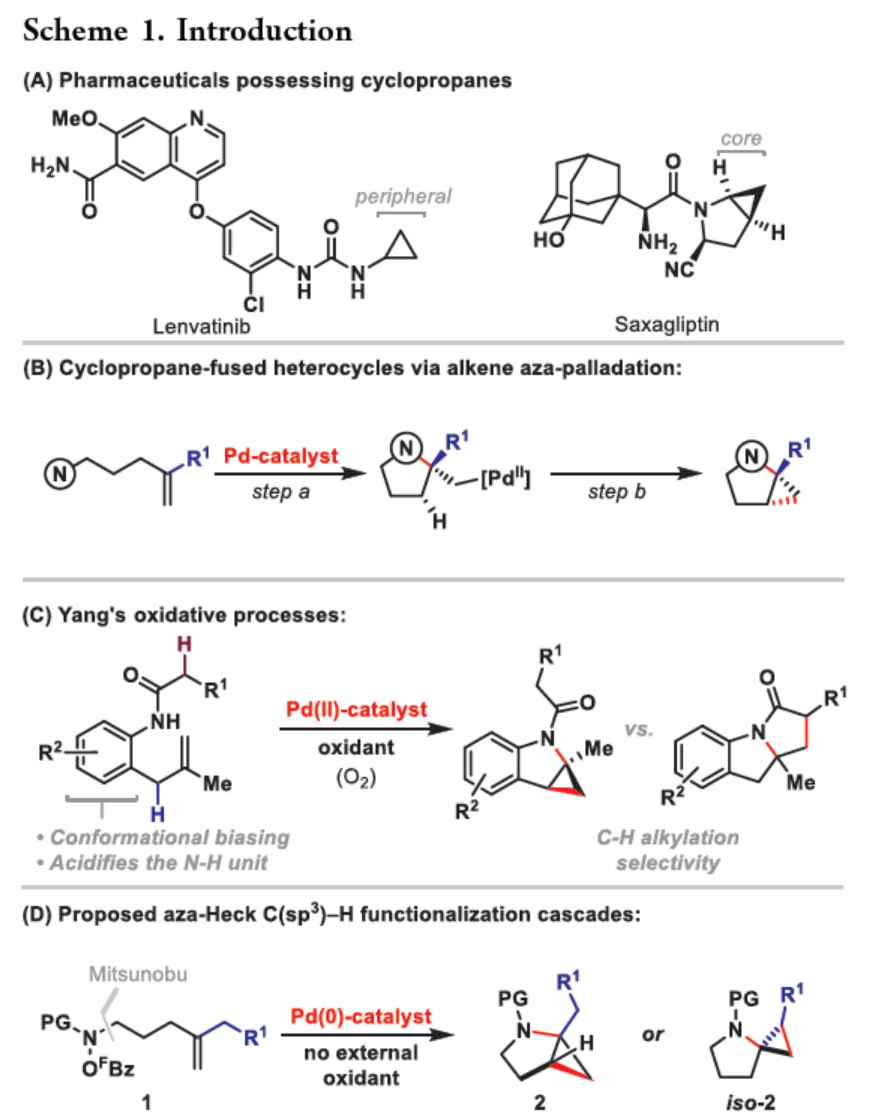
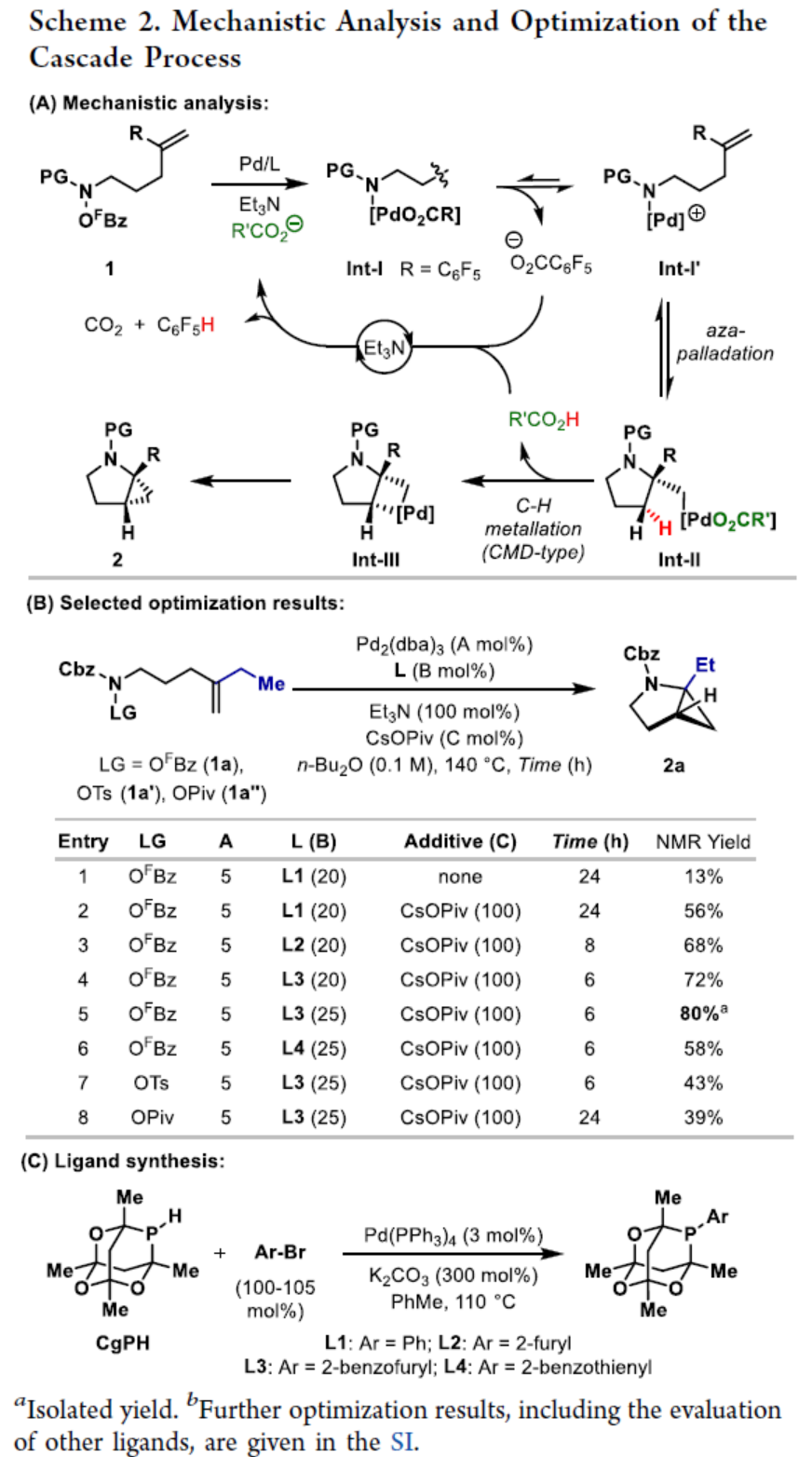
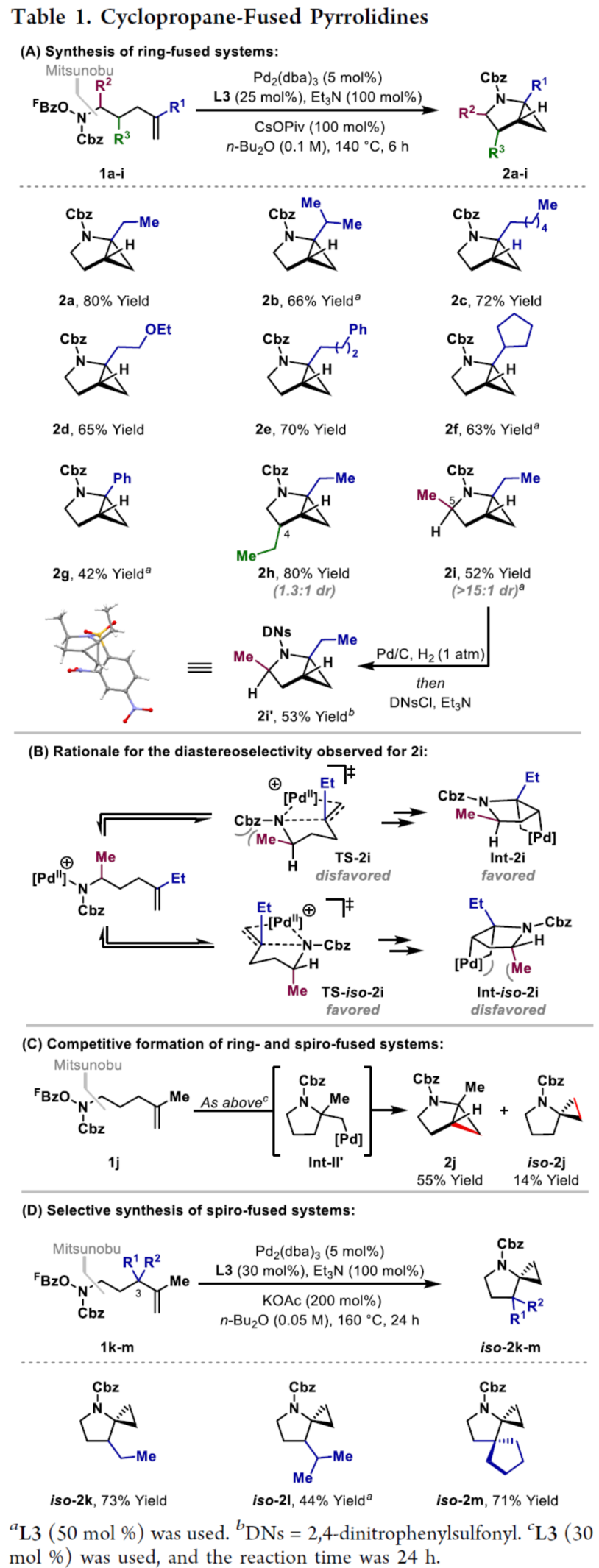
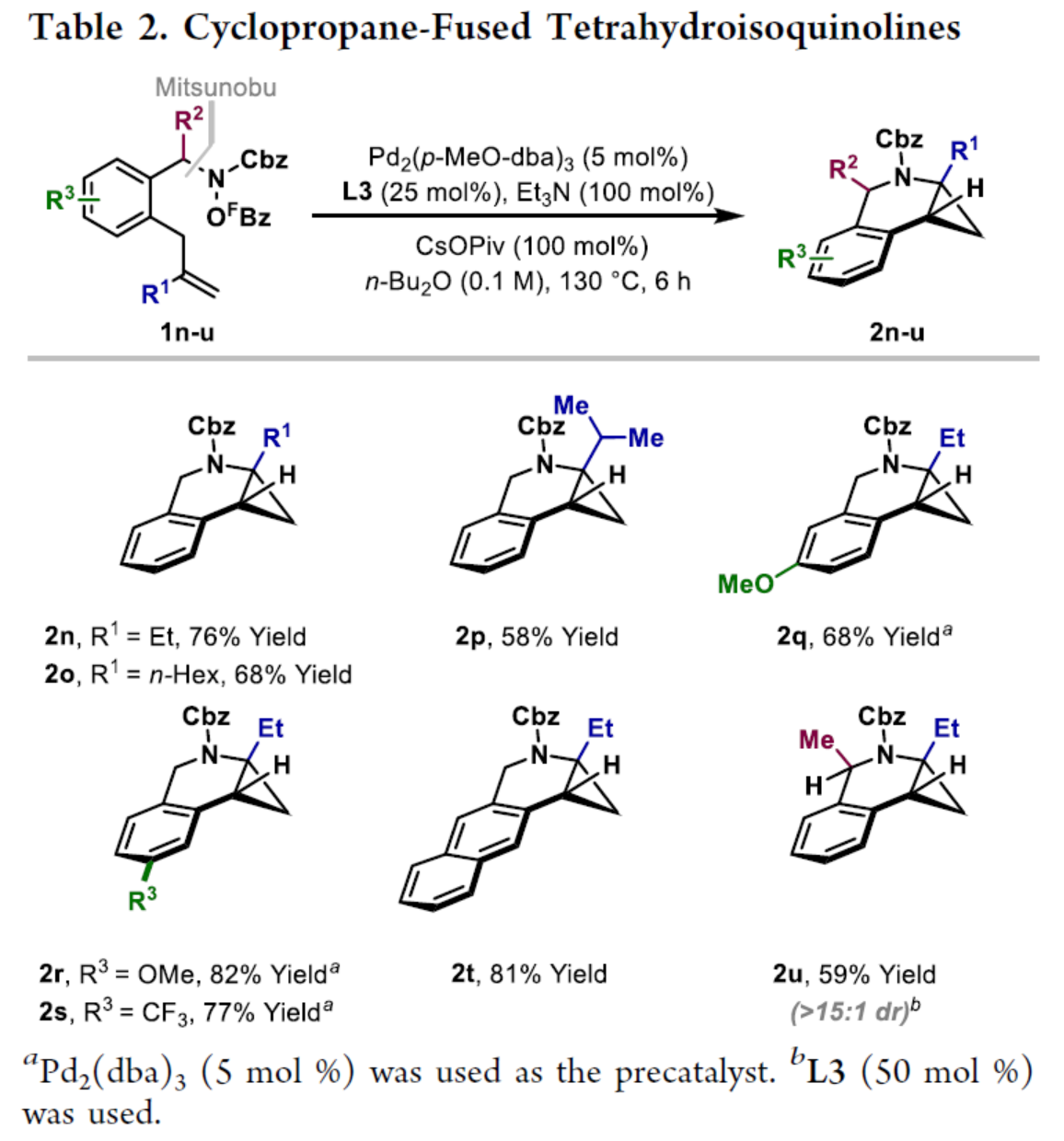
環丙烷單元通常用于藥物設計以緩和化合物的親脂性或N-中心的堿度。同時,外圍環丙烷單元出現在許多已上市藥物中,而母核環丙烷單元較少遇到(Scheme 1A)。例如,DPP-4抑制劑沙格列汀具有環丙烷稠合的吡咯烷骨架。目前,化學家們開發了一種烯烴的氮雜-鈀化用于構建環丙烷稠合的雜環化合物,即在C-H鈀化引發環丙烷化(step b)之前,烯烴首先進行分子內的氮雜-鈀化(step a)(Scheme 1B)。2015年,楊丹課題組開發了一種鈀催化氧化的條件,實現了環丙烷稠合吡咯烷的合成(Scheme 1C)。然而,此類反應存在一定的限制,如在step a中需一個構象偏差(conformationally biasing)和酸化的苯胺單元,從而不適合六環環化,而在step b中的存在底物范圍以及選擇性有限。作者發現,使用N-O鍵代替外部氧化劑(如O2)可顯著提高基于烯烴氮雜鈀化工藝的效率。在該方法中,N-O氧化加成是底物結合和催化劑氧化的關鍵過程。同時,非氧化條件還意味著高度可調的P-基配體可用于調節鈀中心的性質。事實上,這種基于aza-Heck的方法可擴大非構象偏差環化和串聯的范圍,涉及空間和電子多樣化的烯烴。此類反應包括不對稱aza-Heck環化和涉及芳基C(sp2)-H鈀化的串聯反應。近日,英國利物浦大學John F. Bower課題組報道了一種基于aza-Heck引發的環丙烷化過程,涉及C(sp3)-H鍵的鈀化步驟(Scheme 1D)。值得注意的是,這是C(sp3)-H鍵官能團化串聯的第一個例子,涉及使用含有N-O單元的底物。同時,該策略具有如下特點:(a)具有空間位阻的烯烴均可有效的反應。(b)在無構象偏差和酸化苯胺單元的情況下可有效進行5-exo環化或6-exo環化。(c)無需目標C(sp3)-H鍵的芐基活化。此外,通過控制反應的空間以及電子性質,可增強環丙烷化反應的區域選擇性,從而合成了一系列環-或螺-稠合化合物。首先,作者提出了一種合理的反應機理(Scheme 2A)。1中N-O鍵的氧化加成可生成aza-Pd(II)中間體Int-I。前期的工作表明,有效的烯烴氮雜鈀化需要五氟苯甲酸甲酯從Int-I解離以得到Int-I'。Int-I'經環化和羧酸鹽締合生成烷基-Pd(II)中間體Int-II,它可通過協同的金屬化/去質子化型(concerted metalation deprotonation-type)金屬化生成鈀環丁烷Int-III。Int-III經還原消除后,可獲得目標環丙烷產物2。在環丙烷化過程中釋放的羧酸預計會被三乙胺去質子化,生成的三乙銨鹽將引發五氟苯甲酸酯的簡單脫羧反應以釋放C6F5H。前期的研究表明,烯烴氮雜鈀化在陽離子條件下是可逆的,因此該過程的成功可能取決于羧酸鹽介導的 C(sp3)-H鍵金屬化步驟的效率(Int-II到Int-III)。因此,可能需要外部羧酸鹽添加劑(R'CO2M),因為在N-O氧化加成過程中釋放的五氟苯甲酸鹽具有高度離解性和相對較弱的堿。因此,最佳機理方案需要用于氮雜鈀化(Int-I')的陽離子配合物和用于C(sp3)-H鍵金屬化(Int-II)的中性中間體。緊接著,作者對反應條件進行了篩選(Scheme 2B)。當以1a作為底物,Pd2(dba)3作為催化劑,L3作為配體,Et3N作為堿,CsOPiv作為添加劑,在n-Bu2O溶劑中140 oC反應6 h,可以80%的收率得到產物2a。同時,作者還對相關配體的合成進行了研究(Scheme 2C)。在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Table 1A)。研究表明,當底物1中的R1為各種烷基或芳基時,均可順利進行反應,獲得相應的產物2a-2g,收率為42-80%。當底物1中的R3為乙基或R2為甲基時,反應也與體系兼容,獲得相應的產物2h-2i,收率為52-80%。其中,2i經進一步的脫保護后,可與DNsCl反應,可以53%的收率得到N-DNs衍生物2i'。同時,2i'的單晶X-射線衍射表征揭示了甲基和乙基取代基之間的syn-relationship。該結果與可逆的烯烴氮雜鈀化步驟一致,因為生成的鈀環丁烷Int-2i是通過不利的環化模式 (TS-2i)形成的(Table 1B)。當以1j為底物時,可以55%的收率得到預期的產物2j以及以14%的收率得到螺稠環丙烷產物iso-2j(Table 1C)。后者的形成可能是由Int-II'的空間上更易接近的甲基的C(sp3)-H鍵金屬化促進的。因此,作者對選擇性合成螺稠合的體系進行了研究(Table 1D)。通過反應條件的優化后,可獲得一系列螺稠合產物iso-2k-2m,收率為44-73%。同時,作者發現,當以Pd2(p-MeO-dba)3作為催化劑時,在R1、R2或R3處具有不同取代基的底物1n-1u,均可順利進行反應,獲得相應的環丙烷稠合的四氫異喹啉產物2n-2u,收率為58-82%(Table 2)。此外,當以3a作為底物可合成哌啶化合物4a,涉及初始(非構象偏差)5-exo aza-鈀化的過程(Table 3A)。在該過程中,可生成Int-II”,其中可以選擇進行三種不同的C(sp3)-H鍵進行金屬化,形成四元或六元鈀環。在反應過程中,通過C3-位的金屬化,涉及供體-受體環丙烷中間體Int-IV,經熱促進開環可生成哌啶化合物4a。因此,重排過程將3a中的亞甲基CH2單元轉移到目標的C3-位。為了進一步提高反應的效率,作者進行了相關條件的優化研究(Table 3B)。在R1、R2或R3處具有不同取代基的底物3a-3g,均可有效的反應,獲得相應的烯烴區域異構體的混合物4a-4g。迄今為止,使用內部(4d)或外部π-不飽和物(例如活化酮)在環加成過程中攔截供體-受體環丙烷中間體(Int-IV)的嘗試均未成功。英國利物浦大學John F. Bower課題組報道了首例aza-Heck引發的C(sp3)-H官能團化串聯反應,合成了一系列環-或螺環-稠合的環丙烷衍生物。為了實現該過程,作者設計和評估了一系列新型P-配體,其中L3是最佳的配體。此外,作者還闡明了如何使用空間位阻或電性控制來主導C(sp3)-H鍵金屬化的選擇性。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn