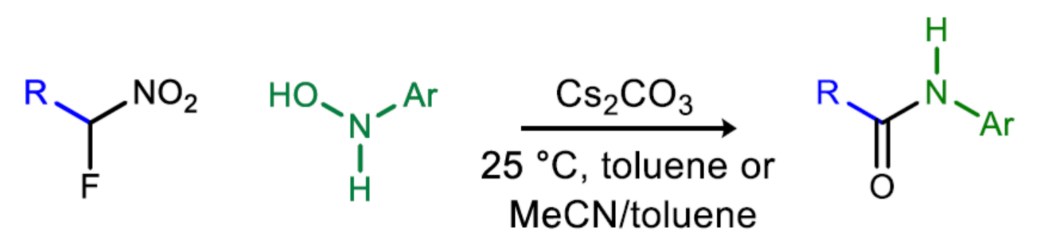
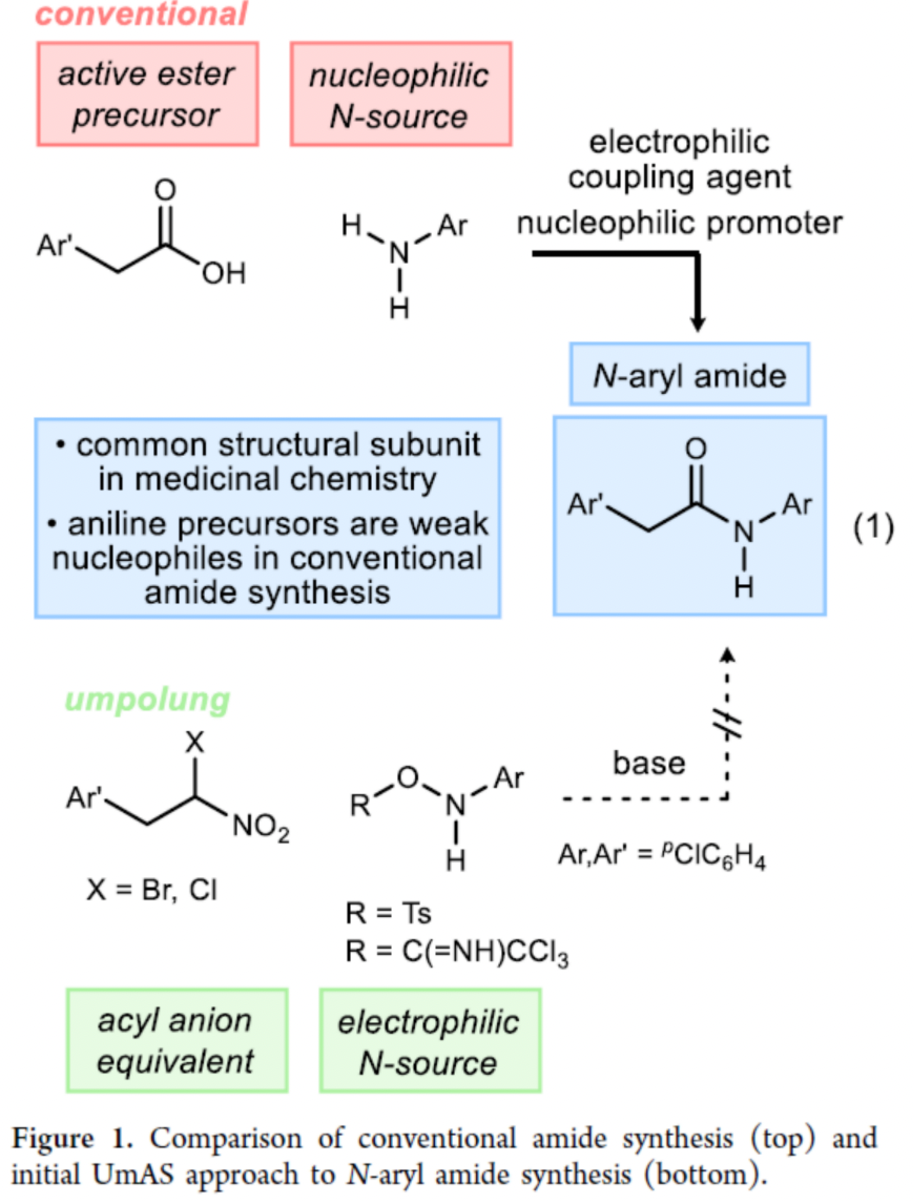
酰胺的合成是應用最為廣泛的有機反應之一。然而,目前用于酰胺合成的策略在經濟上是不可持續的,并且它們越來越多地與健康危害相關,包括人類對偶聯試劑的過敏反應。在外部安全措施下,降低使用偶聯劑和親核促進劑風險的研究規模下,制備α-手性酰胺的總體策略不僅步驟密集,而且容易發生差向異構化。目前,極性反轉酰胺合成(UmAS)策略是一種可以緩解此類問題的有效方法,同時也是一種使用完全催化、對映選擇性策略制備復雜酰胺的方法。然而,一個關鍵的限制是芳胺(苯胺)在UmAS中一直不成功。作者發現,N-芳基羥基胺是UmAS中合適的受體,可解決上述的問題,從而直接合成N-芳基酰胺。受近期使用活化羥胺作為親電氮源報道的啟發,作者開始研究了α-鹵代硝基親核試劑與N-芳基羥胺及其活化衍生物的反應性(Figure 1)。
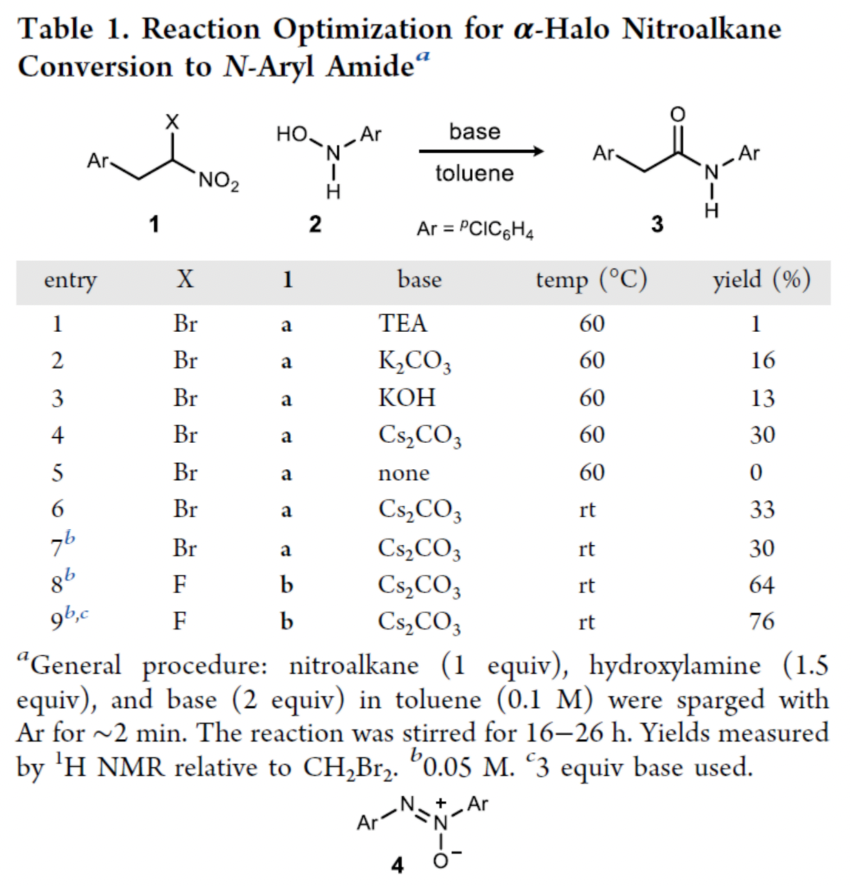
首先,作者以α-鹵代硝基烷烴1與N-芳基羥胺2作為模型底物,進行了相關反應條件的篩選(Table 1)。當以α-氟代硝基烷烴為底物,Cs2CO3作為堿,在甲苯溶劑中室溫反應,可以76%的收率得到N-芳基酰胺產物3。
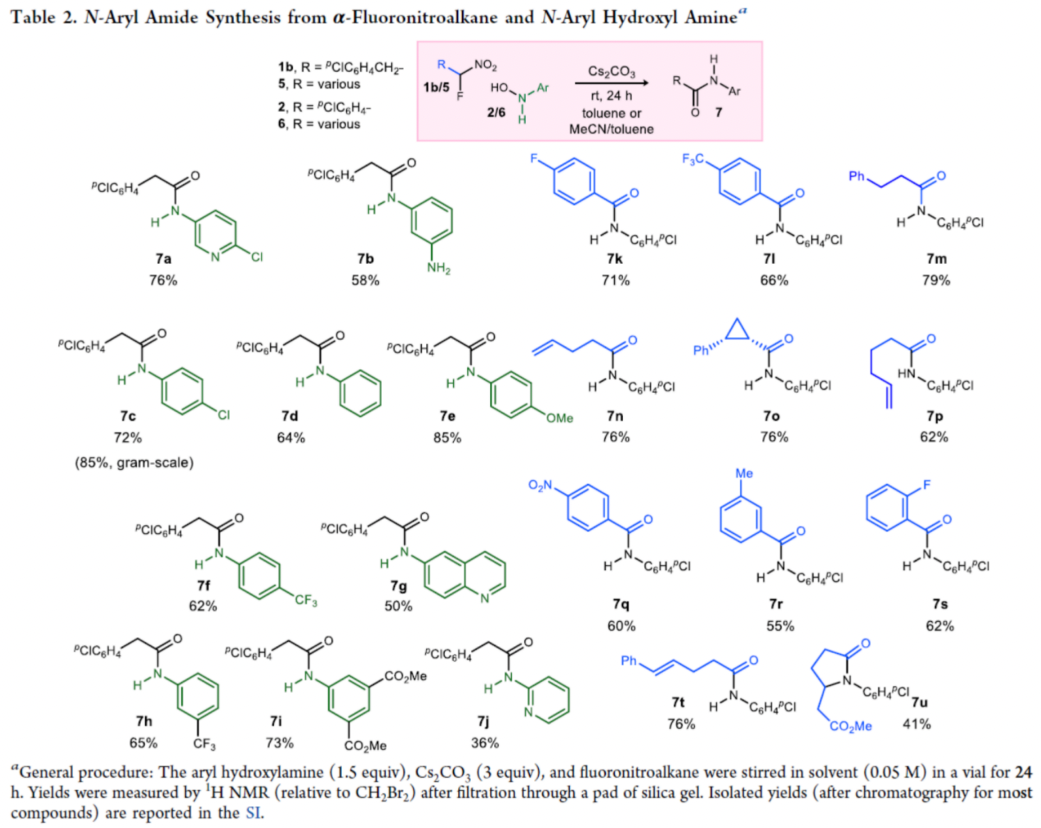
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Table 2)。首先,芳基上含有各種不同電性的N-芳基羥胺以及N-吡啶羥胺,均可與α-氟代硝基烷烴順利反應,獲得相應的產物7a-7j,收率為36-85%。其次,當α-氟代硝基底物的R為不同取代的芳基和烷基時,均可與N-芳基羥胺順利反應,獲得相應的產物7k-7u,收率為41-79%。
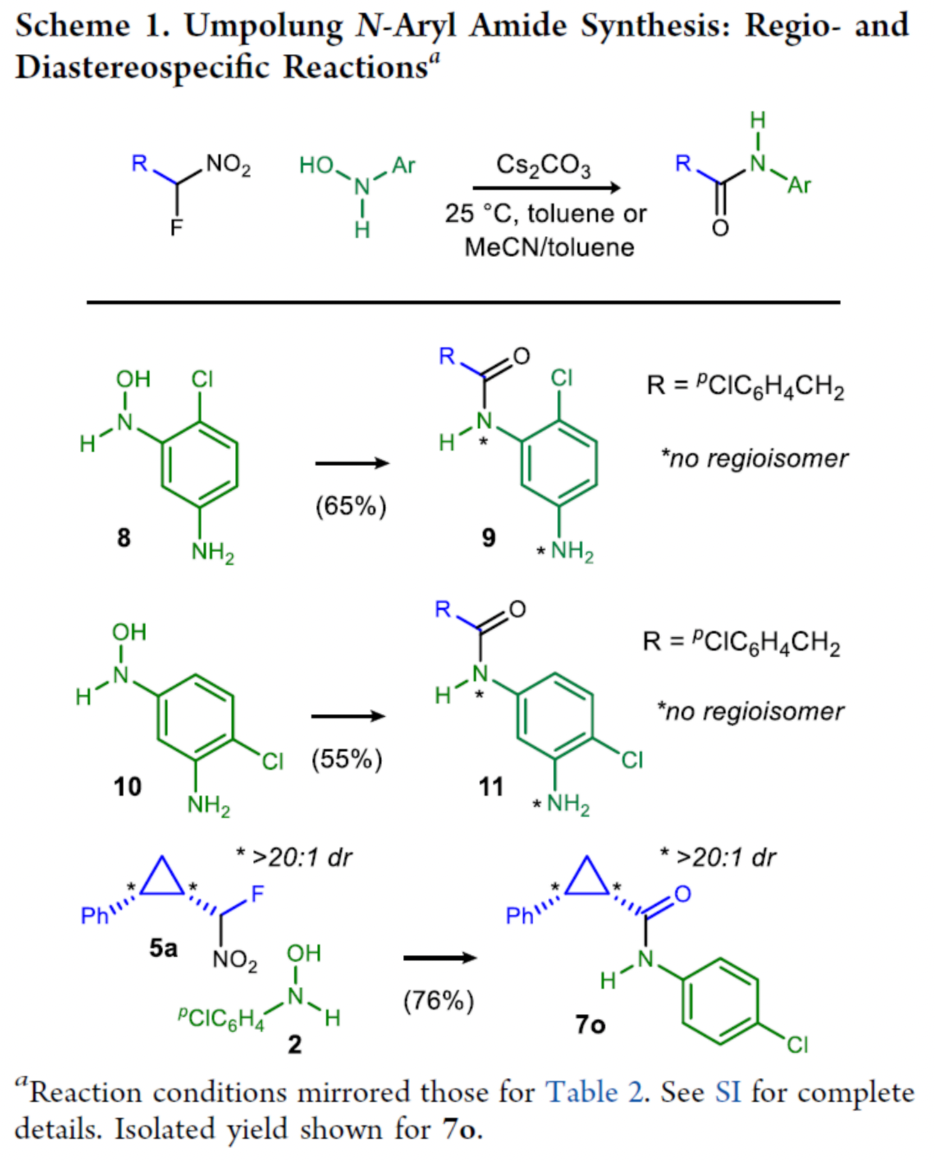
緊接著,作者對反應的區域選擇性以及非對映專一性進行了研究(Scheme 1)。當N-芳基羥胺的芳基上含有氨基以及氯時,反應具有出色的化學選擇性,僅生成N-芳基酰胺衍生物9和11。環丙基取代的溴代硝基甲烷的一些反應不是立體定向的,當環丙基取代的氟代硝基甲烷5a與N-芳基羥胺2進行反應時,具有非對映專一性,可獲得相應的N-芳基酰胺產物7o,為單一的非對映異構體。
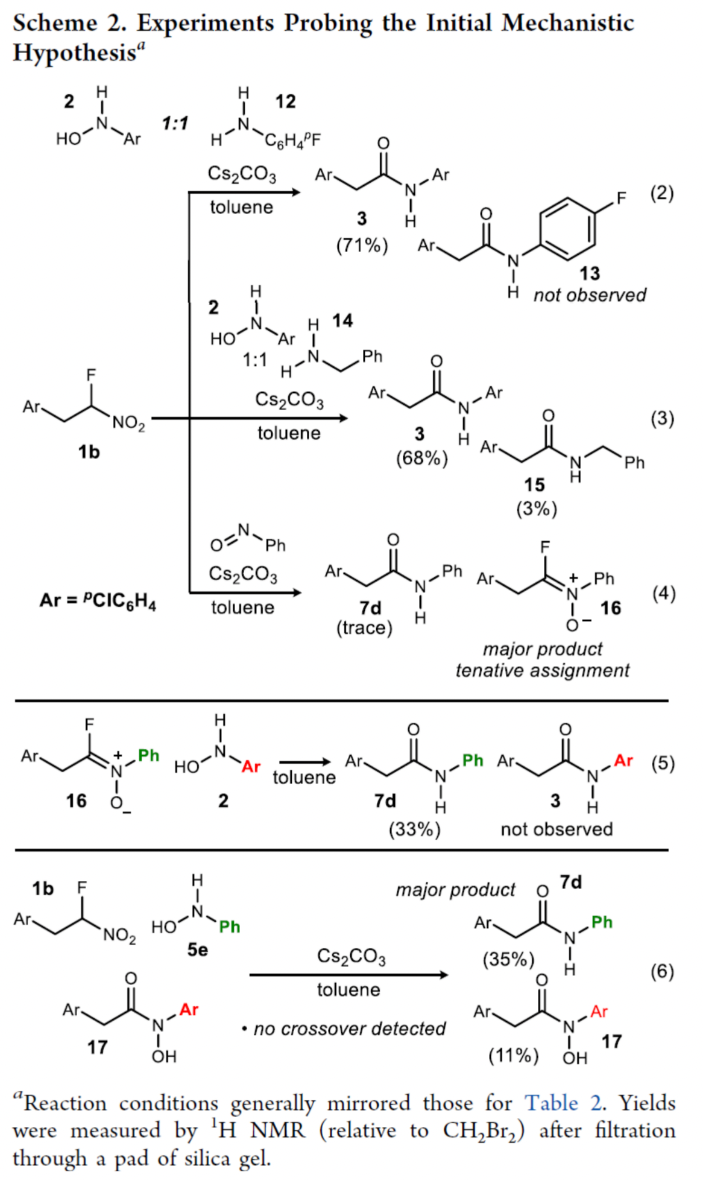
此外,作者還對反應機理進行了進一步的研究(Scheme 2)。首先,等當量的α-氟代硝基烷烴1b、N-芳基羥胺2和對氟苯胺12反應時,僅生成N-芳基酰胺衍生物3,收率為71%(eq 2)。同樣,等當量的α-氟代硝基烷烴1b、N-芳基羥胺2和芐胺14反應時,可以68%的收率得到N-芳基酰胺衍生物3以及以3%的收率得到酰胺衍生物15(eq 3)。當使用亞硝基苯與α-氟代硝基烷烴1b反應時,未能獲得所需的產物7d,主要生成化合物16(eq 4)。因此,反應涉及極性反轉的機理。其次,當化合物16與N-芳基羥胺2在甲苯溶劑中反應時,可以33%的收率得到酰胺化合物7d,但未生成產物3(eq 5)。同時,當N-芳基羥胺5e、α-氟代硝基烷烴1b與17在標準條件下反應時,可以35%的收率得到酰胺化合物7d以及回收11%收率的未反應底物17(eq 6)。
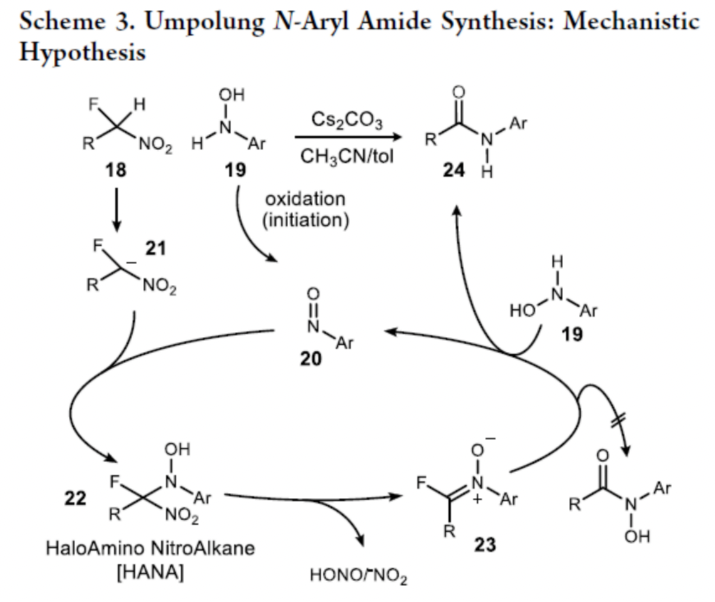
基于上述的研究以及相關文獻的查閱,作者提出了一種合理的催化循環過程(Scheme 3)。首先,N-芳基羥胺被氧化成芳基亞硝基化合物20。親電試劑20可與α-氟代硝基烷烴(fluoronitronate,21)反應生成鹵代氨基硝基烷(HANA)22。隨后,22通過進一步的分解,可生成中間體23。23可再與N-芳基羥胺反應,生成目標的N-芳基酰胺衍生物24以及芳基亞硝基化合物20。值得注意的是,單獨的N-芳基羥基胺19,通過充當還原劑從而促進23轉化為酰胺產物24。
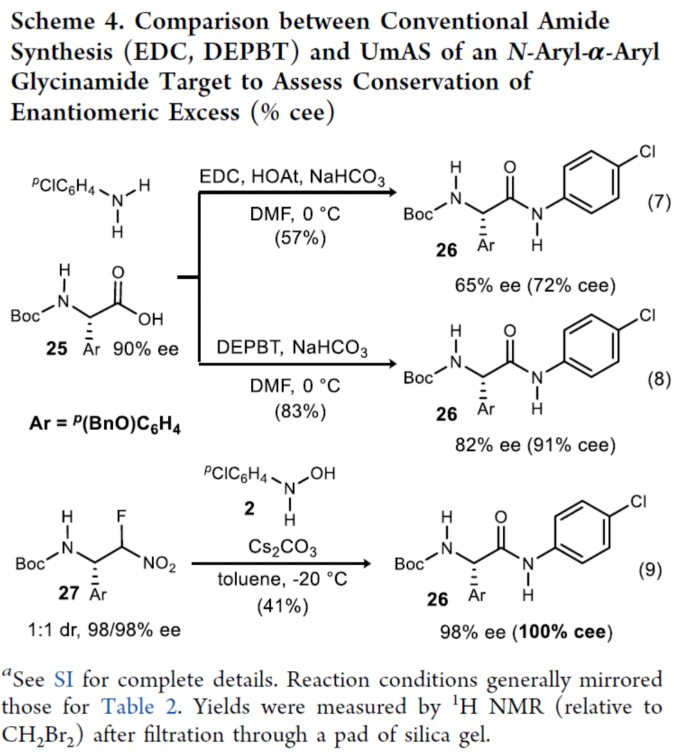
緊接著,作者通過對N-芳基-α-芳基甘氨酰胺合成的兩種策略進行了對比(Scheme 4)。25(90% ee)與苯胺衍生物在EDC/H2O條件下反應,可以57%的收率得到N-芳基酰胺產物26,但ee僅有65%(eq 7)。25(90% ee)與苯胺衍生物在DEPBT條件下反應,可以83%的收率得到N-芳基酰胺產物26,ee為82%(eq 8)。相比之下,當使用非對映異構體的α-氟代硝基烷烴27(dr為1:1)與N-芳基羥胺2在Cs2CO3/甲苯條件下反應,可以41%的收率得到N-芳基酰胺產物26,ee為98%,從而進一步說明了該策略的實用性(eq 9)。同時,N-芳基酰胺產物26長時間暴露于堿性條件會導致26的外消旋化。
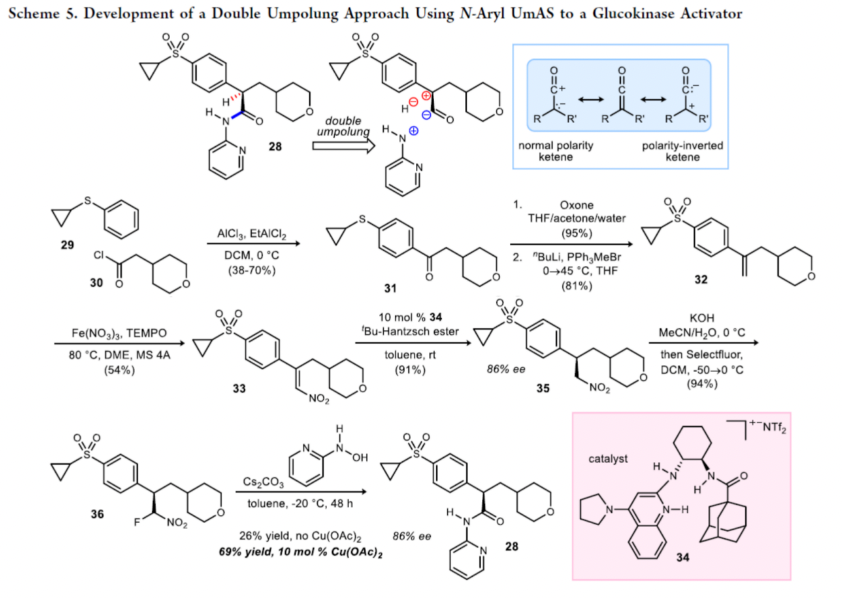
最后,作者通過多步法合成了一種N-芳酰胺衍生物28,是一種globalagliatin 類葡萄糖激酶激活劑的成員,可用于治療糖尿病。首先,29與30在AlCl3/EtAlCl2條件下進行Friedel-Crafts酰化反應,生成芳基酮化合物31,收率為38-70%。其中,反應的收率在一定程度上取決于所用氯化鋁的使用年限。31經氧化(95%收率)以及Wittig亞甲基化反應(81%收率),可生成末端烯烴32。32在Fe(NO3)3/TEMPO條件下進行硝化反應,可以54%的收率得到硝基化合物33。33通過進一步的不對稱還原后,可以91%的收率得到手性化合物35,ee為86%。35經氟化反應后,可以94%的收率得到α-氟代硝基烷烴36。36與2-吡啶基羥胺在Cs2CO3/甲苯/Cu(OAc)2條件下反應,可以69%的收率得到N-芳基酰胺產物28,ee為86%,
美國范德比爾特大學Jeffrey N. Johnston課題組報道了一種極性反轉酰胺合成策略,直接合成了一系列N-芳基酰胺衍生物。其中,以α-氟代硝基烷烴和N-芳基羥胺為底物,僅需使用簡單的Br?nsted堿作為反應的促進劑。同時,該反應具有反應條件溫和、操作簡單、官能團兼容性高、區域選擇性高等特點。此外,UmAS方法的核心是避免了易發生差向異構化親電酰基供體的生成。在傳統酰胺合成中使用的兩種主要偶聯劑中,苯胺的較低親核性對反應的收率和差向異構化存在影響。相比之下,使用N-芳基羥胺的UmAS可直接合成N-芳基酰胺產物,無需差向異構化。
文獻詳情:
Michael S. Crocker, Zihang Deng, Jeffrey N. Johnston*. Preparation of N?Aryl Amides by Epimerization-Free Umpolung Amide Synthesis. J. Am. Chem. Soc.2022, https://doi.org/10.1021/jacs.2c05986











