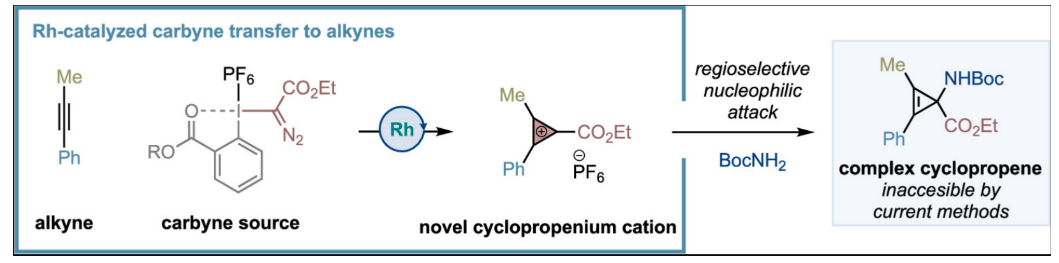
環丙烯陽離子(CPCs)是由Ronald Breslow教授在20世紀50年代末發現的,其是Hückel芳香體系中最小的成員。此類具有兩個π電子的芳香陽離子在三個2p軌道上發生離域,具有一定的熱力學穩定性和分子張力(Figure 1A)。最近,具有較高穩定性的三(二烷基氨基)CPC衍生物可以作為電光催化劑,基因傳遞劑,非水氧化還原電池的陰極電解質或液晶來使用。盡管CPCs可以作為三碳合成子在構建復雜分子結構方面具有較大的應用潛力,但其在有機合成方面的應用還未得到充分的重視。其中一個主要原因是在20世紀50年代至80年代所開發的大多數CPCs合成策略均需要多步合成,因此在合成效率上存在一定局限性。此外,基于炔烴與氯卡賓或陽離子金屬-卡拜[(η5-C5H5)(CO)2Mn≡CPh]+的官能團化反應也是一種合成策略,但其底物適用范圍非常有限(僅報道兩個例子)。并且不對稱的CPCs在親核反應中可能具有較差的區域選擇性。如Padwa課題組報道的CPCs與格氏試劑反應得到兩種區域異構體的混合物。基于此,最近西班牙巴塞羅那科學技術學院Marcos G. Suero課題組利用簡單易得炔烴和高價碘試劑作為形式上的陽離子卡拜源,在銠催化下一步實現CPCs的制備。該反應具有較寬的底物范圍,實現了一種新型酯基取代CPCs的合成。值得注意的是,其還可以與多種親核試劑反應,實現具有較大應用價值的環丙烯衍生物的合成(Figure 1B)。
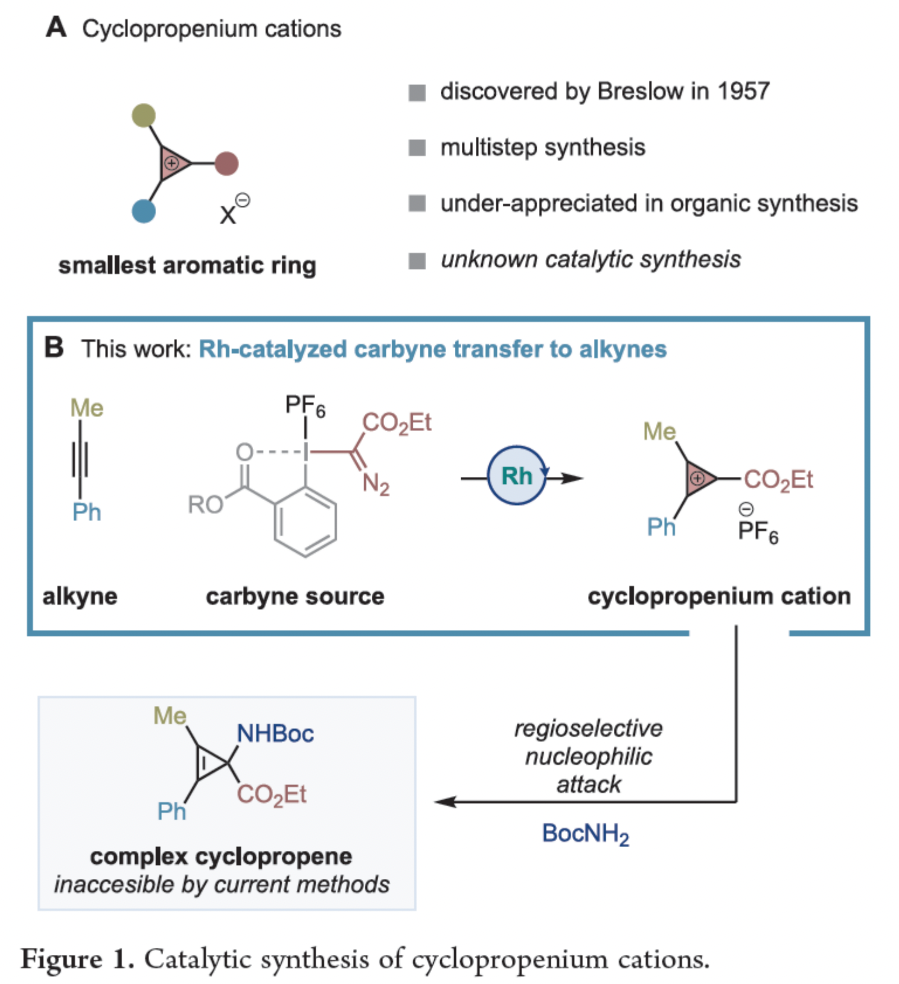
基于作者課題組使用高價碘試劑作為卡拜合成子實現合成轉化的興趣,作者認為利用Rh2(esp)2可以獲得銠-卡拜中間體(int-1),這是一種新型的酯基取代的銠卡賓物種。作者認為此物種可以被炔捕獲得到環丙烯基I(III)中間體(int-2)。最后通過離子化過程使I(III)離去得到酯基取代的CPCs(Figure 2)。

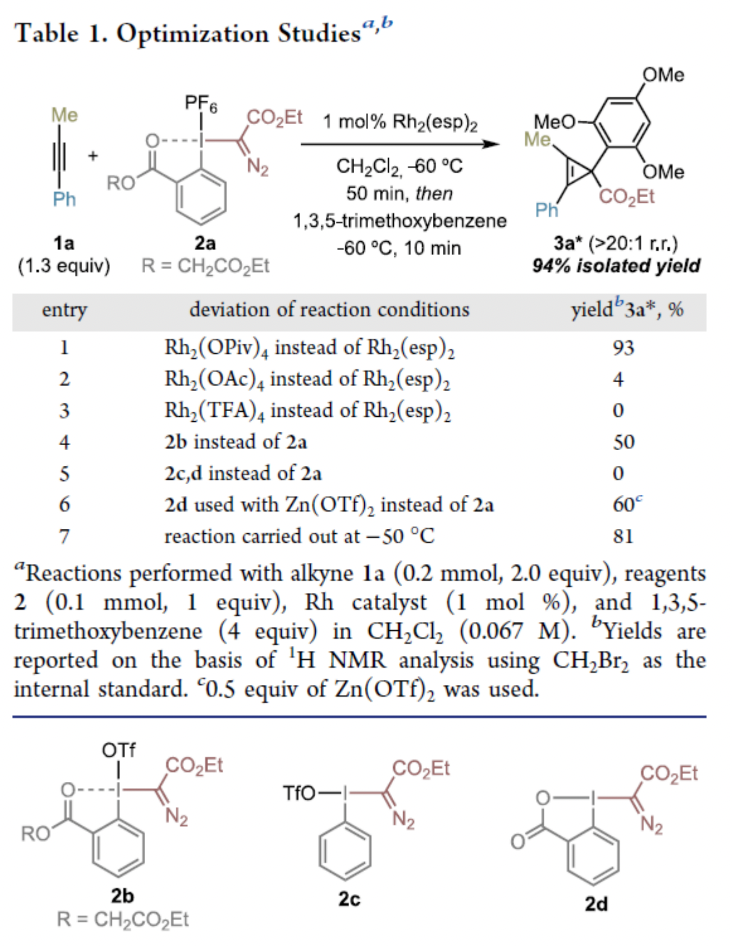
作者首先利用內炔1a和高價碘試劑2a作為模板底物進行條件優化,發現當使用1 mol% Rh2(esp)2催化,在二氯甲烷中-60 oC反應50分鐘后,加入1,3,5-三甲氧基苯作為親核試劑反應10分鐘可以以94%的產率(>20:1 r.r.)得到產物3a*(Table 1)。
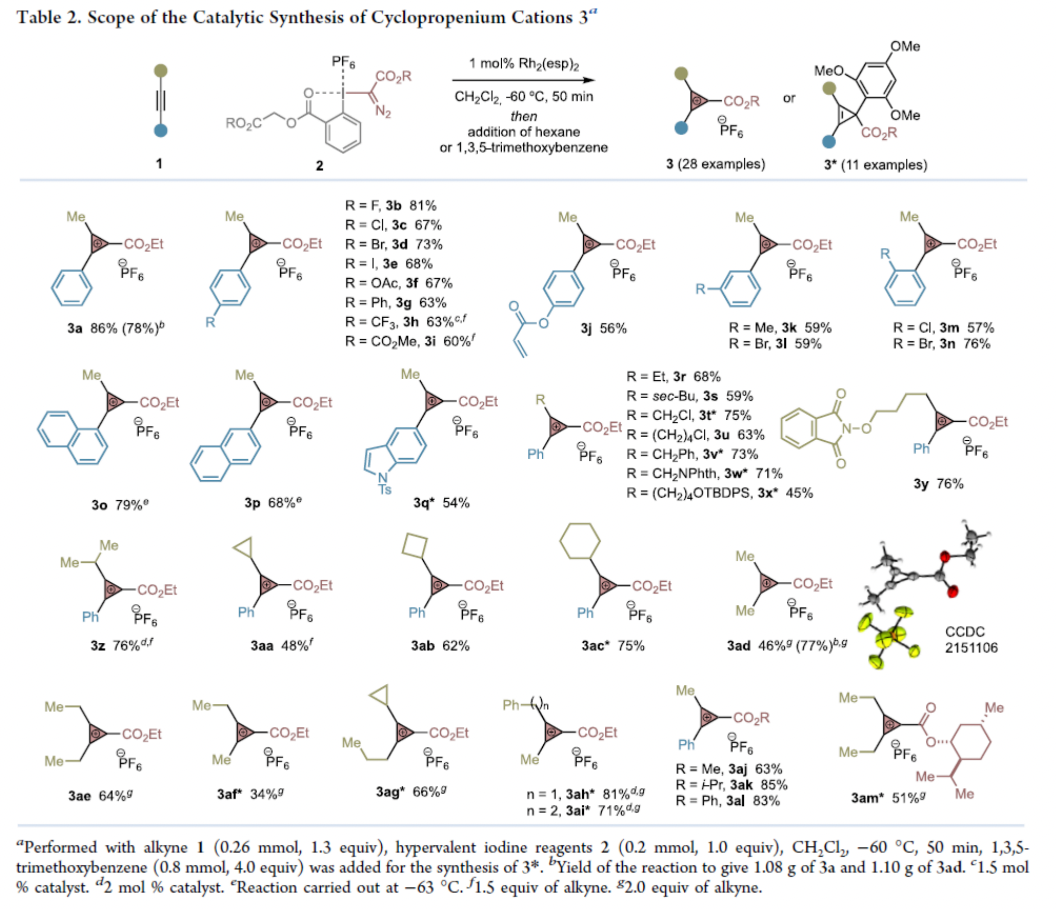
隨后,作者對此反應中炔烴1的底物范圍進行了考察(Table 2)。實驗結果表明反應可以在1中苯環的鄰、間、對位兼容鹵素(3b-3e, 3l-3n)、乙酰氧基(3f)、苯基(3g)、三氟甲基(3h)、酯基(3i)、烯烴(3j)、甲基(3k)等官能團。此外,萘(3o, 3p)和其它雜環骨架(3q*)也可以兼容。其它的一級烷基,如乙基(3r)、仲丁基(3s)、氯烷基(3t*, 3u)、芐基(3v*)以及保護的胺(3w*)或醇(3x*, 3y)官能團化的烷基均可很好的兼容。二級烷基取代基,如異丙基(3z)(需要增加催化劑和炔的量)、環丙基(3aa)、環丁基(3ab)和環己基(3ac*)等均可兼容。而含有三級烷基(叔丁基、三甲基硅基)的炔參與反應只能得到痕量CPCs產物。遺憾的是,二苯乙炔在此反應中無活性,而利用端炔反應則得到難以區分的混合物。此外,作者證實不同酯基取代的高價碘試劑均可兼容得到相應的產物3aj-3al, 3am*。值得注意的是,此反應可以以克級規模實現3a和3ad的制備,證明了此轉化的實用性。
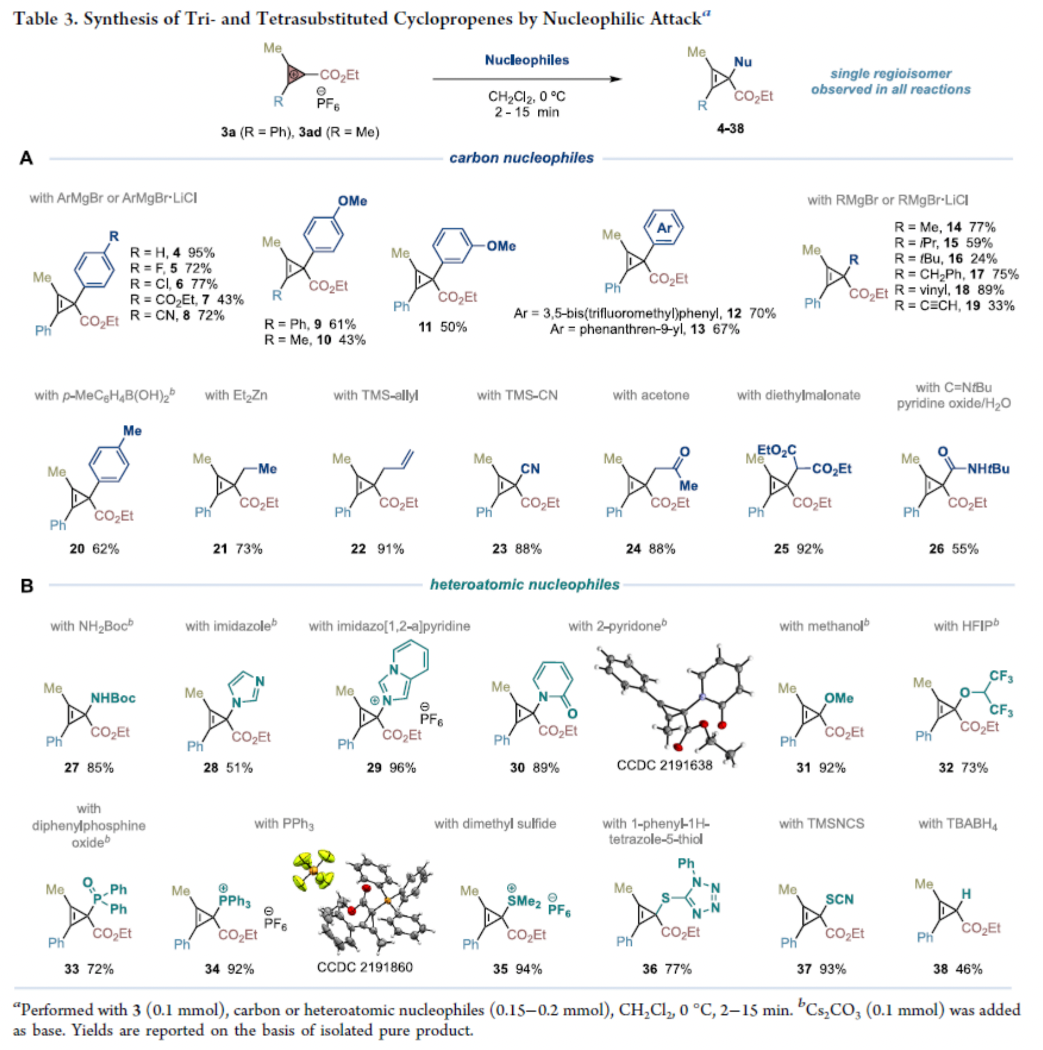
接下來,作者嘗試將合成出的環丙烯陽離子與一系列親核試劑反應來實現多取代環丙烯的合成。實驗結果表明,商業可得的芳基、烷基、烯基、炔基格氏試劑均可以作為碳親核試劑與環丙烯陽離子反應以單一異構體得到環丙烯4-19。此外,硼酸、有機鋅試劑、有機硅試劑、羰基以及異氰也可以作為親核試劑實現環丙烯20-26的合成,并且大部分的例子不需要利用色譜柱分離就可以得到相應的環丙烯產物。值得注意的是,此方法為復雜環丙烯骨架的合成提供了新的途徑,從而解決了金屬催化卡賓與重氮乙酸酯向內炔轉移過程中遇到的挑戰。即烷基或烯丙基取代的金屬卡賓在與內炔發生環丙烯化之前,經歷快速的β-H消除過程或分子內環丙烷化過程(Table 3A)。除了碳親核試劑之外,一系列雜原子(N、O、P、S)親核試劑同樣可以實現此類轉化,以較高的效率得到相應的四取代環丙烯產物27-37。而由于缺少雜原子取代的重氮乙酸乙酯或其它可替代的卡賓源,目前還沒有其它反應能實現此類四取代環丙烯的合成(Table 3B)。
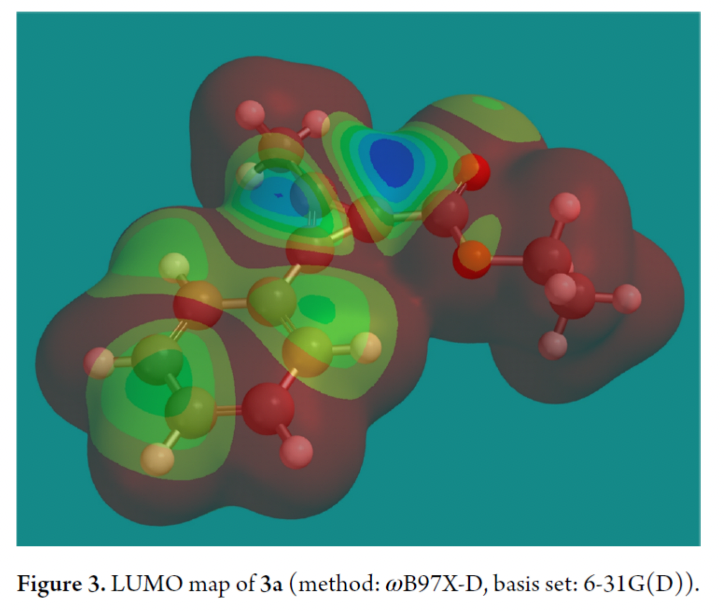
最后,為了解釋CPCs3在親核加成中所觀察到的區域選擇性,作者在ωb97xd/6-31G(d)水平上使用SPARTAN 20對其幾何構型優化和LUMO圖進行計算(Figure 3)。結果表明酯基取代的碳原子在環丙烯陽離子中的LUMO系數最高,表明親核試劑進攻是在軌道控制下發生的。
西班牙巴塞羅那科學技術學院Marcos G. Suero課題組利用簡單易得炔烴和高價碘試劑作為形式上的陽離子卡拜源,在銠催化下一步實現CPCs的制備。該反應不需要在手套箱里操作,且具有較寬的底物范圍,實現了新型酯基取代CPCs的合成。值得注意的是,其還可以與多種親核試劑(C、N、O、P、S)反應,實現具有較大應用價值的環丙烯衍生物的合成。
文獻詳情:
Hang-Fei Tu, Aliénor Jeandin, Marcos G. Suero*, Catalytic Synthesis of Cyclopropenium Cations with Rh-Carbynoids. J. Am. Chem. Soc.2022, https://doi.org/10.1021/jacs.2c07769









