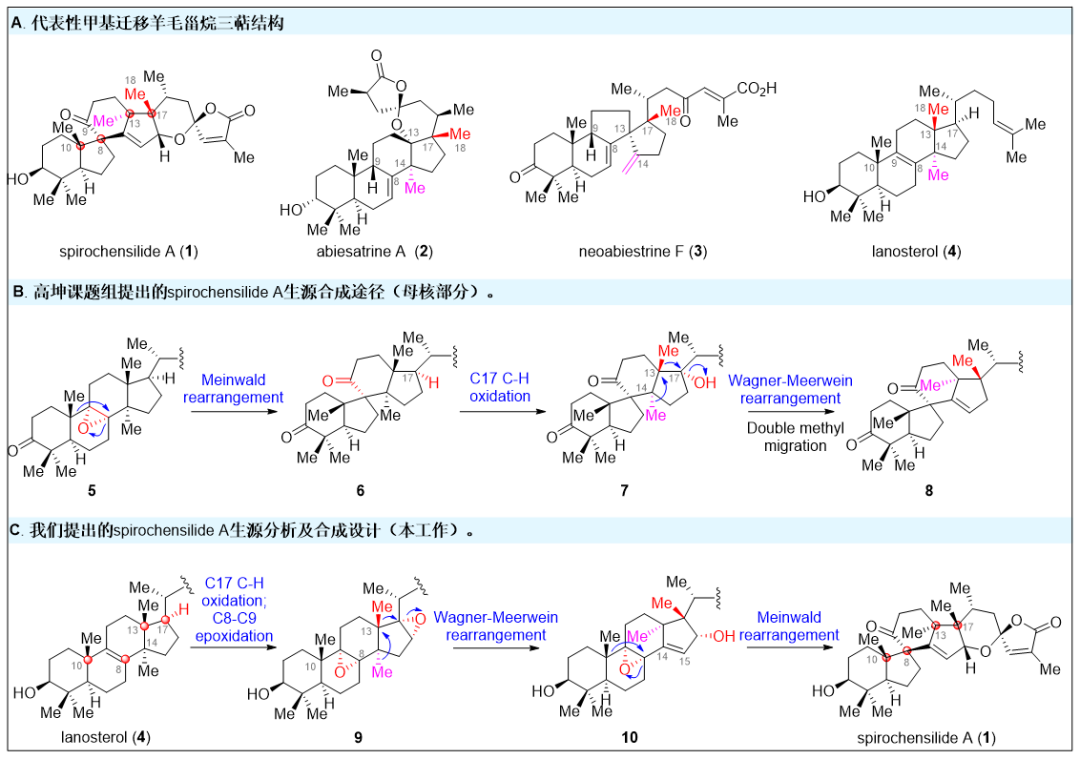
結構豐富,生物活性多樣的三萜天然產物都是眾多傳統中藥的重要組成成分之一,如羊毛甾烷型三萜天然產物憑借其出色的抗炎鎮痛、抗病毒、抗植物病原菌、以及抗腫瘤等活性成為藥物化學家關注的重點。Spirochensilides A-B是2015年蘭州大學高坤課題組(Org. Lett. 2015, 17, 2760-2763)從秦嶺冷杉的枝葉中分離得到的一類結構新穎的羊毛甾烷型三萜天然產物(圖1A)。結構上,它們具有螺[4.5]癸烷(B,C環)模塊組成的6/5/6/5獨特的四環全碳骨架,以及兩對相鄰的全碳手性中心(C8/C10和C13/C17)。生物活性方面,其對NO的產生有中等抑制作用,可作為炎癥研究的潛在探針分子。與此同時,高坤課題組還推測Spirochensilide A是由環氧化合物5經Meinwald重排、酶催化的C17C-H氧化及兩步Wagner-Meerwein重排反應來得到的(圖1B)。Spirochensilide A獨特的骨架結構和生物活性吸引了國內外合成化學家的關注。2020年,北京大學的楊震課題組(J. Am. Chem. Soc. 2020, 142, 8116-8121)以半頻哪醇重排、鎢介導的環丙烯Pauson-Khand反應以及單線態氧促進的氧化環化反應為關鍵反應,最終以22步,2.2%總收率完成Spirochensilide A的首次不對稱全合成。
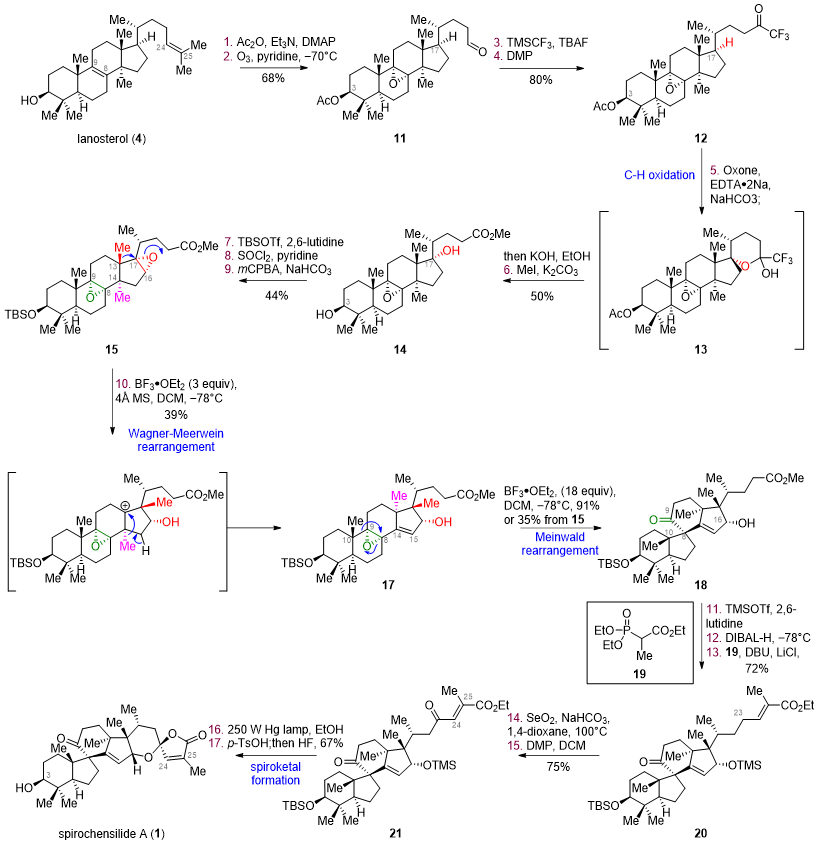
圖1. Spirochensilide A 的結構及生源分析(圖片來源:J. Am. Chem. Soc.)南開大學鄧軍課題組致力于通過仿生合成策略來提高復雜活性天然產物全合成的效率。過去幾年中,陸續完成了多個家族天然產物的仿生合成工作(Angew. Chem. Int. Ed.2018, 57, 14221-14224;Angew. Chem. Int. Ed.2019, 58, 17552-17557;Org. Lett.2020, 22, 9421-9426.),并提出了基于生源啟發的分子網絡分析方法(Bioinspired Structure Network Analysis), 建立了細胞松弛素家族天然產物的通用合成策略,實現了該家族集群式高效合成(Chem. 2021, 7, 212-223; Angew. Chem. Int. Ed.2021, 60, 15963-15971.)近日該課題組利用生源網絡分析方法對Spirochensilide A開展了生源分析,并提出了Spirochensilide A的可能生源合成途徑(圖1C)。該課題組認為,羊毛甾醇(4)在一系列酶催化下首先在C17位進行選擇性C-H氧化、四取代雙鍵環氧化后,發生兩步Wagner-Meerwein甲基遷移重排,形成關鍵中間體10,接著發生Meinwald重排得到6/5/6/5四環骨架,進一步關上螺縮酮環最終的得到Spirochensilides A。該合成的難點主要在于:如何通過化學手段實現C17位的立體選擇性C-H氧化、并調控Wagner-Meerwein雙甲基遷移重排以及Meinwald 重排反應的選擇性。圖2. Spirochensilide A 的仿生合成(圖片來源:J. Am. Chem. Soc.)如圖2所示,基于以上的合成設想,作者從商業可得的羊毛甾醇(4)出發,經過乙酰基保護、臭氧化切斷側鏈、四取代雙鍵環氧化后得到醛中間體11。隨后對化合物11側鏈的醛進行三氟甲基加成,接著DMP氧化,得三氟甲基酮中間體12。采用楊丹課題組發展的3級C-H氧化方法(J. Am. Chem. Soc. 1998, 120, 6611- 6612.),構建了C17位的氧化態得到半縮醛,并通過KOH水解三氟甲基酮和內酯,得到羧酸,最后將羧酸甲酯化得到中間體14。將14的3-OH用TBS保護基進行保護之后,用SOCl2對C17位的羥基進行消除,將得到的雙鍵用m-CPBA進行環氧化,得到重排中間體15。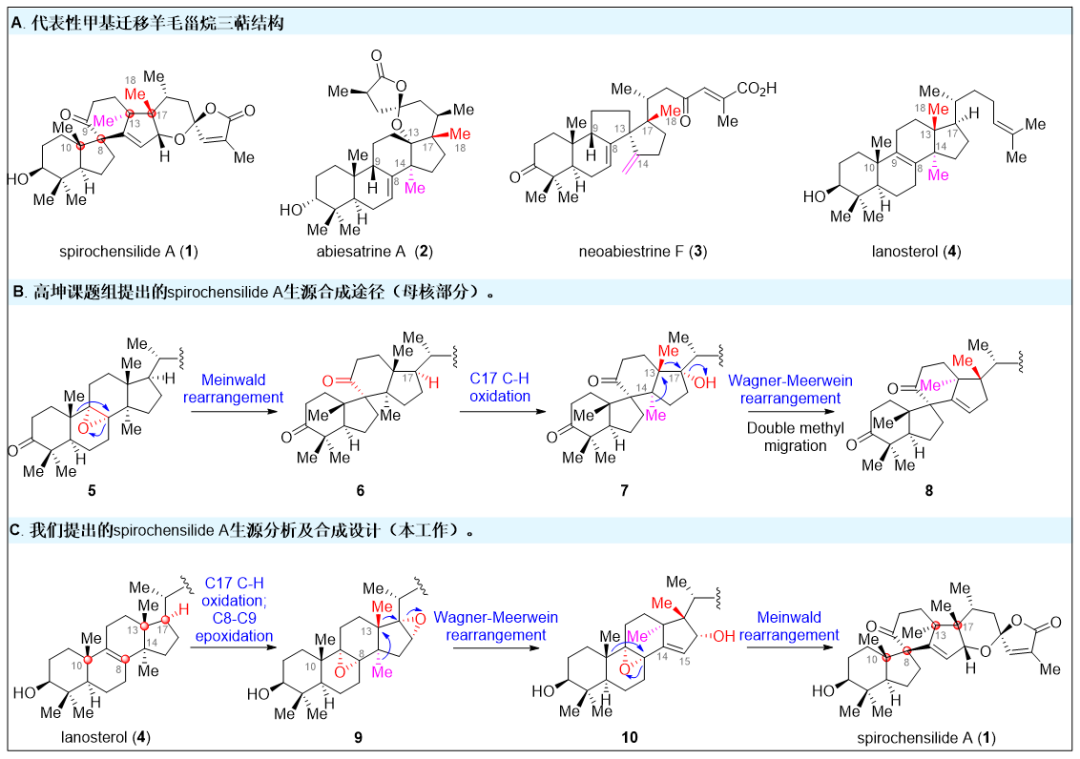

圖3. Wagner–Meerwein重排條件優化(圖片來源:J. Am. Chem. Soc.)得到中間體15之后,經過一系列條件篩選(圖3),最終在BF3·OEt2條件下,實現了兩步連續的Wagner–Meerwein重排反應得到中間體17,并且在相同條件下繼續反應即可得到Meinwald重排產物18,完成了核心四環骨架的構建。在拿到18之后,作者開始構建右側螺縮酮環系。其認為在側鏈碳骨架和氧化態調整到位之后,可以通過一步環化縮合直接構建右側螺縮酮環系,將18中C16位的羥基用TMS保護基保護,將側鏈的酯用DIBAL-H還原至醛,通過HWE反應增碳,得到中間體20。將C23位用SeO2進行烯丙位氧化得到烯丙醇,并用DMP將其氧化為酮,得到中間體21。至此,側鏈碳數和氧化態調整完畢,在光照條件下將雙鍵順反異構化之后,在酸性條件下一步脫除16-OH的TMS保護基并完成螺縮酮結構的構建。最后氫氟酸脫出3-OH的TBS保護基,得到天然產物Spirochensilide A。
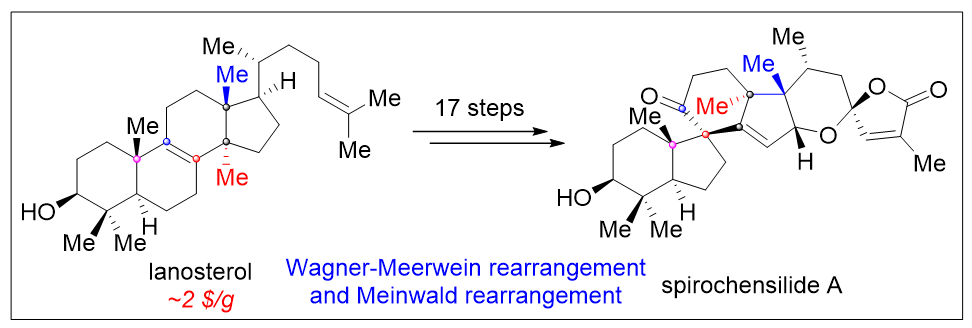
鄧軍課題組通過生源分析及理性的合成設計,以選擇性C-H氧化及Wagner-Meerwein/Meinwald 重排、光照順反異構化串聯螺縮酮成環等反應為關鍵步,17步實現了從廉價易得的羊毛甾醇到Spirochensilide A的高效仿生轉化,為該類天然產物可能的生物合成途徑解析及高效合成提供了線索。相關成果發表在J. Am. Chem. Soc.上,論文第一作者為龍先文博士和李俊博士研究生,鄧軍研究員為通訊作者,該工作得到了國家自然科學基金及南開大學基金的資助。
文獻詳情:
Xianwen Long,? Jun Li,? Feng Gao, Hai Wu, Jun Deng*. Bioinspired Synthesis of Spirochensilide A from Lanosterol. J. Am. Chem. Soc. 2022, https://pubs.acs.org/doi/10.1021/jacs.2c07198