

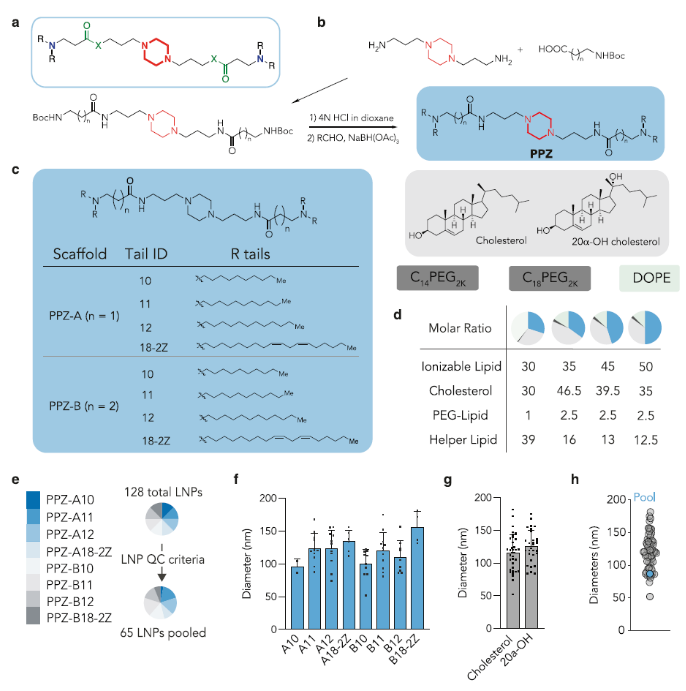
圖1.哌嗪衍生的LNP的合成與表征(圖片來源:Nat. Commun.)
研究背景
肝臟作為人體最大的代謝器官兼具儲存糖原及造血功能,其中肝血竇(相鄰肝板之間的腔隙,是一種特殊的毛細血管)包含不連續的脈管系統以及緩慢的血流,有利于肝細胞與血流之間進行物質交換,增加了納米顆粒外滲和與肝細胞的相互作用,因此將RNA遞送至非肝細胞成為亟待解決的問題。目前研究人員側重于以下幾個方面:1)對動物進行預處理,使肝細胞提前過載,從而改變LNP嗜性。然而,目前尚不清楚這種多步驟策略是否具有臨床相關性;2)LNP偶聯活性靶向配體。例如,DLin-MC3-DMA(一種經FDA批準用于肝細胞siRNA遞送的可電離lipid)結合抗體可重新靶向免疫細胞。這種方法的潛在限制是——含有RNA藥物的主動靶向納米顆粒在臨床試驗中可引起不良事件。3)單個識別納米顆粒體內代謝途徑,實現內源性靶向。此方法需要高通量體內篩選,不適用于大型lipid庫。因此目前大部分lipid高通量篩選處于在體外細胞水平。本文中,作者通過DNA序列“條形碼”,篩選了65種不同的LNP,每個LNP均用獨特的“條形碼”標記。體內注射后,對從不同組織中提取的條碼進行測序,通過檢索14種細胞類型的DNA“條形碼”,便可知其體內分布。
關鍵合成步驟
作者首先設計了由哌嗪核心和兩個叔胺組成的可電離脂質體頭部,其可與疏水碳鏈相連(Pi-Lipids)(圖1a)。其中以哌嗪為核心,添加了從C10到C12的飽和烴鏈(之前研究表明C10到C12的烷烴長度有助于增強細胞膜穿透;ID:10-12)。此外,亞油酸鏈也被證實可增強LNP的胞內遞送,因此作者也將其納入體系(ID:18-2Z)(圖 1b,c)。這八種新的基于哌嗪的可電離脂質體具體合成步驟如下:1,4-雙(3-氨基丙基)哌嗪與Boc保護的β-丙氨酸或γ-氨基丁酸通過酰胺偶聯反應12小時,產生哌嗪中間體,產率為50%。隨后脫除Boc保護基,然后與不同疏水醛進行一鍋法還原胺化反應,得到最終的哌嗪基脂質(PPZ),產率為32%至59%。作者改變了碳鏈鍵的長度并在兩個骨架中合成了lipid,PPZ-A含兩個碳,PPZ-B含三個碳。脂質結構通過核磁共振和高分辨率質譜分析確證。
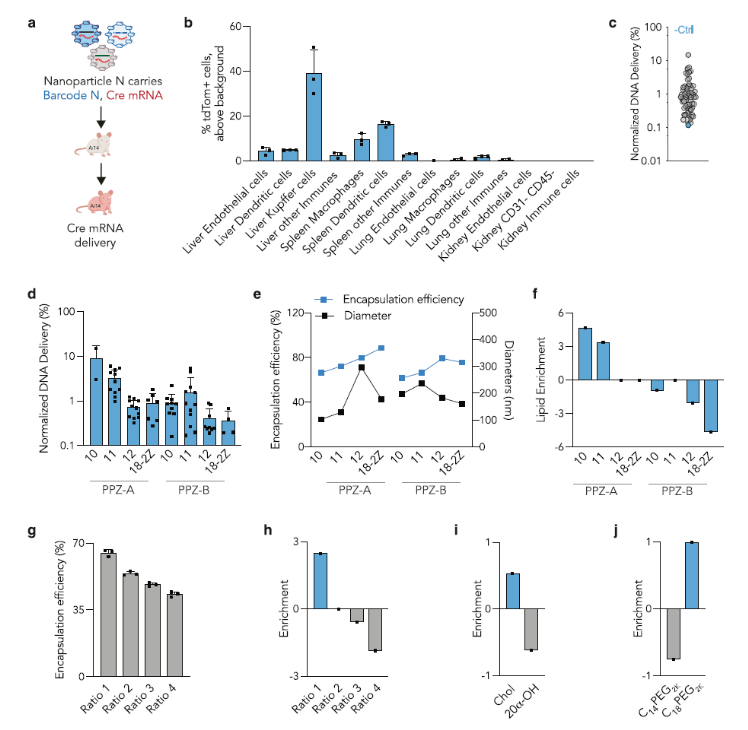
圖2. 量化分析65種mRNA LNP體內遞送以及結構分析(圖片來源:Nat. Commun.)
PPZ lipid與mRNA形成脂質納米顆粒
作者進一步研究了Pi-Lipids是否可制備為單分散LNP(Pi-LNP)。采用了(i)可電離陽離子lipid;(ii)兩種具有不同碳鏈長度的PEG-lipid(C14PEG2K和C18PEG2K);(iii)兩種膽固醇(膽固醇、20α-羥基膽固醇);(iv)磷酸乙醇胺(DOPE)。作者將Cre mRNA和DNA“條形碼”以10比1的質量比進行混合。每個LNP都經過配制以攜帶其獨特的DNA“條形碼”,所有DNA“條形碼”均為91nt長的單鏈DNA序列。用硫代磷酸酯修飾5'和3'末端以減少外切核酸酶降解,采用通用正向和反向引物區域以確保每個序列的相等擴增,包含7個隨機核苷酸以監測PCR偏差。
在對65個Pi-LNP進行表征后,作者將其靜脈注射入Ai14小鼠中(圖 2a)。Ai14小鼠在CAG啟動子下游有一個Lox-Stop-Lox-tdTomato構建體。因此,如果Cre mRNA被遞送到靶細胞中并隨后翻譯成Cre蛋白,則細胞變為tdTomato+(圖 2a)。通過熒光激活細胞分選分離tdTomato+細胞并對細胞進行測序,在tdTomato+細胞內分離與特定LNP相關的DNA 條形碼。作者共量化了14個不同細胞群的tdTomato+細胞的百分比(圖 2b)。在枯否細胞中觀察到40%的tdTomato+細胞,在脾巨噬細胞中為10%,在脾樹突細胞中為16%。在肝內皮細胞和樹突細胞tdTomato+%<5%,肺和腎沒有觀察到tdTomato+細胞。之后,作者使用下一代DNA測序研究了65個LNP。然后,使用大型數據集對所有細胞類型進行全面結構分析。首先,分析了基于不同Pi-Lipid結構的LNP的平均歸一化遞送,發現含有PPZ-A10的Pi-LNP 表現出最高的遞送,其次是PPZA11(圖 2d)。作者假設在Pi-LNP之間觀察到的標準化傳遞的差異可能是由于封裝效率或LNP直徑差造成的。為了驗證這一假設,配制了八個LNP,僅改變可電離脂質結構,同時保持相同的摩爾比和化合物組成,并測量每個LNP的直徑和封裝效率(圖 2e)。作者觀察到分別用PPZ-A10到PPZ-A18-2Z配制的Pi-LNPs的封裝效率從66%增加到88%,這表明封裝效率隨著碳鏈越長而增加。然而,具有較長碳鏈的Pi-LNP也顯示出150到300 nm大直徑,不利于LNP的體內遞送。用PPZ-A和PPZ-B脂質配制的Pi-LNP之間的封裝效率相當,但含有PPZ-B脂質的Pi-LNP 比PPZ-A的尺寸大,因此體內遞送量降低(圖 2d)。
總結
本文中,作者通過設計、合成和表征128種新型Pi-LNP,并將核酸遞送到體內的非肝細胞。其中LNP-A10,以低至0.3mg/kg的劑量優先向肝臟和脾臟免疫細胞遞送mRNA。作者將PPZ脂質的結構與包含哌嗪基序的商業脂質(C12-20039)進行比較,其添加了酰胺鍵并去除了羥基。羥基會產生立體異構體,使純化變得困難。相比之下,PPZ脂質是手性純的,這使得它們更容易純化。作者發現與之前報道的C12-20039相比,Pi-LNP對脾巨噬細胞和樹突狀細胞的遞送增加。
文獻詳情:

長按或掃碼左側二維碼查看原文
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn