

正文
(圖片來源:Nat. Chem.)
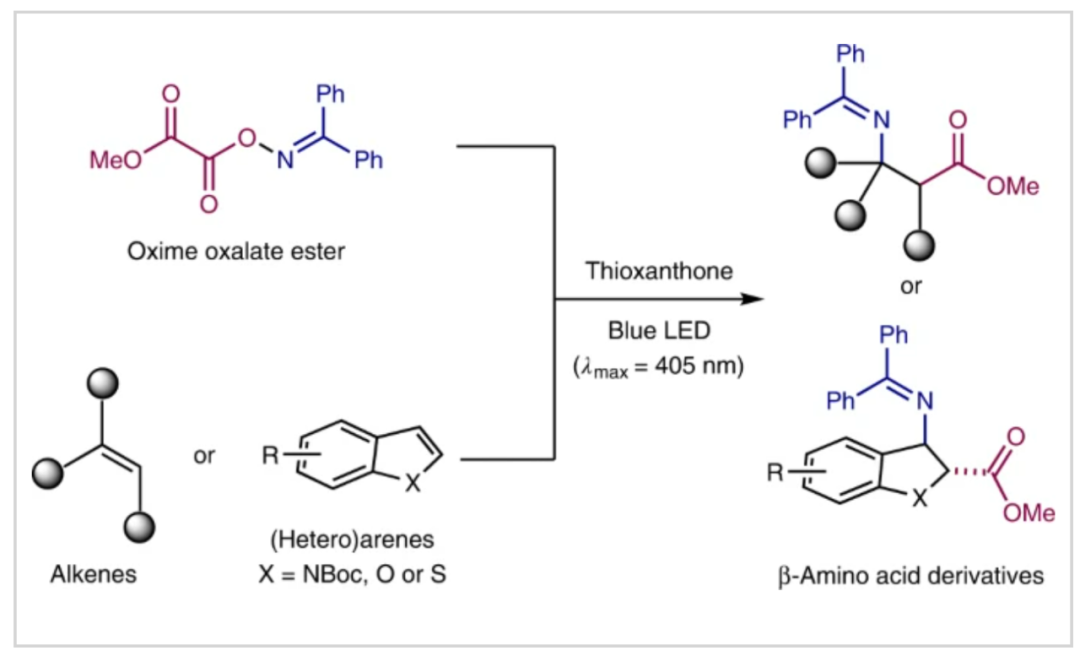
β-氨基酸作為一種重要的結構骨架廣泛存在于眾多生物活性分子、藥物以及天然產物中(Fig. 1a)。此外,由于此類骨架可以增加代謝穩定性,β-氨基酸也被廣泛用于構建生物活性多肽和模擬肽學。因此,探索β-氨基酸及其衍生物的高效合成在有機化學和藥物化學中具有重要意義。
β-丙氨酸作為最簡單的β-氨基酸,是唯一天然存在的β-型氨基酸,其可以用于食品添加劑和藥物,與我們的日常生活密不可分。目前,在生物合成中可以通過二氫尿嘧啶和肌肽降解來合成β-丙氨酸。而大部分β-丙氨酸的生產主要來源于氨與β-丙內酯反應的工業化生產過程。盡管這是一種高效制備β-丙氨酸的方法,但β-丙內酯需要多步制備且反應條件苛刻等不足降低了其經濟效益。從環境和經濟效益上來講,如果直接選用簡單易得的乙烯作為起始原料來實現β-氨基酸的工業制備,則具有重要的意義(Fig. 1b)。
近些年,化學家們利用各種合成方法制備非天然β-氨基酸衍生物取得了很大的進展。主要包括以下策略:1)胺親核試劑與α,β-不飽和羧酸衍生物的共軛加成(Fig. 1c, Path I);2)貴金屬(Rh, Ir, Ru)催化β-胺基丙烯酸酯的氫化反應(Fig. 1c, Path II);3)烯醇硅醚與亞胺的Mannich類型反應(Fig. 1c, Path III);4)α-氨基酸與重氮甲烷的多步Arndt–Eistert同系化反應(Fig. 1c, Path IV)。盡管上述方法可以實現β-氨基酸的制備,但是這些方法通常需要通過多步操作對起始原料進行預官能團化,從而降低了反應的實用性。除此之外,劉國生小組(J. Am. Chem. Soc. 2015, 137, 2480)和Ruben Martin小組(J. Am. Chem. Soc. 2021, 143, 4949)分別利用CO和CO2作為羰基源實現了β-氨基酸的制備。但是也具有底物范圍局限、原料需要多步制備、反應時間長、會產生金屬催化劑殘留等不足。近年來,可見光作為一種安全、可再生和廉價的化學能源可促進復雜有機分子的合成,目前已經成為有機合成中的重要手段。最近,德國明斯特大學Frank Glorius課題組發展了光催化,利用簡單的烯烴或雜芳烴作為起始原料,高區域選擇性的實現了分子間的胺基-羧基化反應,構建了一系列β-氨基酸衍生物(Fig. 1d)。反應中使用穩定的肟草酸酯作為雙官能團化試劑,通過能量轉移(EnT)策略一步實現了胺基-羧基化過程,從而發展了一種構建β-氨基酸衍生物的新策略(Fig. 1e)。
(圖片來源:Nat. Chem.)
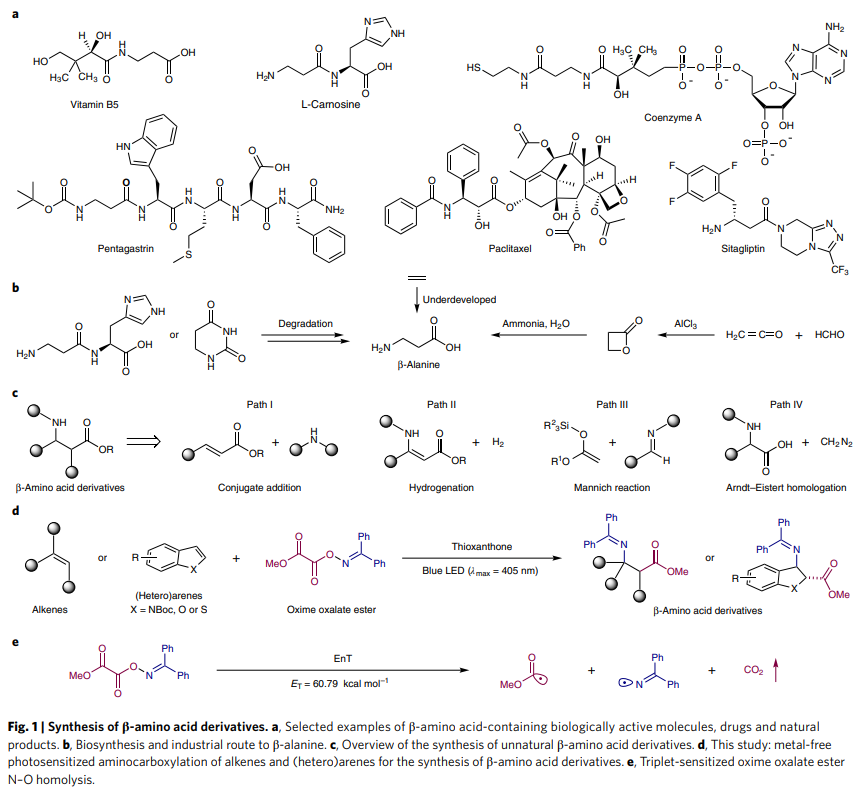
作者首先選用肟草酸酯S1和苯乙烯A1作為模板底物進行反應嘗試和條件篩選,發現當使用A1 (0.2 mmol), S1 (0.3 mmol), 噻噸酮 (5.0 mol%), EtOAc (0.1 M), 18 W blue LED (λmax = 405 nm), 氬氣氛圍,室溫下反應12小時可以以88%的分離產率得到β-氨基酸產物1。此外,作者在條件敏感性篩選中得出該反應相對比較穩定,只是在低光強度或高氧濃度下產率有所下降。隨后,作者對此反應中單取代烯烴的底物范圍進行探索。實驗結果表明反應對富電子烯烴、貧電子烯烴、烯炔以及非活化的烯烴均可以兼容。此外,對于含有復雜分子結構的端烯同樣具有良好的兼容性,以較高的產率得到相應的β-氨基酸產物47-59(Table 1)。
(圖片來源:Nat. Chem.)
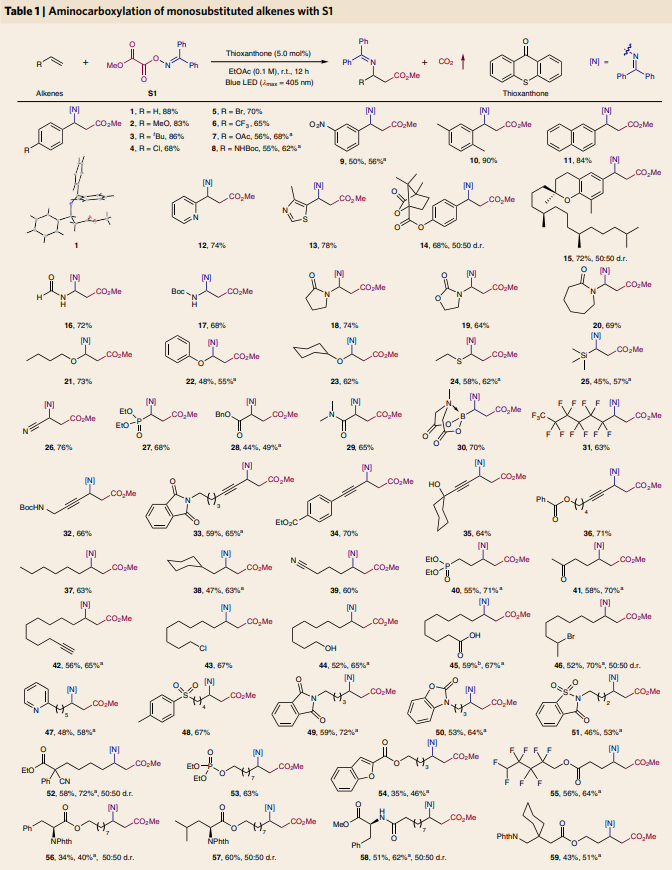
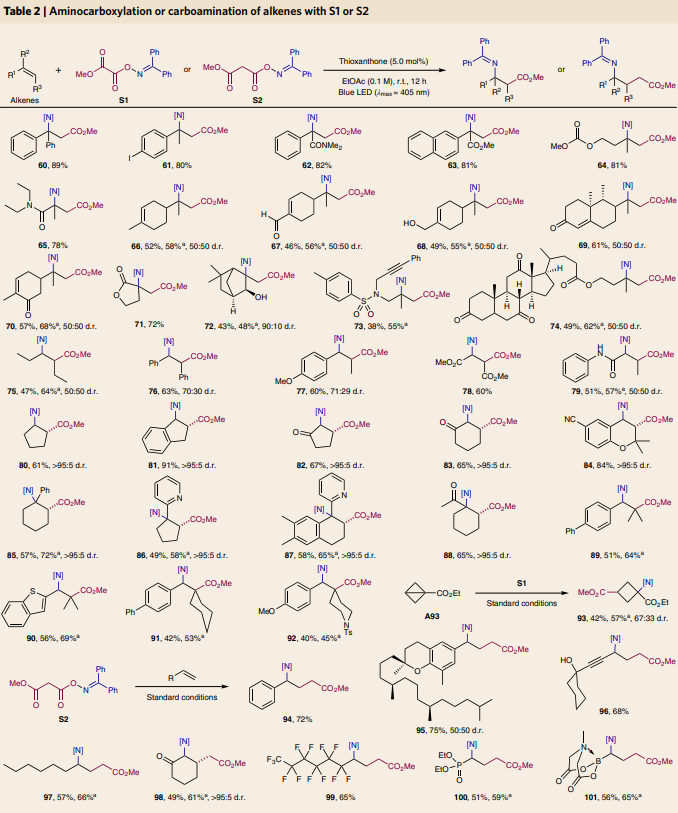
在對單取代烯烴的底物范圍進行探索后,作者嘗試對立體位阻更大的多取代烯烴的兼容性進行探索(Table 2)。實驗結果表明,1,1-二取代烯烴、對稱與非對稱的1,2-二取代烯烴以及三取代烯烴均能順利實現此轉化。遺憾的是,可能是由于立體位阻過大,四取代烯烴不能兼容此反應。值得注意的是,具有較大環張力的三環底物A93也可作為合適的受體,以42%的產率實現四元環氨基酸衍生物93的合成。除此之外,當作者選取S2作為雙官能團化試劑時,利用此方法在標準條件下還可以實現一系列γ-氨基丁酸(GABAs)衍生物94-101的合成。
(圖片來源:Nat. Chem.)
在已報道自由基與不飽和鍵的加成反應中,通常選用烯烴或炔烴作為底物。而雜芳環中的不飽和鍵由于活性相對較低,通常應用在自由基加成反應中具有一定局限性。高興的是,此反應體系對雜環(吲哚、苯并呋喃、苯并噻吩、菲、蒽)的加成過程同樣具有良好的兼容性。值得注意的是,這些產物中的絕大多數利用已有文獻報道的方法是很難合成的(Table 3)。
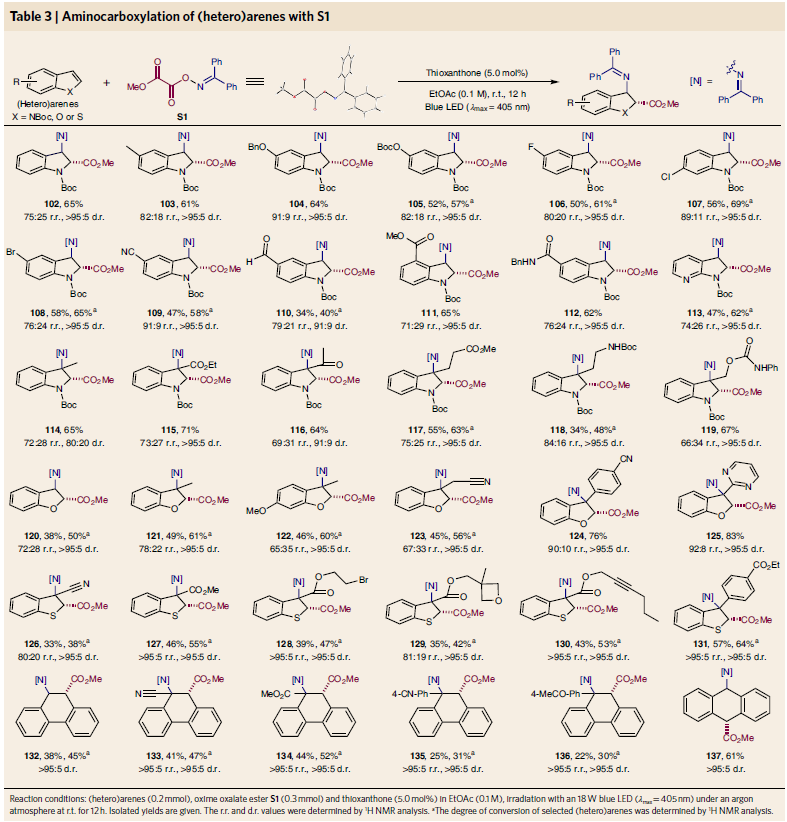
(圖片來源:Nat. Chem.)
接下來,為了證明此轉化的實用性,作者進行了一系列合成應用(Fig. 2)。首先,選用手性雙官能團化試劑S3可以實現不對稱胺基-羧基化過程,以56%的產率(d.r. = 75:25)實現138的合成(Fig. 2a)。隨后,作者對合成出的β-氨基酸產物1, 26, 94進行了多種合成轉化,證明了β-氨基酸產物的較高合成價值(Fig. 2b)。值得注意的是,利用S1(5.0 mmol)和乙烯(2.0 bar)作為原料,利用此方法可以以90%的產率直接一步合成β-丙氨酸衍生物147,隨后經過簡單的水解即可得到β-丙氨酸148。而148還可以通過四步轉化以49%的總產率實現生物活性分子L-carnosine 152的合成(Fig. 2c)。除了生物活性分子外,利用β-丙氨酸還可以實現一系列藥物核心結構的構建。例如,利用148可以通過三步,87%的總產率實現抗炎藥balsalazide 155的合成(Fig. 2d)。此外,利用此方法使用A94和S1作為原料,可以通過五步高效合成出治療2型糖尿病的口服藥(±)-sitagliptin 160(Fig. 2e)。
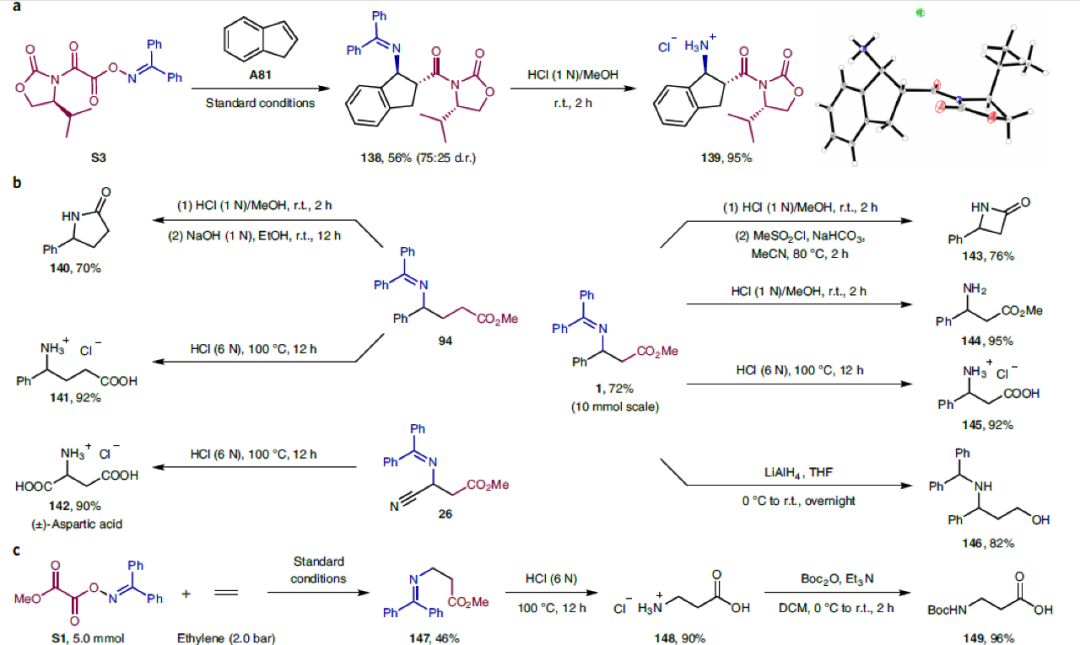


(圖片來源:Nat. Chem.)
為了深入探索反應機理,作者進行了一系列控制實驗(Fig. 3)。通過實驗主要得出以下結論:1)反應中涉及氮自由基中間體(Fig. 3a);2)反應進行得很快,并沒有明顯的誘導期,大部分產物在1小時內形成(Fig. 3b);3)紫外可見吸收光譜表明在激發波長(λmax = 405 nm)附近,噻噸酮是唯一的吸收物種(Fig. 3c);4)S1能夠有效淬滅噻噸酮發光,而A1不能淬滅,這表明反應中噻噸酮與S1之間存在相互作用(Fig. 3d);5)反應中可能存在Dexter型的三線態-三線態能量轉移過程(Fig. 3e);6)利用循環伏安法排除了S1被激發態的噻噸酮單電子轉移還原的可行性(Fig. 3f)。
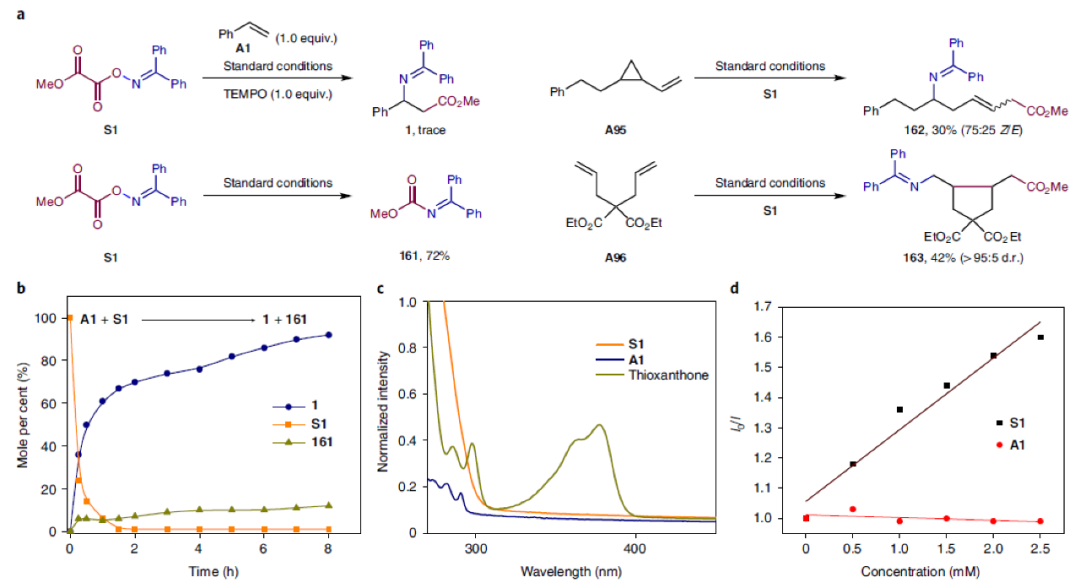
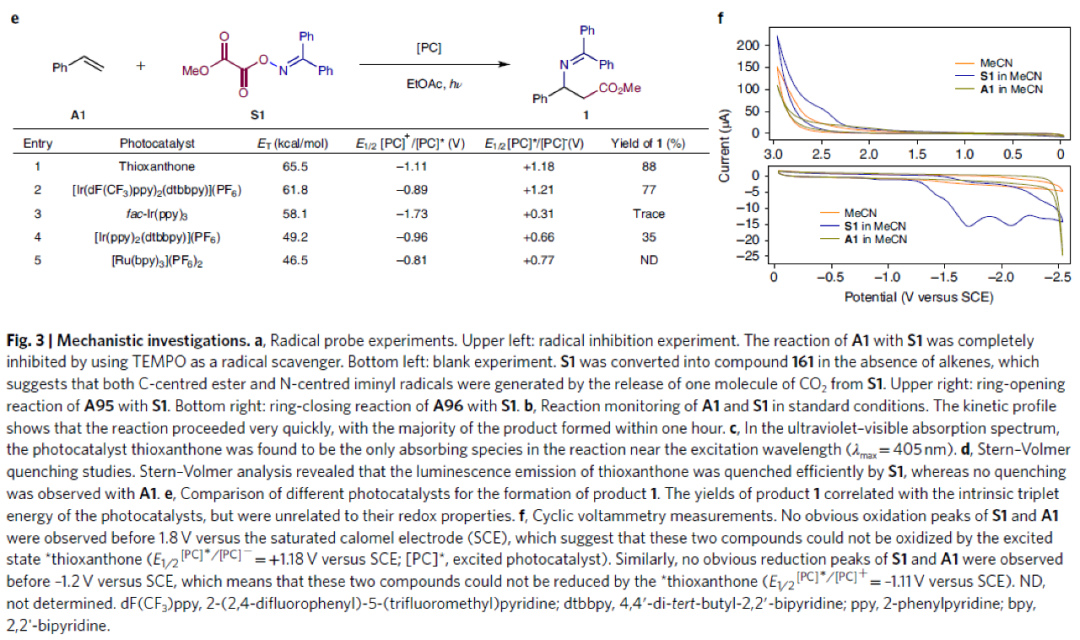
(圖片來源:Nat. Chem.)
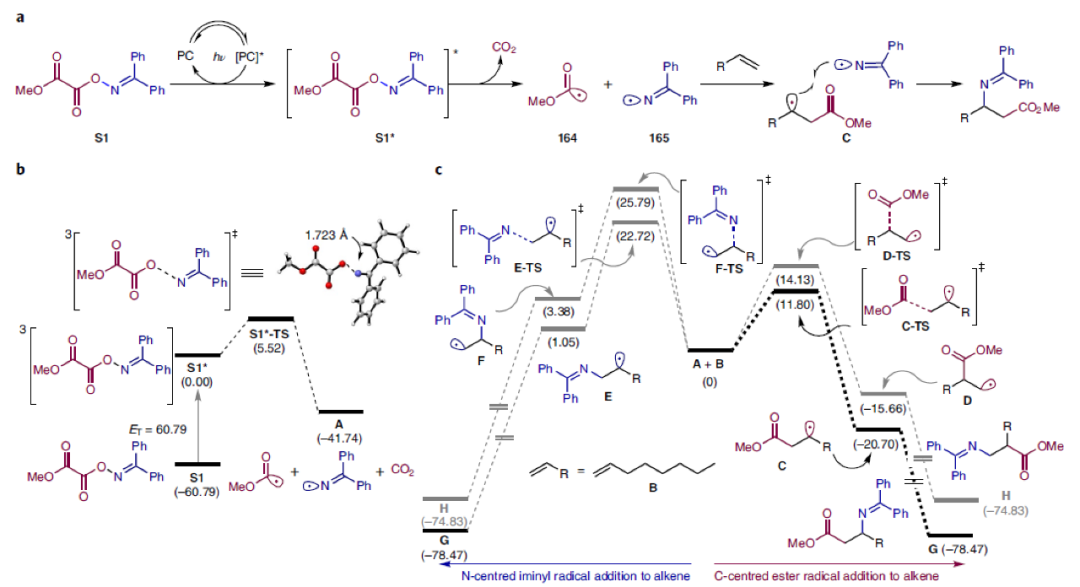
最后,作者通過DFT實驗對機理進行進一步探索(Fig. 4)。S1的三線態能量(60.79 kcal mol–1)足夠與激發態的噻噸酮(ET = 65.5 kcal mol–1)經歷三線態-三線態能量轉移(TTEnT)過程。接著S1*可以經歷N-O鍵的斷裂并釋放CO2(5.5 kcal mol–1)形成碳自由基164和氮自由基165(Fig. 4a, b)。隨后通過對164和165與烯烴自由基加成的四種可能路徑進行比較,作者認為:通過自由基加成過程可以解釋為什么反應具有高區域選擇性(Fig. 4c)。

(圖片來源:Nat. Chem.)
總結
德國明斯特大學Frank Glorius課題組發展了光催化,利用簡單的烯烴或雜芳烴作為起始原料高區域選擇性的實現了分子間的胺基-羧基化反應。此反應條件溫和,無需金屬參與,底物范圍廣,官能團兼容性好,為β-氨基酸和γ氨基酸衍生物的合成提供了新策略。
文獻詳情:

長按或掃碼左側二維碼查看原文
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn