- 首頁
- 資訊
Angew:構建靶向內質網的DNA納米裝置,用于膜結合細胞器中蛋白質的自噬依賴性降解
來源:化學加網原創 2022-09-01
導讀:近日,華東理工大學錢旭紅院士、楊泱泱教授團隊報道了一種通過自噬依賴性途徑,經歷新的細胞內降解的新型DNA納米裝置,該裝置用于特異性捕捉內質網(ER)定位的蛋白質,并將其運輸至溶酶體進行降解。這種DNA納米裝置既能高效降解外源性的ER駐留蛋白(ER-eGFP),又能降解癌細胞中過表達的分子伴侶(葡萄糖調節蛋白78)。文章鏈接DOI: 10.1002/anie.202205509
蛋白質是細胞中最豐富的生物分子,其生物/病理功能與亞細胞定位密切相關。例如,內質網(ER)是一種必不可少的膜結合細胞器(MBO),具有獨特的化學環境,可以在伴侶分子和折疊酶的幫助下進行蛋白質的折疊和修飾。蛋白質的錯誤折疊和異常蛋白質表達可能會引起ER應激,進而引起癌癥和神經退行性疾病。通過采用包括泛素-蛋白酶體系統(UPS)和自噬系統的細胞蛋白質質量控制系統,靶向蛋白降解(TPD)策略已成為具有代表性的蛋白質消除工具。納米材料的最新研究進展提供了大量可以靶向亞細胞區室的候選材料。其中,DNA納米結構因其可編程的自組裝性,廣泛的功能性及高生物相容性,而被認為能夠作為參與疾病治療的治療載體。此外,DNA納米結構已被證實可作為靶向細胞器,生物傳感和細胞凋亡等工具。Krishnan課題組開發了一系列用于檢測細胞器內離子變化的DNA納米裝置。仰大勇團隊報道了一種DNA納米結構,實現了線粒體干擾。然而,其他MBO靶向DNA納米裝置還未有報道。本文描述了一種ER靶向DNA納米結構用于消除大多數癌細胞中ER上過表達的定位蛋白。該文使用肽-寡核苷酸偶聯作為人工膜受體(AMR), AMR可以將自身插入到細胞膜上。隨后,含有AMR互補序列鏈的凹形DNA裝置(cDOS)通過與AMR雜交錨定在細胞表面,開啟cDOS的跨膜攝取。本文證明了AMR引導能夠快速有效的運送cDOS,并且cDOS在體內逃逸后靶向到內質網,隨后經過自噬依賴性的途徑到溶酶體進行降解。基于以上的發現,該課題組提出使用亞細胞靶向cDOS去構建程序化的MBO定位蛋白降解系統,用于調節包括外源性ER-駐留蛋白(ER-eGFP)和內源性過表達分子伴侶(葡萄糖調節蛋白78)在內的蛋白質的豐度(圖1)。
圖1. 靶向內質網的DNA納米裝置,用于降解膜結合細胞系中的蛋白質(圖片來源:Angew. Chem. Int. Ed.)凹形DNA折紙結構(cDOS)由179個短鏈DNA及M13mp18支鏈在四步過程中混合,退火合成。隨后離心三次去除多余的短鏈,最后使用瓊脂糖凝膠電泳和透射電子顯微鏡來分析cDOS(圖2a,b,c)。pH低插入肽(pHLIPs)是在酸性條件下,能夠形成跨膜 a-螺旋并將自身插入細胞膜的一系列相應肽。本文制備了pHLIPs-寡核苷酸偶聯物(pHLIP-ON)作為AMR,并用于cDOS內化。5’-炔烴連接的寡核苷酸與疊氮連接的pHLIP通過銅(Ⅰ)催化疊氮化物-炔烴環加成過程合成pHLIP-ON(圖2d)。
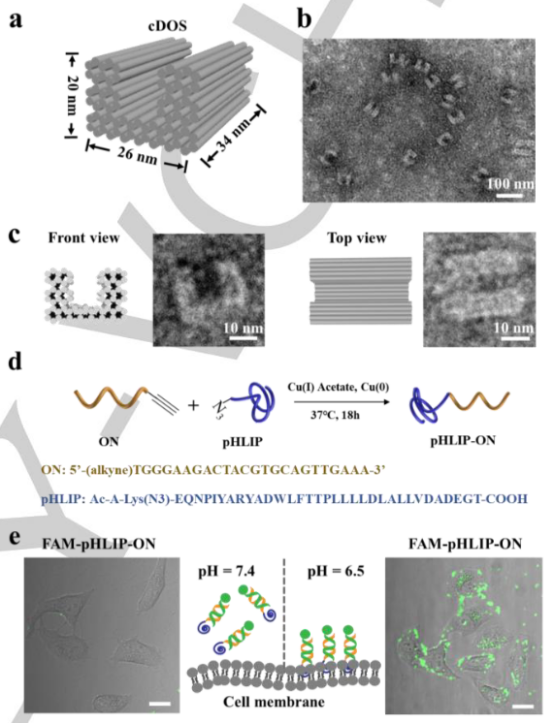
圖2. (a)(b)(c)凹形DNA 折紙結構表征圖,(d) pHLIP-ON 合成過程,(e) FAM-pHLIP-ON 分別在pH=7.4, pH=6.5下細胞膜插入性能(圖片來源:Angew. Chem. Int. Ed.)為了評估pHLIP-ON的膜插入能力,將其與FAM修飾的單鏈DNA(FAM-ssDNA)雜交,形成雙鏈FAM-pHLIP-ON。作者首先優化了培養環境的pH(弱酸性或正常條件下)(圖2e),評估了膜錨定pHLIP-ON用作cDOS內化的AMR向導的潛力。實驗結果表明pHLIP-ON 可以在弱酸性微環境下被作為特定的AMR, 并在雜交時承載cDOS (圖3a,b,c)。隨后,使用定量實時PCR (qPCR)實驗檢測了體系中存在或不存在AMR時,細胞對cDOS的攝取效率。結果顯示,與單獨的cDOS相比,在AMR協助下,細胞內定位過程中cDOS的攝取效率增加了大約18倍(圖3d)。由于低pH是腫瘤細胞的微環境的共同特征之一,因此該策略可能更適用于靶向癌細胞而不是健康細胞。為了證實這一推測,作者選用兩種癌細胞(MCF-7和HepG2)一種健康細胞(DC2.4)來進行驗證。如圖3e,在弱酸性的培養微環境下,cDOS在MCF-7和HepG2細胞中均能觀察到有效內化,而在健康細胞DC2.4細胞內未觀察到內化。
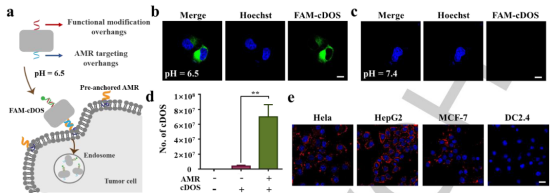
圖3. (a) FAM-cDOS在弱酸性條件下與預錨定AMR雜交,內化示意圖, (b) 弱酸性條件下 (pH=6.5), (c) 正常條件下 (pH=7.4) cDOS的跨膜性能,(d) cDOS 在存在或不存在AMR下,細胞對cDOS攝取效率。(e) cDOS在癌細胞與健康細胞中內化情況(圖片來源:Angew. Chem. Int. Ed.)隨后,實驗確定了cDOS的內吞途徑主要是小窩蛋白依賴性介導途徑。并通過共定位檢測后,確定了cDOS跨膜后的走向。如圖4a,c顯示,cDOS被內吞4到6h后,其主要集中在內質網上。在被內吞6h后,內質網和高爾基體上的cDOS逐漸轉移至溶酶體(圖4b)。并在孵育12h后,cDOS有效的轉移至溶酶體進行降解(圖4d)。實驗證實了cDOS在內吞后,能夠有效的靶向ER,這是DNA納米結構首次在沒有任何亞細胞靶向配體的幫助下顯示出亞細胞靶向能力。
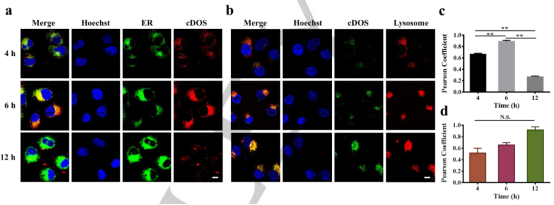
圖4. cDOS在不同時間 (4、6和12小時) 在不同細胞器(ER和溶酶體)中的細胞間運輸情況(圖片來源:Angew. Chem. Int. Ed.)最后,作者選用了包括外源性ER駐留eGFP和內源蛋白(葡萄糖調節蛋白78)兩種ER定位蛋白,分析該系統的可行性及降解效率。實驗結果表明,cDOS介導的蛋白質降解系統可用于自噬-溶酶體途徑進行細胞器定位的蛋白質降解。此外,將該系統與特定的腫瘤微環境響應配體相關聯可以引導和促進細胞器定位蛋白質降解,增強腫瘤選擇性。
錢旭紅院士團隊開發了一種DNA納米裝置,旨在降解MBO定位的蛋白質。這種方法通過DNA納米裝置與蛋白質靶向配體作為彈頭的程序組裝構建,隨后將該組件用于靶向到ER定位的蛋白質上并攜帶它們進行溶酶體降解。該方法表現出外源和內源ER定位蛋白的高降解效率。同時為調節細胞蛋白質的豐度提供了新的見解,并可能加速癌癥治療的發展。
文獻詳情:
Caixia Liu, Bin Wang, Weiping Zhu, Yufang Xu, Yangyang Yang*, Xuhong Qian*, An ER‐targeting DNA Nanodevice for Autophagy‐dependent Degradation of Proteins in Membrane‐bound Organelles. Angew. Chem. Int. Ed. 2022, https://doi.org/10.1002/anie.202205509
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn






