

圖片來源:Nat. Commun.
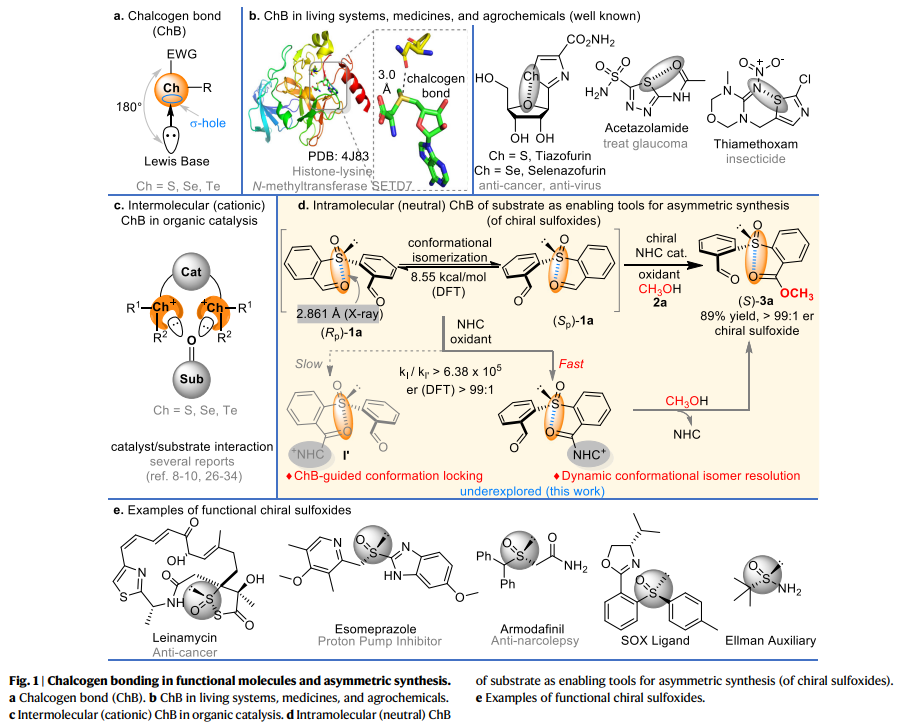
硫族元素鍵(ChB)是硫族元素(S、Se、Te)與路易斯堿之間的一類新型弱非共價相互作用(fig. 1a)。近年來,由于其在生命系統、藥物化學、農藥等領域的特殊作用(fig. 1b),引起人們的廣泛關注。與多種功能分子設計相比,ChB在有機合成中的探索卻十分少見(fig. 1c),可能的原因是,在合成反應中形成催化劑和底物之間的ChB絡合物較為困難。近日,貴州大學的池永貴、鄭鵬程團隊將分子內ChB相互作用用于底物的構象調節和選擇性化學轉化之中。在這項工作中,作者研究了ChB在亞磺酰基二苯甲醛化合物的反應性中的作用,主要是通過分子ChB引導的底物構象異構化來實現NHC催化氧化亞砜的動態動力學拆分(fig. 1d),從而合成了一系列的手性亞砜化合物。作者通過1a的固態X-射線結構分析揭示了底物中硫和氧原子之間存在ChB,而ChB破壞了1a的對稱性,因此使1a這種對稱的亞砜以兩種對映異構體的外消旋混合物形式存在。同時,作者通過DFT計算,兩種異構體互相轉化的活化能為8.55 kcal/mol。值得注意的是,手性亞砜化合物已經廣泛用于藥物、農用化學品以及不對稱催化的配體(fig. 1e),這使該反應合成的產物具有后續應用的可能性。

圖片來源:Nat. Commun.
首先,作者選擇1a作為模型亞砜底物,甲醇2a作為親核試劑來尋找最優反應條件,探索了NHC預催化劑與聯苯醌(DQ)作為氧化劑將1a的一個醛基轉化為酯單元。通過一系列的篩選得到最優條件:使用NHC預催化劑B,以K3PO4為堿,溶劑為CH2Cl2的條件下,產物3a可以達到89%的收率和超過99:1的er值(table 1)。
圖片來源:Nat. Commun.
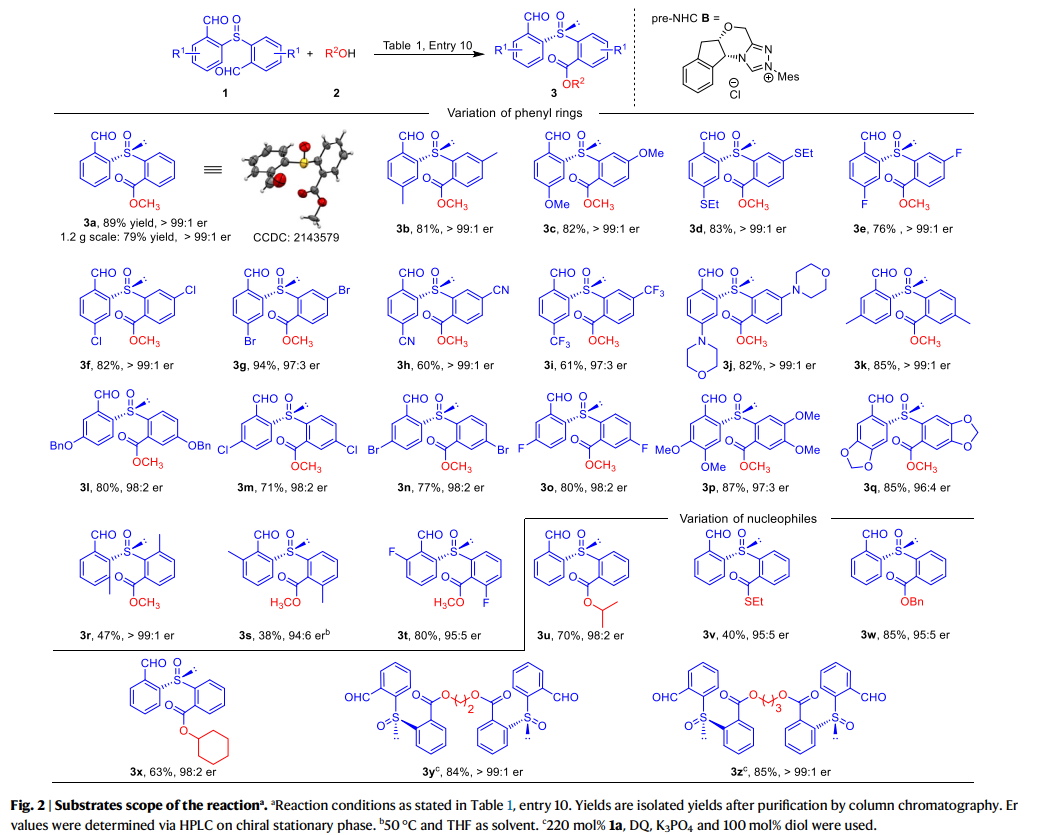
作者接下來對研究反應的普適性進行了考察(fig. 2)。在1a的苯環對位(相對于醛基)更換不同取代基,單酯產物都獲得了優異的er值(3b-3j)。當取代基為甲基(3b)、甲氧基(3c)、乙硫基(3d)或鹵素(3e-3g)時,反應產率良好,相應的產物產率為60-94%。當使用吸電子取代基(例如CN、CF3)時,產物(3h, 3i)的產率略低 (60%和61%),同時保持了優異的er值。其反應主要副產物來自3h和3i的進一步酯化,得到相應的二酯化合物。各種取代基(如Me、OBn和鹵素)也可以在1a苯環上的間位碳上,并不會影響反應產率和er值(3k-3o)。值得注意的是,在1a的對位和間位碳上具有雙取代基的底物同樣具有良好的兼容性(3p, 3q)。當甲基在1a的鄰位時,反應產率和er值卻均有下降(3s)。3s的低產率主要是由于形成二酯,er值下降的原因可能是空間位阻。鄰位的氟取代產物3t,產率為80%,er為95:5。在1a的鄰位碳(相對于亞砜)上甲基取代時會使3r的er值超過99:1,但產率降低到47%。此外,各種醇、硫醇和仲醇也可作為有效的親核試劑(3u-3x)。有趣的是,當二醇用作親核試劑時,兩個羥基都可以被酰化,得到相應的手性二亞砜,具有優異的產率和er值(3y, 3z)。這些結果表明,這種策略可以進一步發展,將手性亞砜連接到含有多個羥基單元的功能分子(如天然產物和聚合物)上。
圖片來源:Nat. Commun.
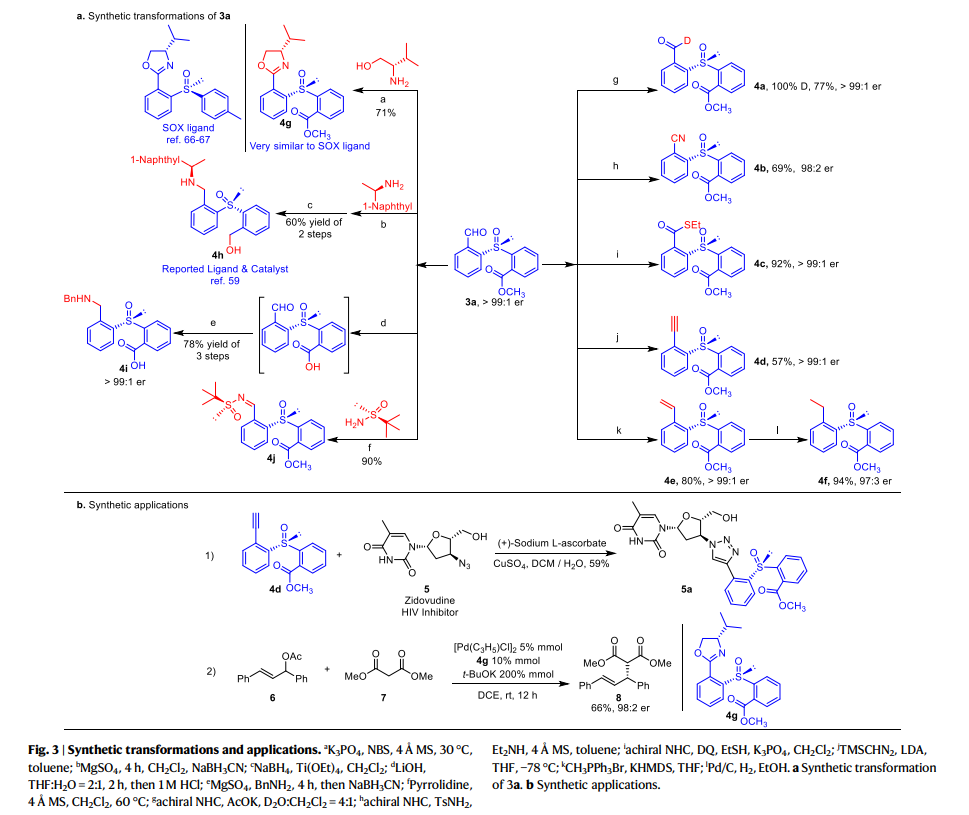
同時,作者還對該反應產物的衍生化應用進行了研究(fig. 3)。首先對3a中的醛基進行進一步的轉化。例如,醛氫在D2O存在下催化氘化得到4a,甲酰基催化的氰化得到4b,硫酯化得到4c,其er值均得到了保持。不僅如此,作者還通過Seyferth-Gilbert反應和Wittig 反應合成了4d和4e,通過對4e還原合成了4f。同時,3a與L-纈氨醇反應生成的噁唑啉4g與SOX配體十分相似。值得注意的是,衍生合成的手性亞砜4h及其類似物是已知不對稱合成中的手性配體和催化劑,其可以很容易地通過還原胺化反應從3a及其類似物合成。此外,3a經歷酯基的水解和與BnNH2的還原胺化可以得到的非天然氨基酸4i,與Ellman助劑縮合可以有效地獲得手性二亞砜產物4j。除產物衍生之外,4d可以與具有疊氮基的抗 HIV 藥物(齊多夫定)綴合,生成 5a。4g則可以作為手性配體,在Pd-催化的烯烴6和丙二酸酯7的取代反應中得到手性控制出色的產物8 (98:2 er)。
圖片來源:Nat. Commun.
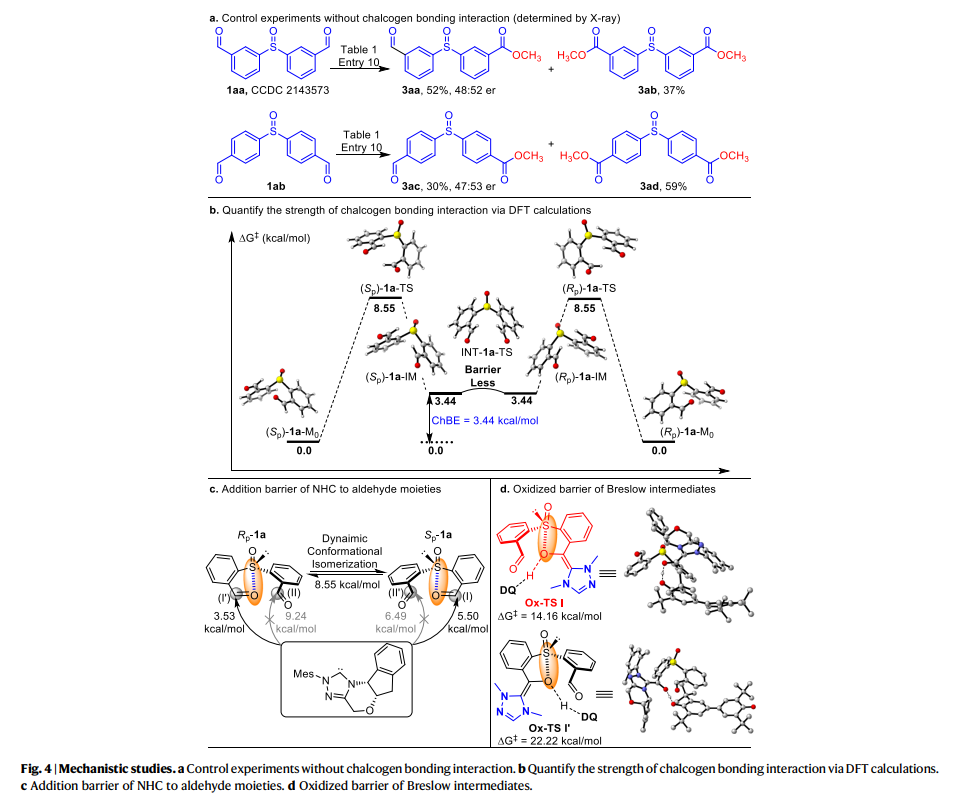
作者還對機理進行了進一步的研究(fig. 4)。作者通過(1aa, 1ab) 的控制實驗表明遠程醛基沒有顯示出ChB相互作用(fig. 4a),使用DFT計算研究了亞砜和甲酰基之間的硫族元素鍵合強度(fig. 4b),發現參與硫屬元素鍵合相互作用的醛基部分是構象鎖定和弱激活的。這些構象鎖定的醛基與NHC催化劑的反應速度(ΔG? = 5.50, 3.53 kcal/mol)比沒有硫屬元素鍵合的醛基(ΔG? = 6.49, 9.24 kcal/mol)更快。同時,低旋轉勢壘表明1a的構象可以在室溫下經歷快速的相互轉化,這使實現NHC催化的動態動力學拆分成為可能。進一步的DFT研究表明,Breslow中間體的氧化步驟(fig. 4d)是手性確定步驟。
總結 池永貴、鄭鵬程團隊報道了一種用于合成手性亞砜的NHC催化的動態動力學拆分反應。該方法利用底物分子中的硫族元素鍵來引導底物的構象異構化,借NHC催化氧化來實現手性亞砜化合物的合成。該反應生成的手性亞砜產物可以作為平臺分子,直接轉化為功能化合物,應用于催化和生物學研究。該反應為反應控制和不對稱合成開辟了一條新途徑。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn