



(圖片來源:J. Am. Chem. Soc.)
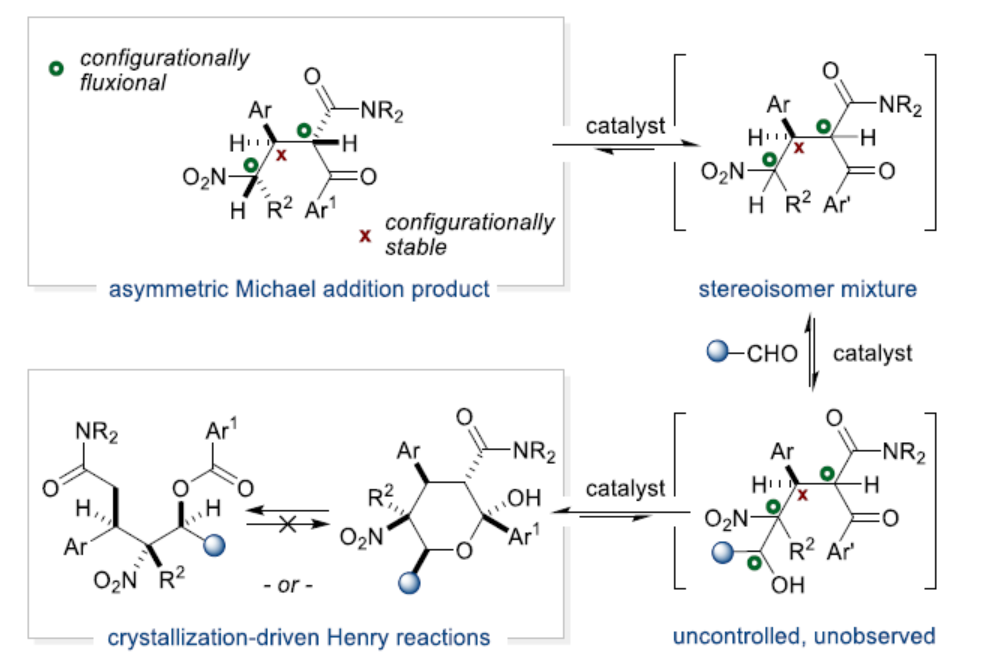
全取代含氮的碳手性中心(fully substituted [N]-bearing carbon stereogenic centers)的手性結(jié)構(gòu)單元廣泛存在于各類天然產(chǎn)物和藥物試劑中。同時,此類化合物的生物活性通常與其絕對構(gòu)型相關(guān)。例如,諾華公司開發(fā)的強效抗瘧藥物NITD609(R-對映異構(gòu)體),其藥效幾乎是其對映異構(gòu)體的10倍。然而,將全取代含氮的碳手性中心引入小分子中仍具有挑戰(zhàn)。堿催化硝基烷烴和羰基親電試劑的偶聯(lián)反應(yīng)(即Henry反應(yīng))是構(gòu)建全取代含氮的碳手性中心的潛在策略,涉及碳-碳鍵的形成,可合成β-氨基醇以及α-羥基羰基化合物,具有100%的原子經(jīng)濟性。然而,大多數(shù)Henry反應(yīng)主要以硝基甲烷作為親核底物(Scheme 1a, scenario 1)。隨著硝基烷前親核試劑的復(fù)雜性增加,反應(yīng)的效率和實用性均會受到影響。為了抑制不需要的縮合產(chǎn)物(Scheme 1a, scenarios 1-2)以及通過retro-aldol反應(yīng)進行的產(chǎn)物分解,必須控制反應(yīng)介質(zhì)的堿度。后者在Scheme 1a的scenarios 3-4中更為嚴重,其中龐大的烷基取代基的空間分布有利于鍵斷裂。為了規(guī)避這些問題,現(xiàn)有的方法通常需要在低溫下進行反應(yīng)并使用過渡金屬催化劑來實現(xiàn)高水平的立體控制。由于這些原因,scenarios 3和4目前尚不完善。
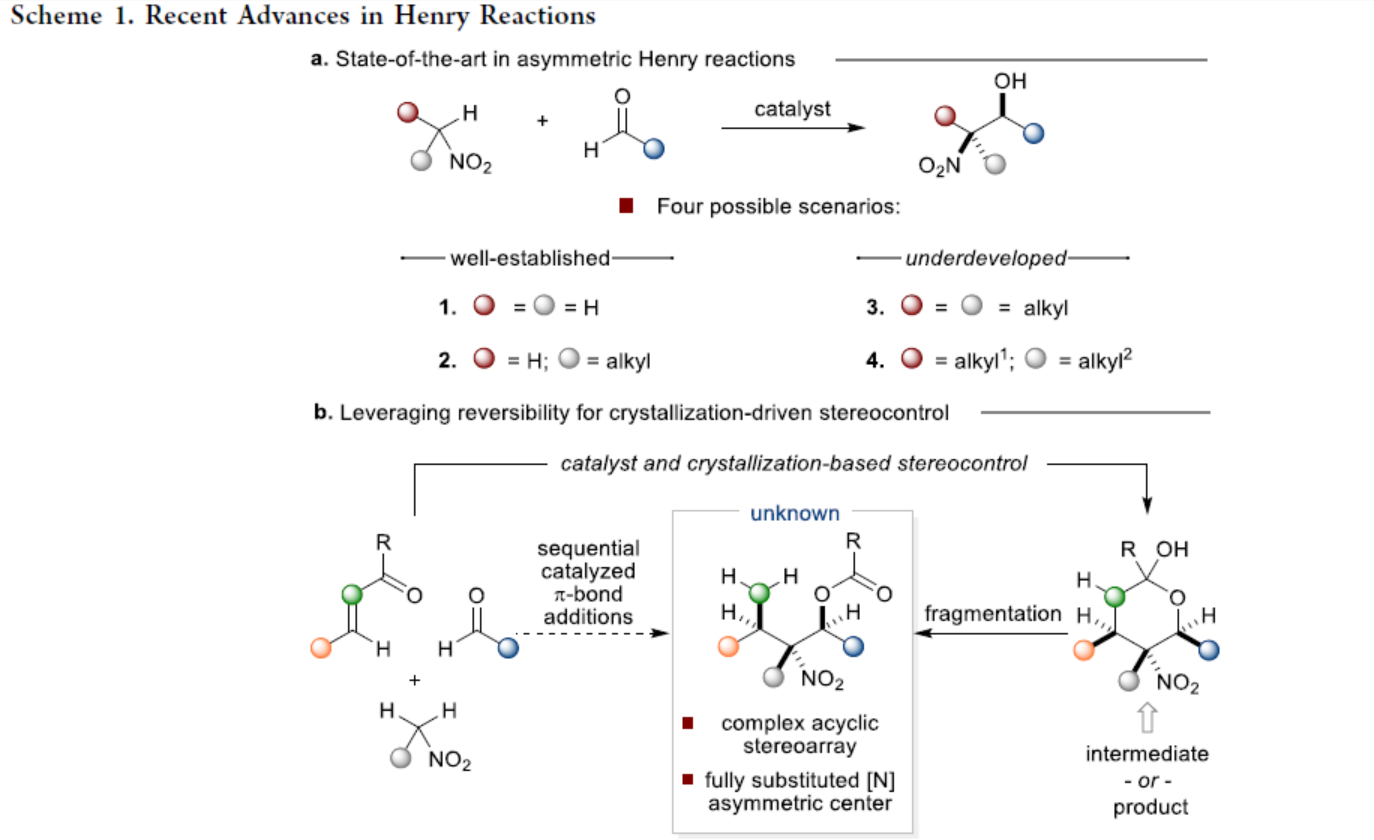
同時,將Henry反應(yīng)用于多組分多米諾反應(yīng)中的關(guān)鍵合成步驟,是解決上述問題的另一種方法。現(xiàn)有方法通常需在低溫下進行反應(yīng)以實現(xiàn)高水平的手性控制,但反應(yīng)時間過長。并且,部分產(chǎn)物的穩(wěn)定性低,導(dǎo)致后處理過程之前需額外的保護步驟。目前為止,僅有兩例通過α,α-取代硝基烷烴構(gòu)建全取代含氮的碳手性中心的反應(yīng),但反應(yīng)的收率以及非對映選擇性適中。在此,Jeffrey S. Johnson課題組提出了一種替代性的策略,即通過簡單的硝基烷與π-親電試劑進行串聯(lián)親核加成,生成了全取代含氮的碳手性中心的的有機結(jié)構(gòu)單元(Scheme 1b)。
(圖片來源:J. Am. Chem. Soc.)
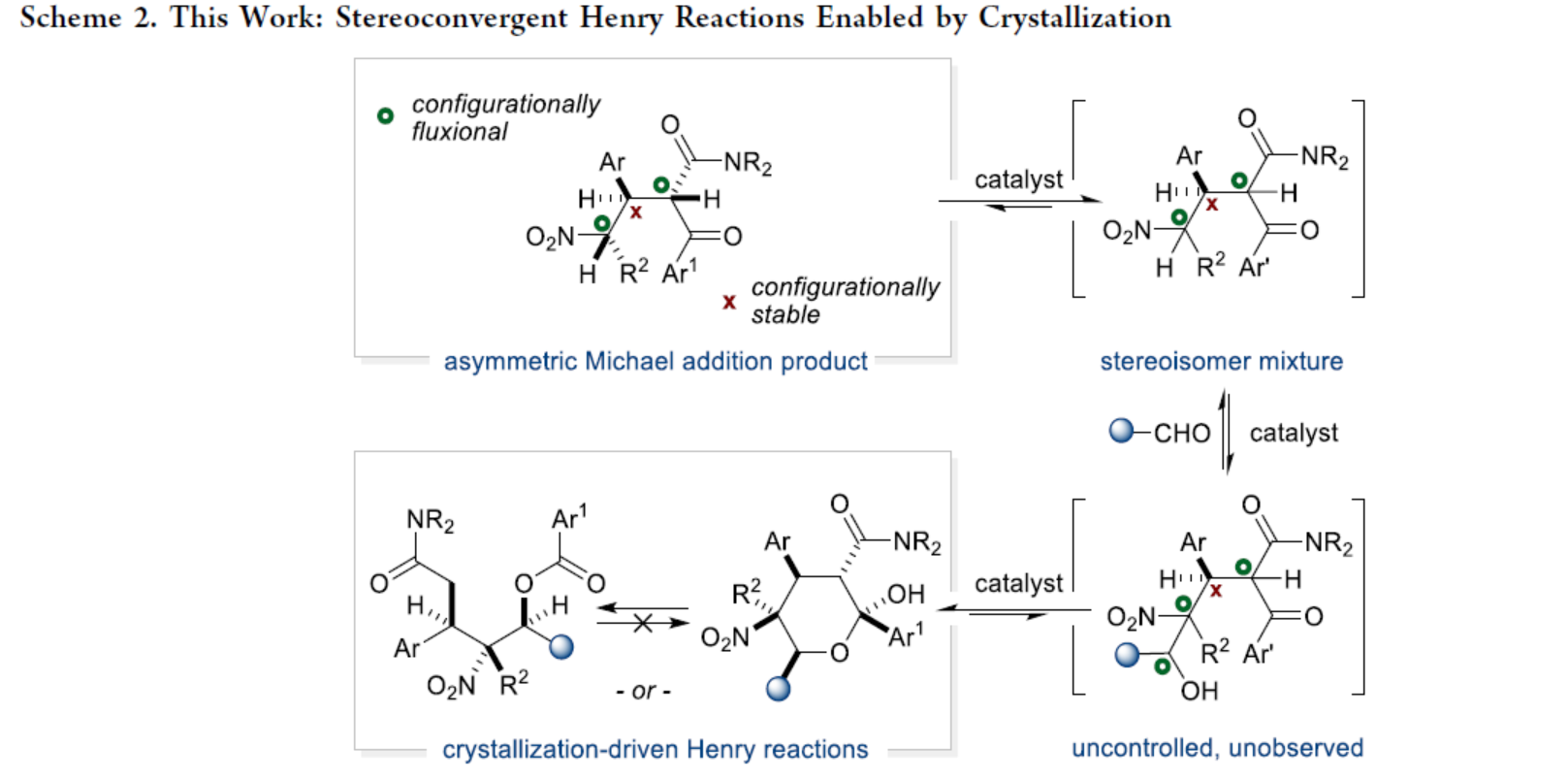
Jeffrey S. Johnson課題組報道了一種晶態(tài)(Crystallization)促進手性匯聚Henry反應(yīng),合成了一系列吡喃半縮酮衍生物以及苯甲酸酯衍生物(Scheme 2)。其中,該反應(yīng)具有操作簡單,反應(yīng)無需額外的保護步驟,且反應(yīng)僅需常規(guī)的過濾分離操作。
(圖片來源:J. Am. Chem. Soc.)
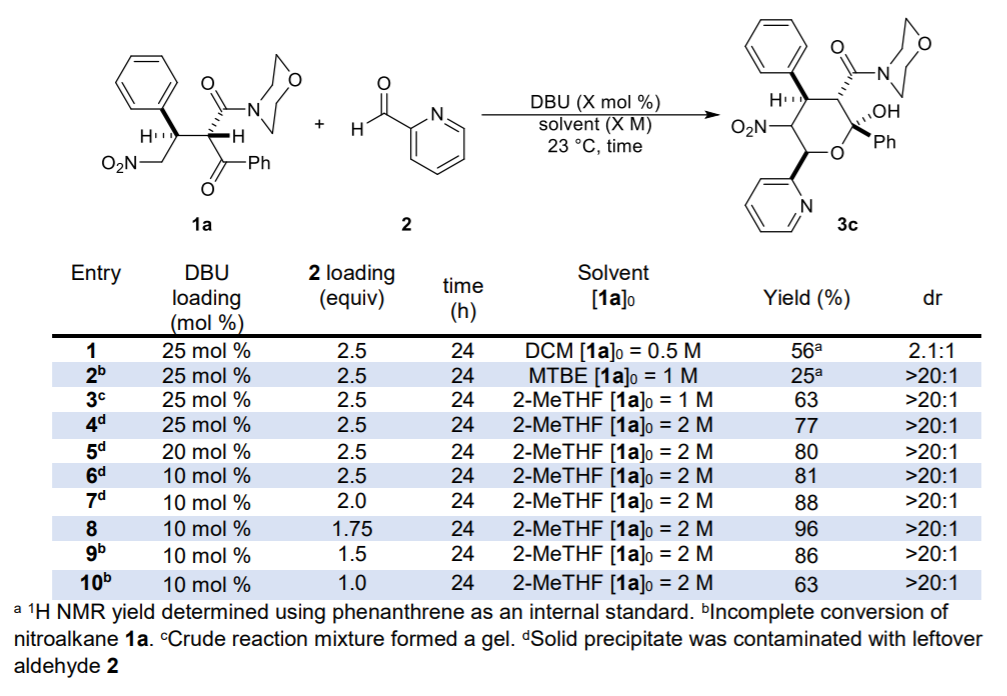
首先,作者以硝基烷烴1a與吡啶醛2作為模型底物,進行了相關(guān)反應(yīng)條件的篩選。當(dāng)使用0.1當(dāng)量的DBU,1.75當(dāng)量的吡啶醛2,在2-MeTHF溶劑中23 oC反應(yīng)24 h,可以96%的收率得到吡喃半縮酮產(chǎn)物3c,dr > 20:1。其中,醚類溶劑對于產(chǎn)物的單一非對映異構(gòu)體的選擇性結(jié)晶至關(guān)重要。
(圖片來源:J. Am. Chem. Soc.)
在獲得上述最佳反應(yīng)條件后,作者對單取代硝基烷的Henry反應(yīng)的底物范圍進行了擴展(Table 1)。研究表明,當(dāng)醛底物的R1為含有鹵素的芳基、吡啶基、苯乙烯基和苯乙炔基時,均可順利與1aa-1bb反應(yīng),獲得相應(yīng)的吡喃半縮酮產(chǎn)物3a-3f,收率為77-94%,dr > 20:1。值得注意的是,反應(yīng)僅需通過單次過濾分離,即可獲得所需的吡喃半縮酮產(chǎn)物,無需進一步純化。
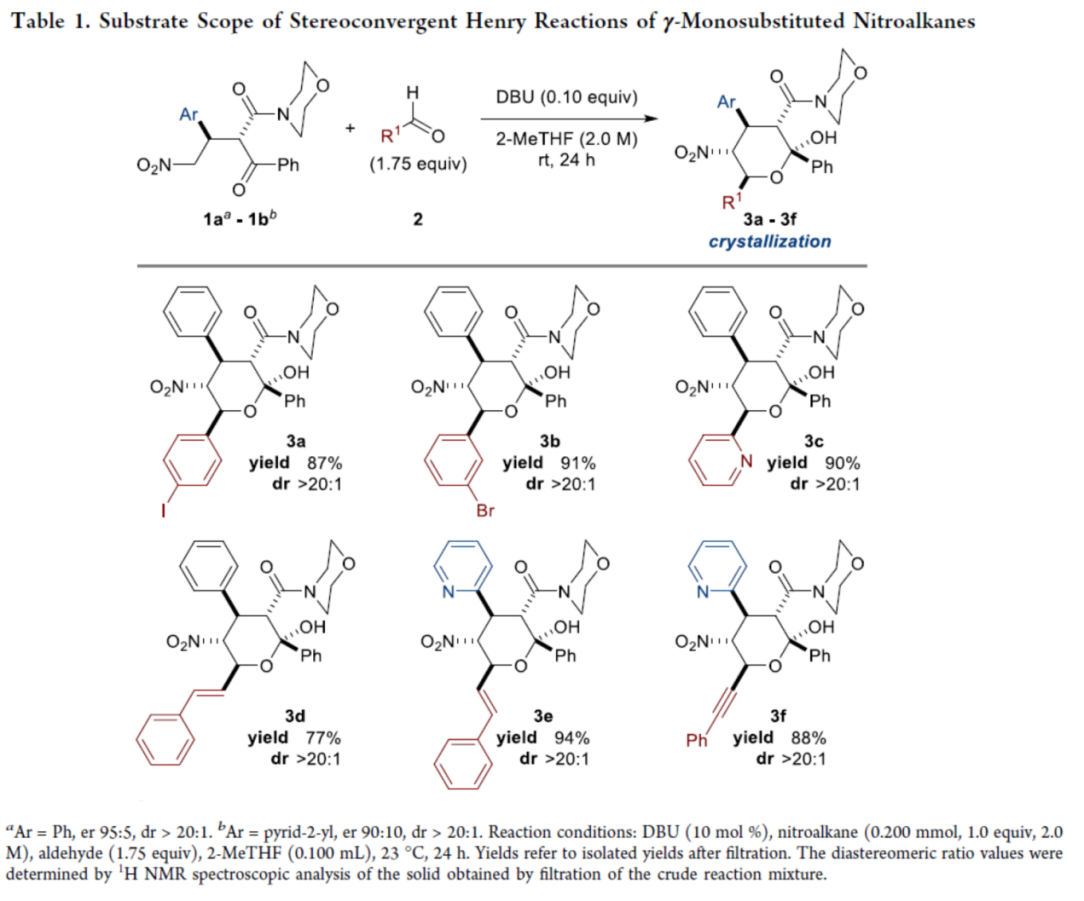
(圖片來源:J. Am. Chem. Soc.)
同時,使用廉價的原料,通過簡單的四步反應(yīng),可合成吡喃半縮酮產(chǎn)物3a,且無需柱色譜分離,從而進一步證明了反應(yīng)的實用性(Scheme 3)。

(圖片來源:J. Am. Chem. Soc.)
隨后,作者對雙取代硝基烷的Henry反應(yīng)的底物范圍進行了擴展(Table 2)。通過對反應(yīng)條件的再次優(yōu)化后發(fā)現(xiàn),當(dāng)使用0.25當(dāng)量的DBU,2.5當(dāng)量的醛,在2-MeTHF溶劑中室溫反應(yīng)48 h,可使反應(yīng)順利進行。同時,當(dāng)醛底物的R1為含有鹵素的芳基、吡啶基、苯乙烯基和苯乙炔基時,均可順利與1c反應(yīng),獲得相應(yīng)的吡喃半縮酮產(chǎn)物4a-4d,收率為77-95%,dr > 20:1。其次,當(dāng)?shù)孜?strong style=";padding: 0px;outline: 0px;max-width: 100%;box-sizing: border-box !important;overflow-wrap: break-word !important">1中的Ar1為N-甲基吡咯基、含有氰基與鹵素取代的芳基,獲得相應(yīng)的吡喃半縮酮產(chǎn)物4e-4g,收率為84-90%,dr > 20:1。當(dāng)?shù)孜?strong style=";padding: 0px;outline: 0px;max-width: 100%;box-sizing: border-box !important;overflow-wrap: break-word !important">1中的Ar2為含有三氟甲基取代的芳基,獲得相應(yīng)的吡喃半縮酮產(chǎn)物4h-4i,收率為85-93%,dr > 20:1。同時,含有哌啶酰胺單元的底物1,也是合適的底物,獲得相應(yīng)的吡喃半縮酮產(chǎn)物4j,收率為93%,dr > 20:1。此外,在某些情況下,硝基烷的γ-位的甲基取代會導(dǎo)致吡喃半縮酮在溫和條件下發(fā)生retro-aldol裂解,獲得相應(yīng)的無環(huán)苯甲酸酯產(chǎn)物5a-5e,收率為73-96%,dr > 20:1。值得注意的是,在比較4i和5d時,僅通過改變酮的特性,就可選擇性地獲得苯甲酸酯產(chǎn)物,且完全優(yōu)于吡喃半縮酮產(chǎn)物。
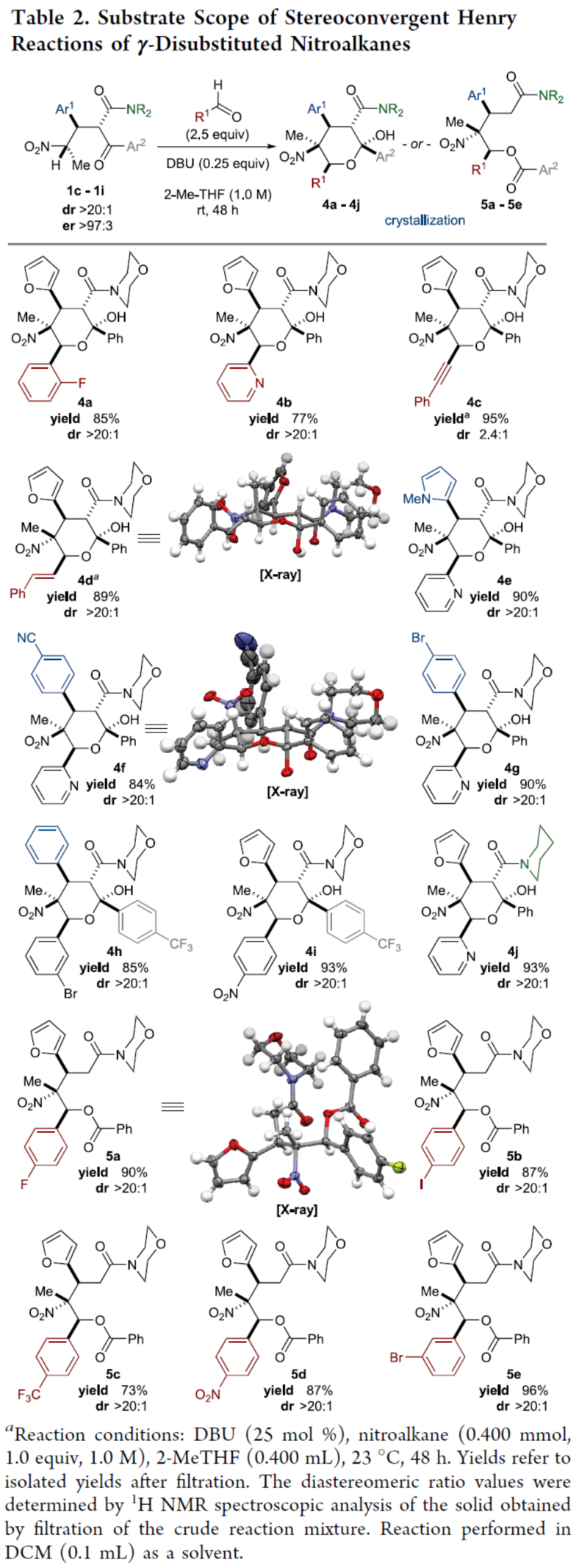
(圖片來源:J. Am. Chem. Soc.)
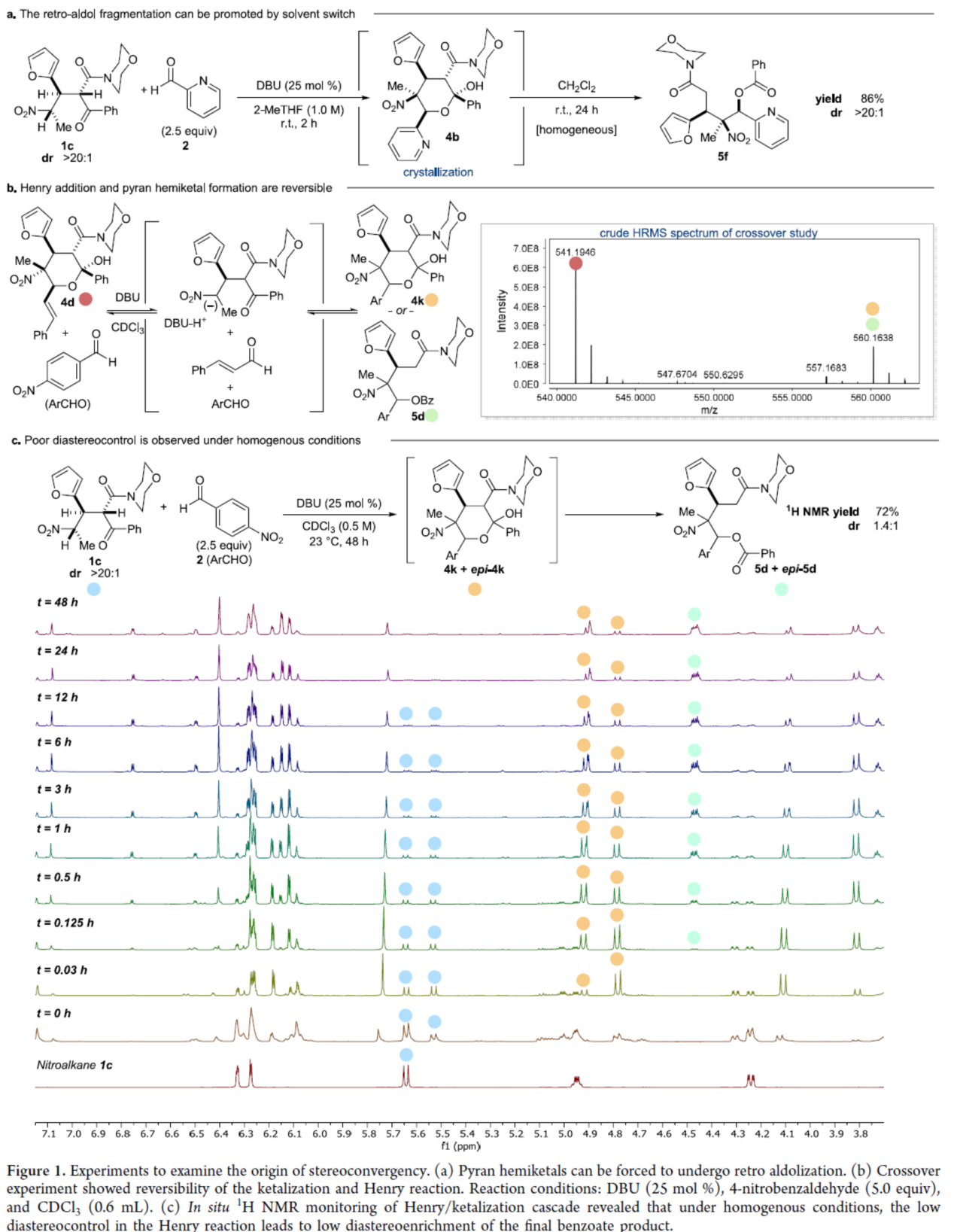
緊接著,作者對反應(yīng)的機理進行了研究(Figure 1)。首先,通過原位斷裂實驗(situ fragmentation experiment)表明,吡喃半縮酮產(chǎn)物可被迫進行逆羥醛縮合反應(yīng)(retro aldolization)(Figure 1A)。其次,通過交叉反應(yīng)研究表明,溶液中Henry/縮酮化(ketalization)步驟的可逆性,與從平衡的非對映體混合物中選擇性的結(jié)晶相結(jié)合,對于實現(xiàn)高水平的非對映體控制是必要的(Figure 1B)。此外,通過Henry/縮酮化串聯(lián)的原位1H NMR研究表明,在均相條件下,Henry反應(yīng)中的低非對映控制導(dǎo)致最終苯甲酸酯產(chǎn)物的非對映富集率低(Figure 1C)。同時,結(jié)晶不僅簡化了所需產(chǎn)物的分離,而且對于形成全取代含氮的碳手性中心的Henry反應(yīng)中的高水平手性控制也至關(guān)重要。
最后,作者對反應(yīng)的實用性進行了研究(Scheme 4)。首先,克級規(guī)模實驗,可以87%的收率獲得苯甲酸酯產(chǎn)物5a(dr > 20:1),以89%的收率獲得吡喃半縮酮產(chǎn)物4d(dr > 20:1)(Scheme 4a)。其次,吡喃半縮酮產(chǎn)物4d可進行多種轉(zhuǎn)化,如疊氮化(6a)、還原(6b和6c)、還原環(huán)化(6d)以及氰化(6e)反應(yīng)(Scheme 4b),且反應(yīng)過程中的非對映選擇性不受影響。此外,苯甲酸酯產(chǎn)物5a經(jīng)還原性內(nèi)酰胺化,可一步合成具有價值的γ-內(nèi)酰胺化合物6g(Scheme 4c)。
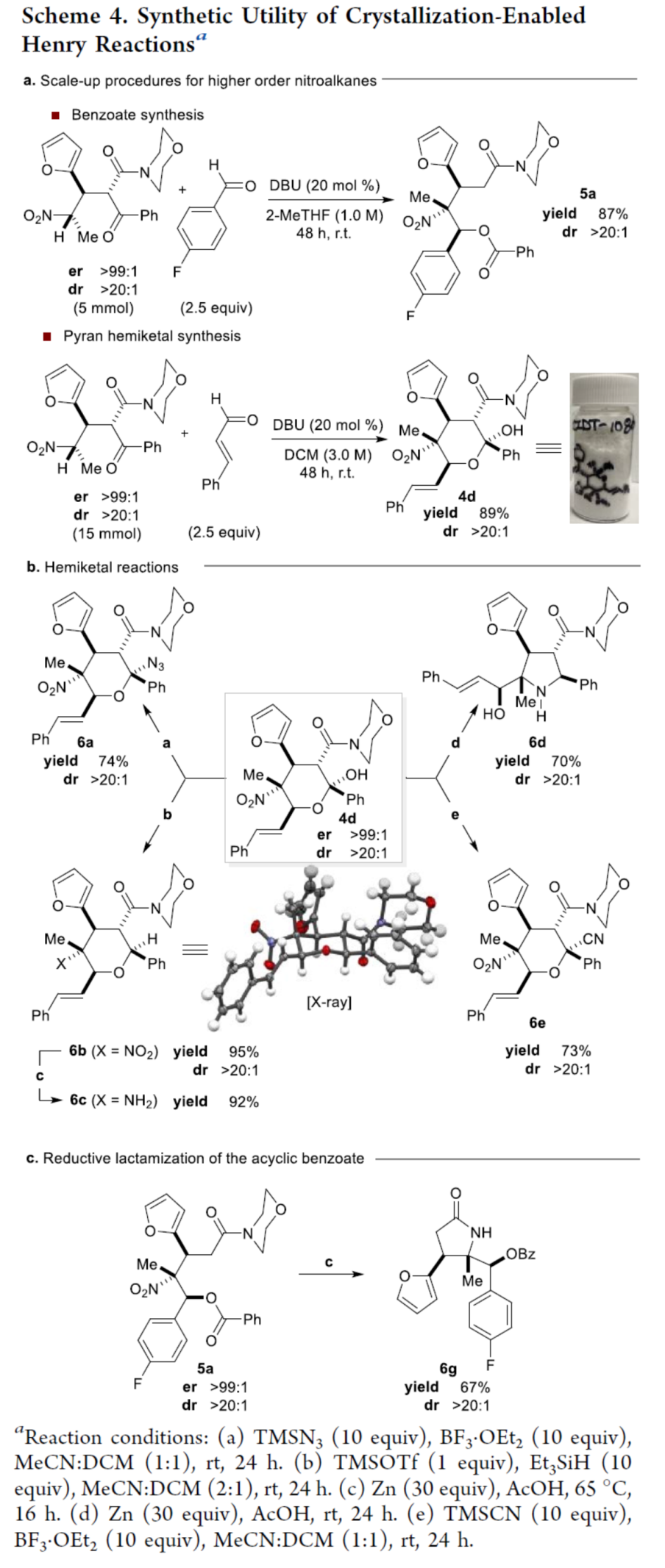
(圖片來源:J. Am. Chem. Soc.)
總結(jié) 美國北卡羅來納大學(xué)教堂山分校Jeffrey S. Johnson課題組報道了一種晶態(tài)促進手性匯聚Henry反應(yīng),合成了一系列吡喃半縮酮衍生物以及苯甲酸酯衍生物。其中,該反應(yīng)具有操作簡單,反應(yīng)無需額外的保護步驟,且反應(yīng)僅需常規(guī)的過濾分離操作。此外,通過后期衍生化實驗,可進一步轉(zhuǎn)化為相應(yīng)的四氫吡喃、疊氮化物、腈、1,2-氨基醇和γ-內(nèi)酰胺衍生物。原位反應(yīng)監(jiān)測實驗表明,反應(yīng)的非對映選擇性是由結(jié)晶的熱力學(xué)控制。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn