

正文
羰基葉立德作為一種高活性的有機合成中間體被廣泛應用于氧雜環骨架的構建,其中金屬卡賓與羰基化合物的環氧化反應作為一種構筑環氧乙烷骨架的有效手段,自從2001年由Michael P. Doyle教授首次系統報道以來引起了化學家們極大的研究興趣。然而,該領域的不對稱催化問題長期以來沒有得到很好的解決,究其原因主要是原位生成的羰基葉立德中間體上的金屬催化劑的解離速度遠遠快于環化速度。因此,直接通過金屬催化劑上的手性配體來調控產物的立體選擇性極具挑戰性(圖1a)。
近日,葉龍武教授課題組基于先前課題組有關銅催化1,5-二炔不對稱環化反應(J. Am. Chem. Soc. 2019, 141, 16961; J. Am. Chem. Soc. 2020, 142, 7618; Chem. Sci. 2021, 12, 9466; Angew. Chem. Int. Ed. 2022, 61, e202115554)的研究基礎,以廉價金屬銅作為催化劑,以上海有機所唐勇院士課題組發展的帶有大位阻邊臂的雙噁唑啉作為手性配體,通過遠程立體化學控制策略,成功實現了1,5-二炔與羰基化合物經由羰基葉立德中間體的不對稱環化反應,并且在該工作中首次實現了烯基陽離子對羰基的捕獲(圖1b)。
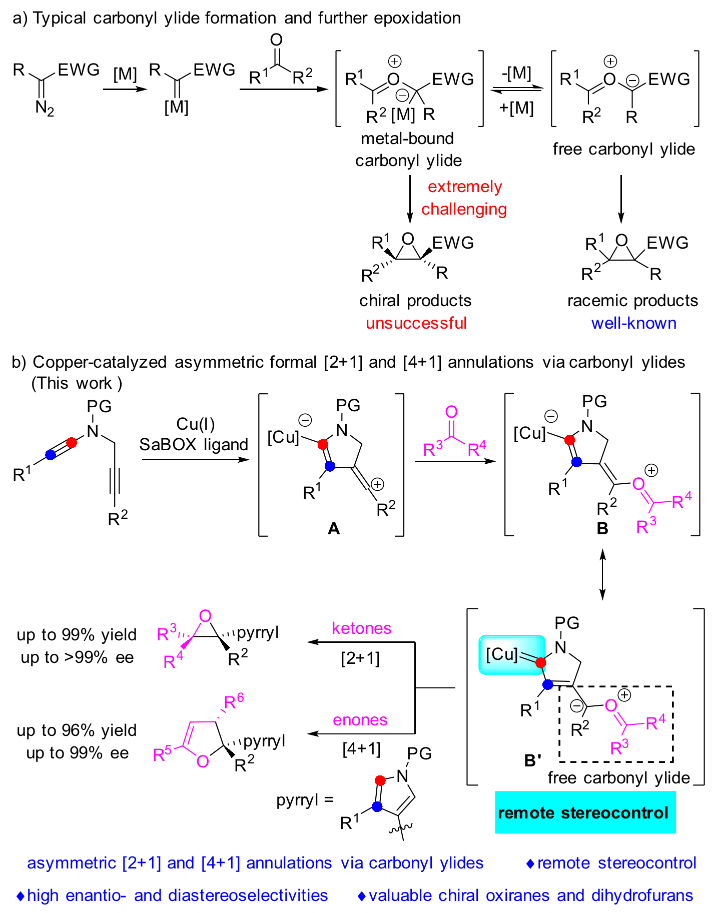
圖1. 經由羰基葉立德的環氧化反應(圖片來源:Angew. Chem. Int. Ed.)
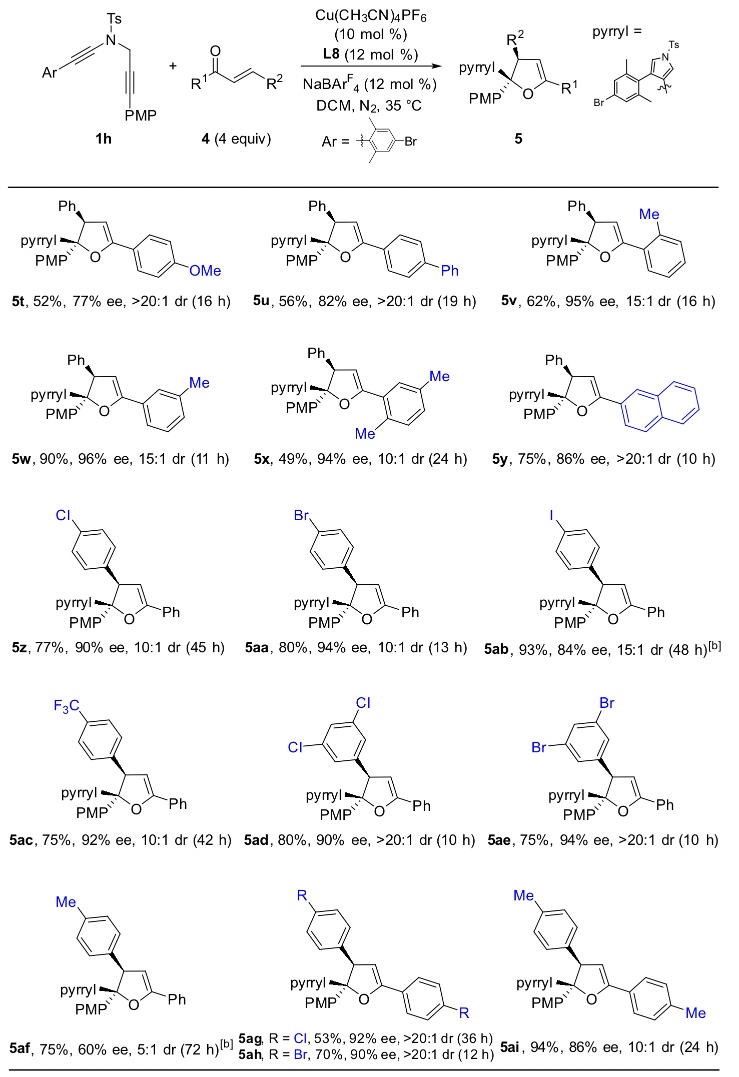
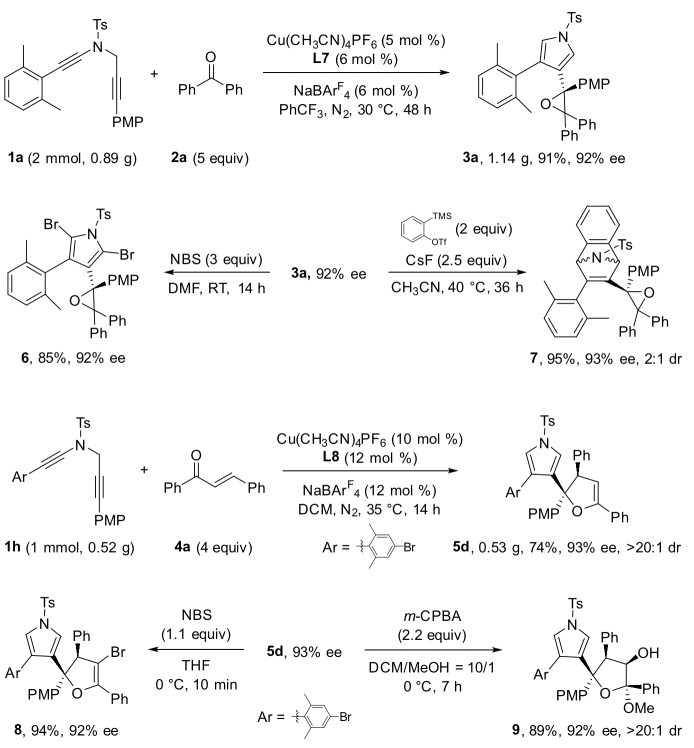
作者通過條件篩選發現,大位阻的雙噁唑啉配體對提高產物的對映選擇性和非對映選擇性至關重要,在最優反應條件下,1,5-二炔與芳基芳基酮反應能以中等到優秀的收率和對映選擇性實現具有高挑戰性的手性四取代環氧化合物的不對稱合成,特別是對于非對稱的芳基芳基酮也能以優秀的收率、對映和非對映選擇性得到含有連續兩個手性季碳中心的四芳基取代環氧化合物(圖 2,圖3)。
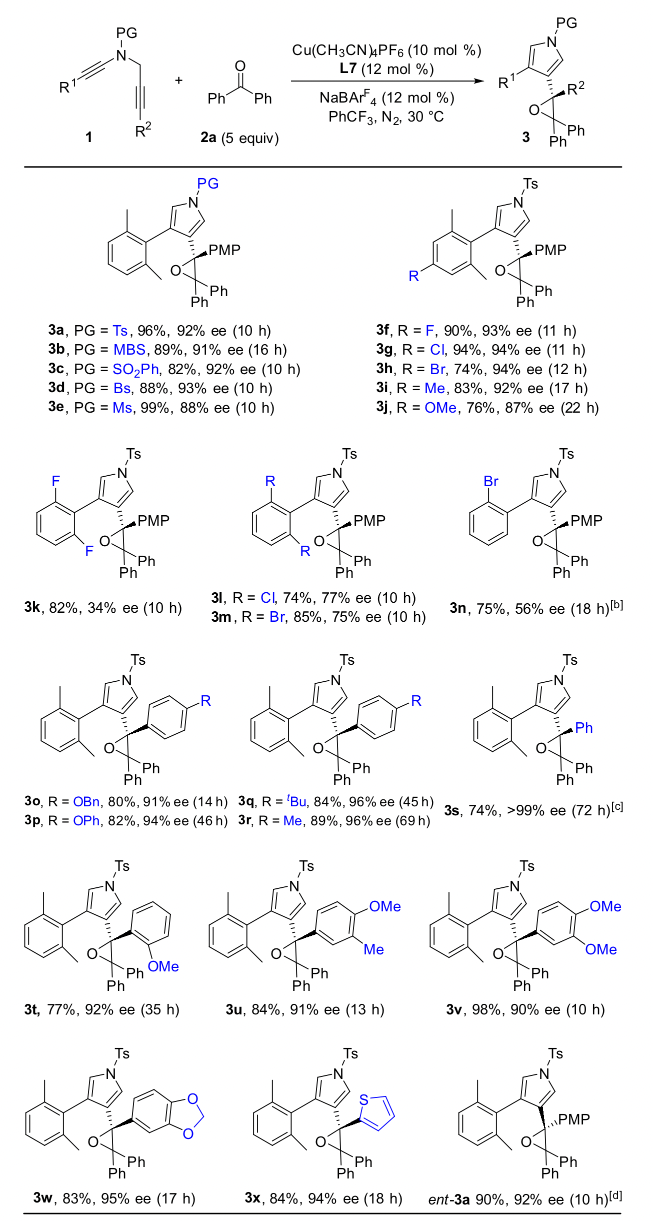
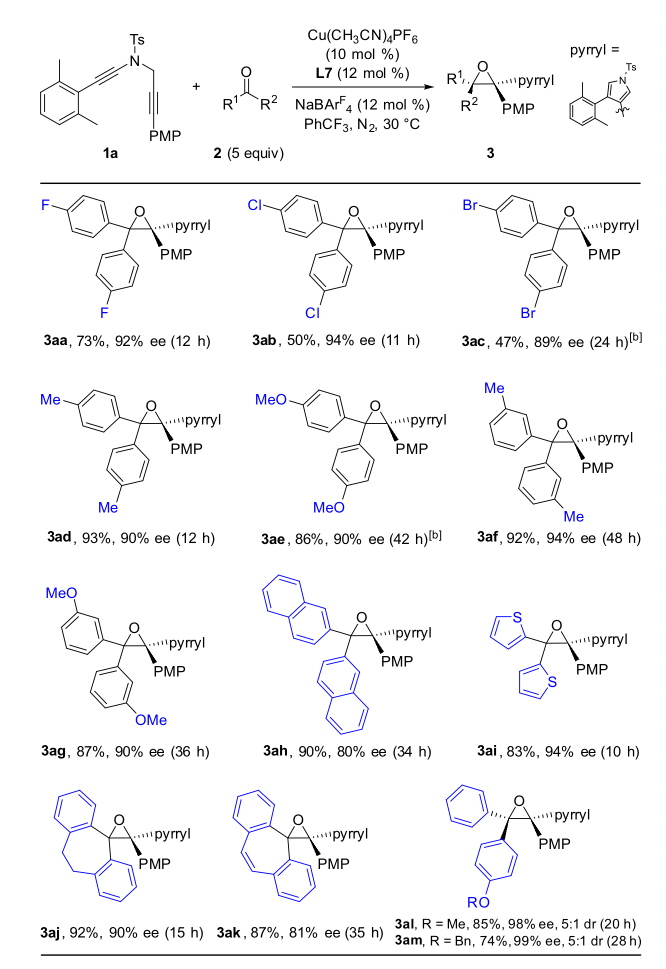
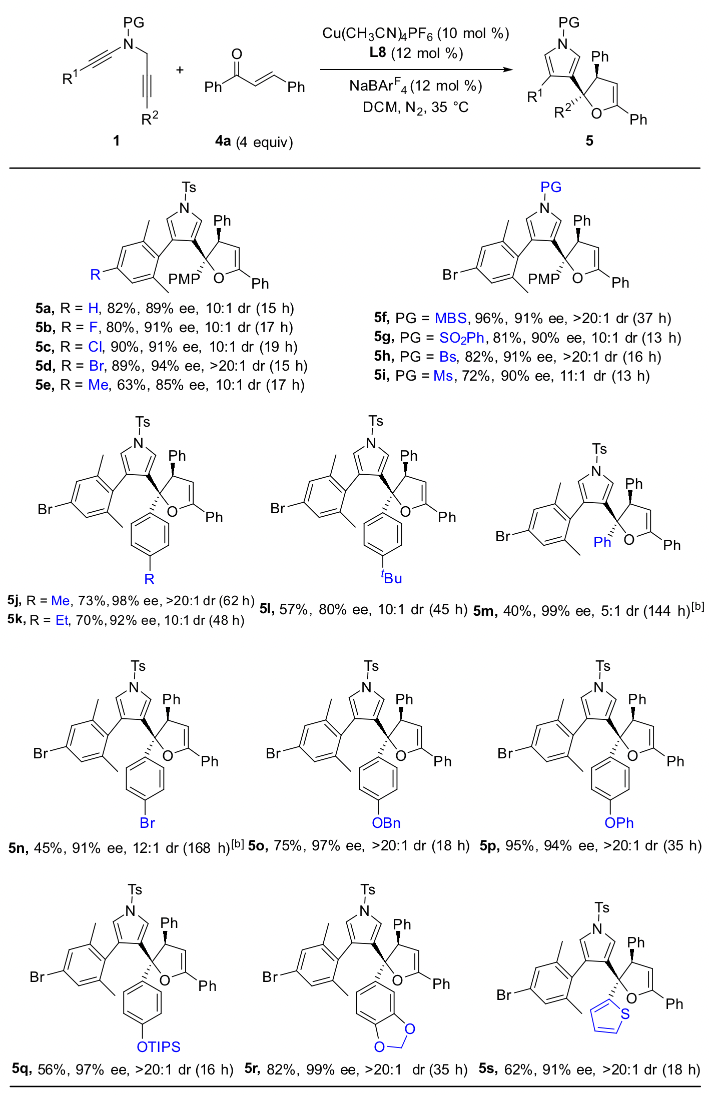
總結
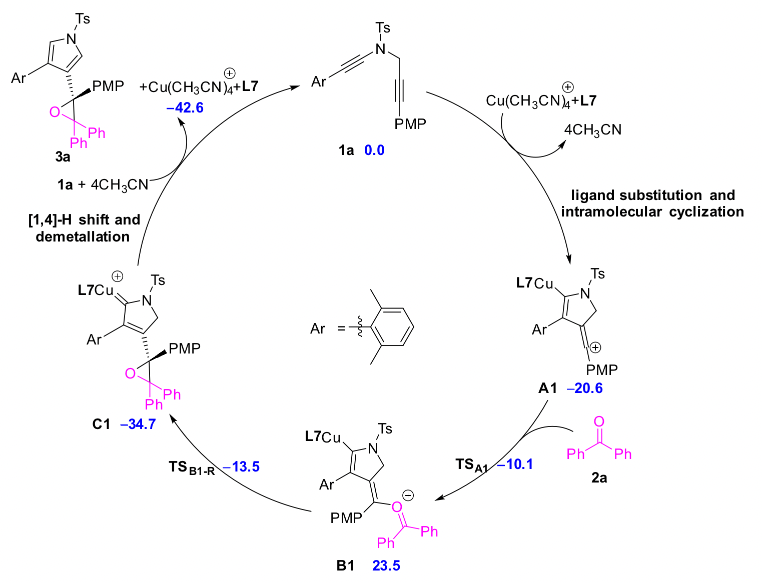
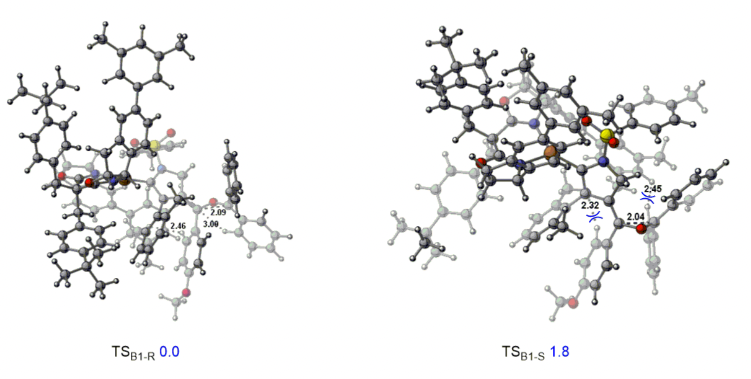
廈門大學葉龍武教授課題組在前期有關銅催化1,5-二炔不對稱環化反應的基礎上,通過遠程立體化學控制策略避免了金屬的解離,從而順利實現了銅催化1,5-二炔與羰基化合物經由羰基葉立德中間體的不對稱環化反應,多樣性和原子經濟性的得到了手性四取代環氧乙烷和二氫呋喃類化合物,另一方面,該反應的實現也為基于烯基陽離子的不對稱轉化提供了新思路。最后,作者通過密度泛函理論(DFT)計算,進一步明析了該類反應的機理和不對稱控制模式。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn