



(圖片來源:Angew. Chem. Int. Ed.)
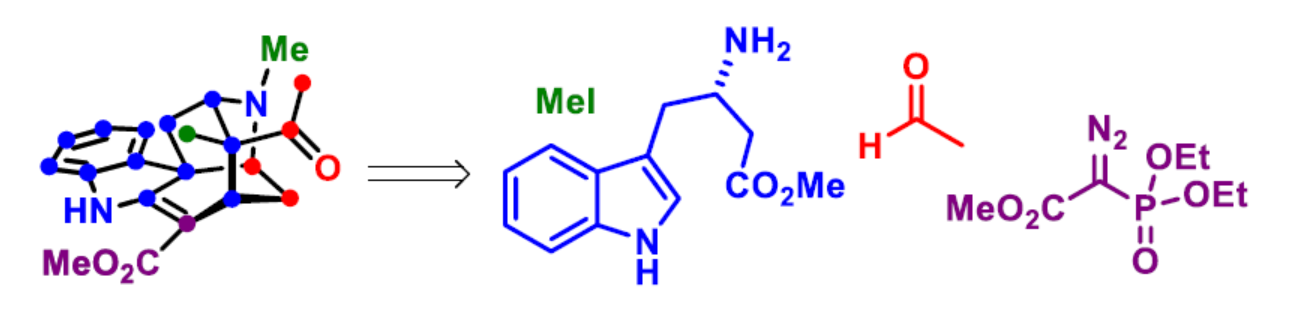
Drak2(DAP激酶相關(guān)的凋亡誘導(dǎo)蛋白激酶2)是一種參與調(diào)節(jié)不適當(dāng)T細(xì)胞活化的信號分子。它的抑制作用可促進(jìn)小鼠對自身免疫的抵抗力,同時不會削弱它們對病毒和細(xì)菌感染的免疫反應(yīng)。由于Drak2在腫瘤發(fā)生中沒有作用,它可能是一種選擇性和有前途的藥物靶點(diǎn),可對抗自身免疫性疾病,且不會增加病毒/細(xì)菌感染或腫瘤發(fā)展的風(fēng)險。然而,小分子Drak2抑制劑仍非常稀缺。2019年,化學(xué)家們從Alstonia Scholaris中分離出一種新型單萜吲哚生物堿alstonlarsine A(1),并在微摩爾范圍內(nèi)具有Drak2抑制活性(Figure 1)。其中,alstonlarsine A(1)具有9-氮雜三環(huán)[4.3.1.0]癸烷骨架以及五個手性中心(其中兩個是季碳手性中心)。近日,貝爾格萊德大學(xué)Zorana Ferjancic與Filip Bihelovic團(tuán)隊(duì)報道了(+)-alstonlarsine A(1)的對映選擇性全合成。
(圖片來源:Angew. Chem. Int. Ed.)
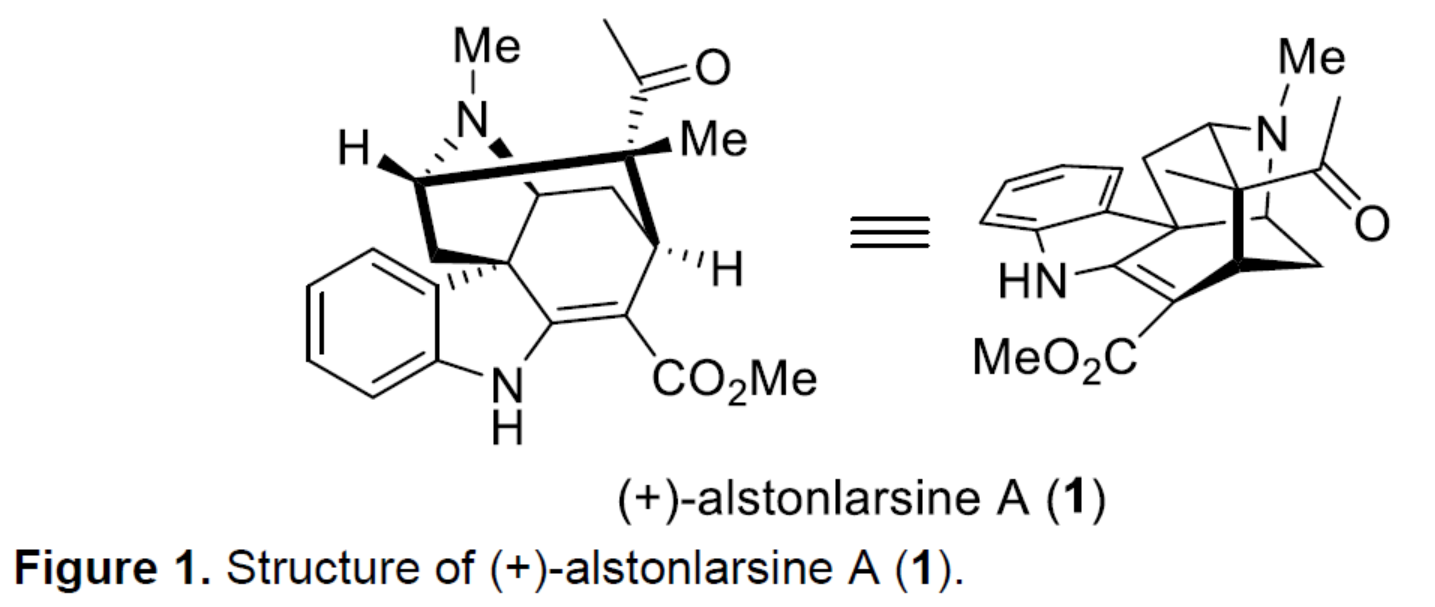
首先,作者對(+)-alstonlarsine A(1)進(jìn)行了逆合成分析(Scheme 1)。(+)-alstonlarsine A(1)可通過烯胺衍生物2經(jīng)分子內(nèi)的Diels-Alder環(huán)加成反應(yīng)生成。同時,三環(huán)仲胺3與乙醛的縮合可原位生成烯胺衍生物2,從而引發(fā)分子內(nèi)反電子需求(inverse-electron-demand)的去芳構(gòu)化Diels-Alder環(huán)加成反應(yīng)。作者認(rèn)為,通過多米諾串聯(lián)反應(yīng)可一步構(gòu)建(+)-alstonlarsine A(1)中的兩個新環(huán)、一個C-N鍵、兩個C-C鍵和三個新的手性中心。三環(huán)仲胺3中的環(huán)庚烯單元,可通過吲哚衍生物5的C(2)-H鍵官能團(tuán)化以及隨后分子內(nèi) Horner-Wadsworth-Emmons(HWE)反應(yīng)合成。具有季碳手性中心的吲哚衍生物5,可通過光學(xué)純的β-高色氨酸(β-homotryptophan)衍生物6經(jīng)非對映選擇性烷基化/aldol加成反應(yīng)獲得。
(圖片來源:Angew. Chem. Int. Ed.)
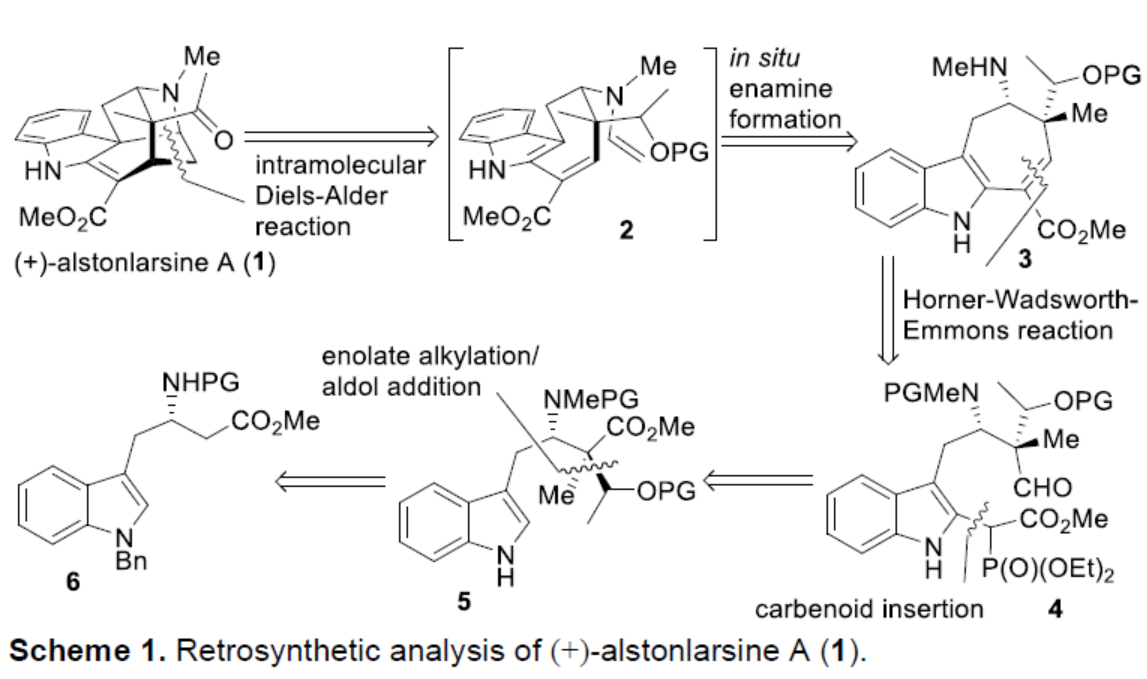
根據(jù)β-氨基酸衍生物進(jìn)行非對映選擇性α-烷基化的相關(guān)研究,作者認(rèn)為N-Tosyl-β-高色氨酸甲酯(6-Ts)是α-烷基化/aldol加成串聯(lián)過程的有效底物。雖然,6-Ts可在茍刻條件下(LDA、HMPA、MeI)順利進(jìn)行α-甲基化反應(yīng),但隨后6-Me-Ts與乙醛進(jìn)行aldol反應(yīng)時,反應(yīng)失敗(Scheme 2, part A)。經(jīng)過大量的研究后發(fā)現(xiàn),此類反應(yīng)需使用一些不易進(jìn)行β-消除且空間要求較低的底物,如高色氨酸β-內(nèi)酰胺衍生物7(Scheme 2, part B)。底物7可在較溫和的條件下順利進(jìn)行甲基化反應(yīng),以幾乎定量的收率獲得甲基化中間體8。中間體8可與乙醛進(jìn)行aldol反應(yīng),生成具有季碳手性中心的中間體9,且具有出色的非對映選擇性。隨后,中間體9中的羥基保護(hù)以及N-保護(hù)基的交換后,可獲得克級中間體11。
(圖片來源:Angew. Chem. Int. Ed.)
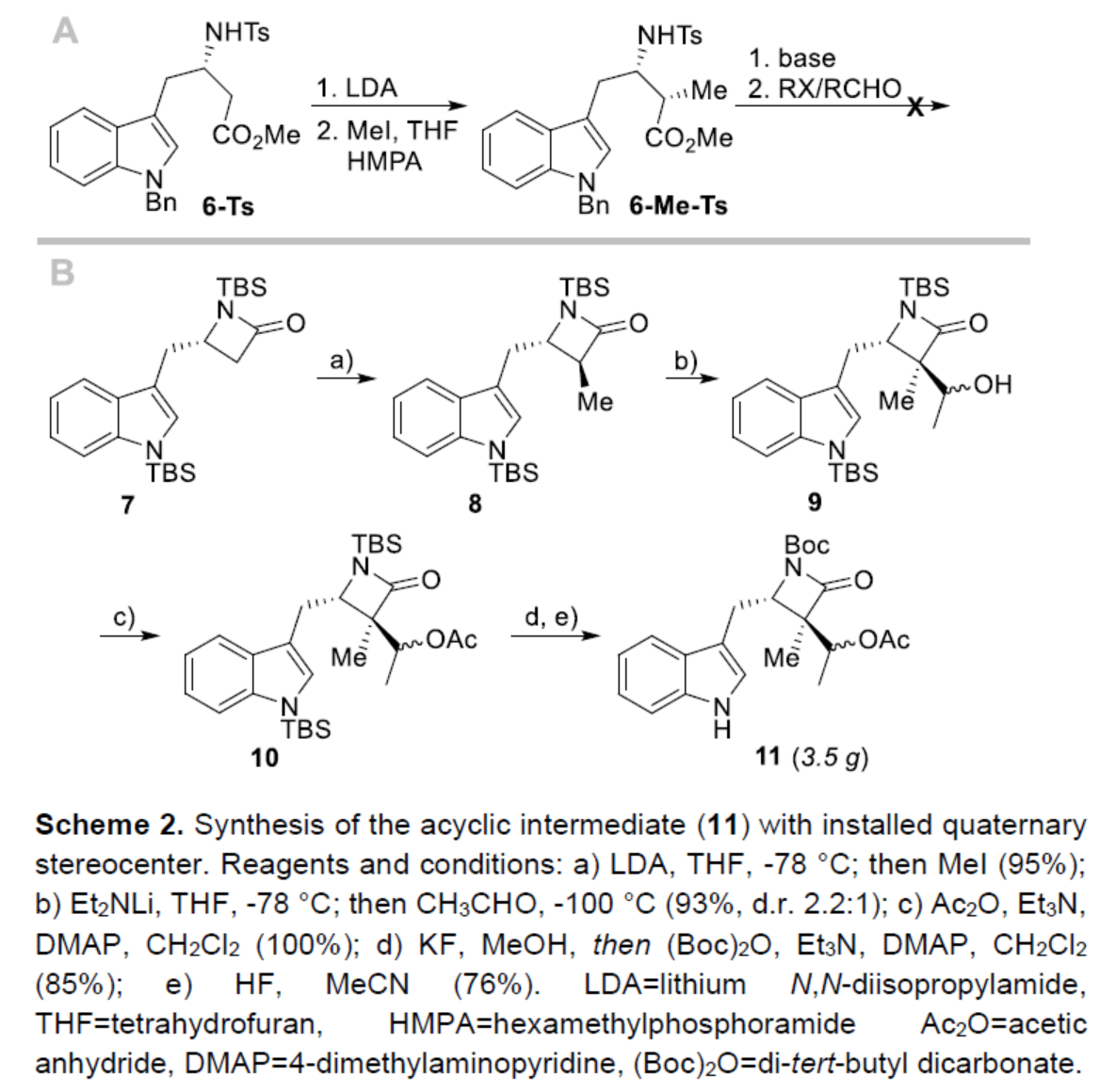
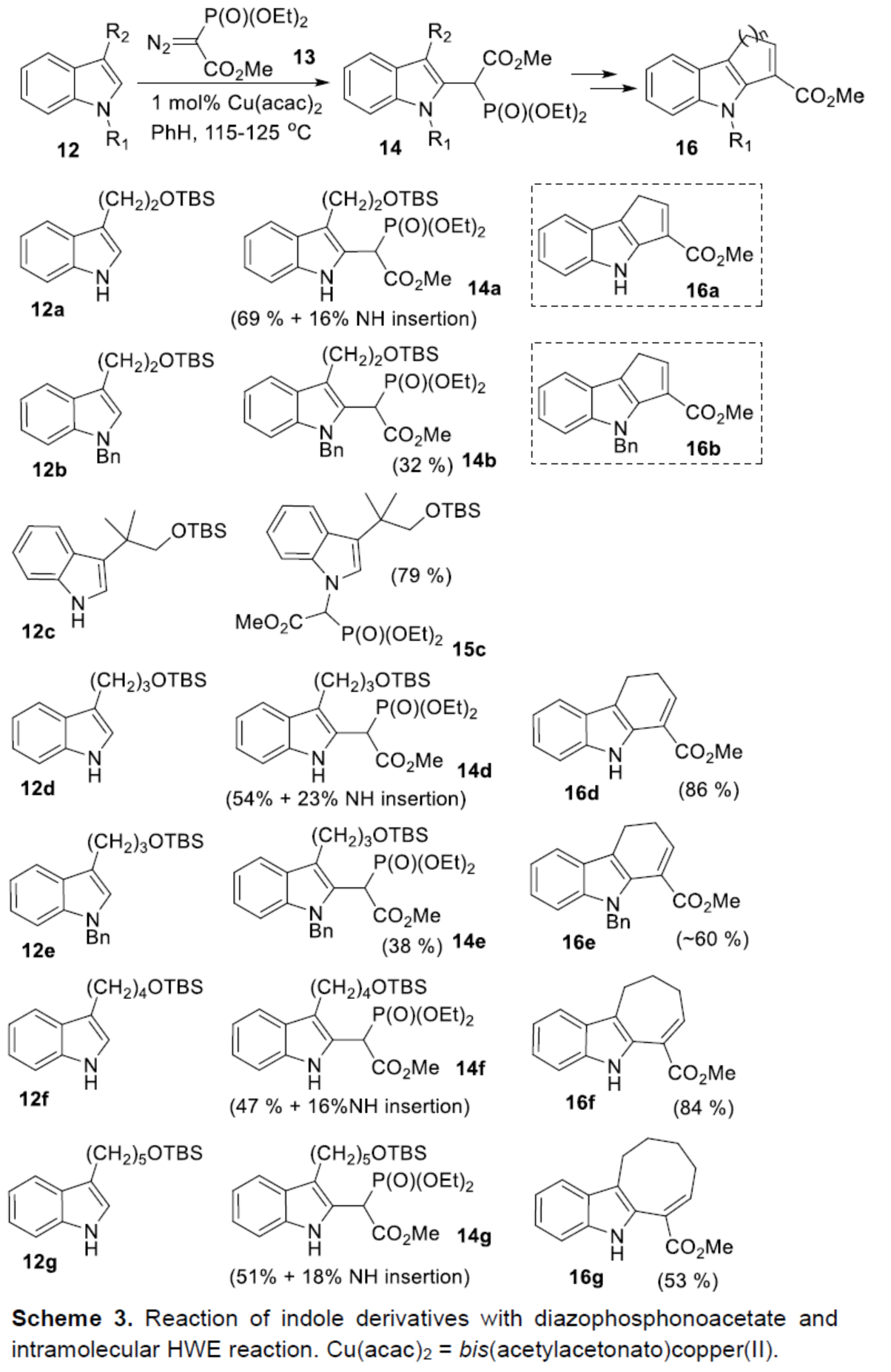
接下來,作者開始對吲哚環(huán)的官能團(tuán)化反應(yīng)進(jìn)行了研究(Scheme 3)。作者認(rèn)為,在吲哚衍生物C-2位引入膦酰基乙酸酯(phosphonoacetate)單元,再通過分子內(nèi)Horner-Wadsworth-Emmons反應(yīng),可實(shí)現(xiàn)七元環(huán)的構(gòu)建。鑒于從重氮丙二酸二甲酯衍生的銅-卡賓類化合物形式插入C-H鍵的相關(guān)報道,作者認(rèn)為重氮膦酰基乙酸酯應(yīng)可進(jìn)行相似的轉(zhuǎn)化。研究表明,Cu(acac)2催化3-取代吲哚12與重氮膦酰基乙酸酯13反應(yīng)時,可獲得預(yù)期的C-2官能團(tuán)化化合物14。同時,作者發(fā)現(xiàn),(1)游離吲哚氮底物比N-烷基化底物反應(yīng)更快,并以良好的收率形成相應(yīng)的產(chǎn)物(14a、14d、14f、14g);(2)缺電子的N-Boc吲哚衍生物未發(fā)生反應(yīng);(3)吲哚環(huán)的C-3位含有空間位阻較大的取代基,可防止C(2)-H鍵的插入,僅獲得N-H鍵插入的化合物15c。此外,在對分子內(nèi)Horner-Wadsworth-Emmons反應(yīng)研究后發(fā)現(xiàn),在LiBr/Et3N條件下,14d-14g衍生的醛,均可順利進(jìn)行環(huán)化反應(yīng),從而有效地構(gòu)建了六-八環(huán)中間體16d-16g。值得注意的是,該策略是首次將HWE反應(yīng)用于環(huán)庚烯并[b]吲哚骨架的構(gòu)建。
(圖片來源:Angew. Chem. Int. Ed.)
因此,吲哚衍生物11在銅-卡賓插入條件下,可區(qū)域選擇性獲得膦酸酯中間體17(4.5 g,83%的收率)。中間體17中的β-內(nèi)酰胺單元經(jīng)還原斷裂可生成一級醇中間體18,經(jīng)IBX氧化,可獲得醛中間體19。中間體19經(jīng)分子內(nèi) Horner-Wadsworth-Emmons反應(yīng),可獲得關(guān)鍵的三環(huán)中間體20(大于2 g)。中間體20中經(jīng)吲哚單元N-H鍵的保護(hù)以及N-甲基化后,可獲得中間體21。

(圖片來源:Angew. Chem. Int. Ed.)
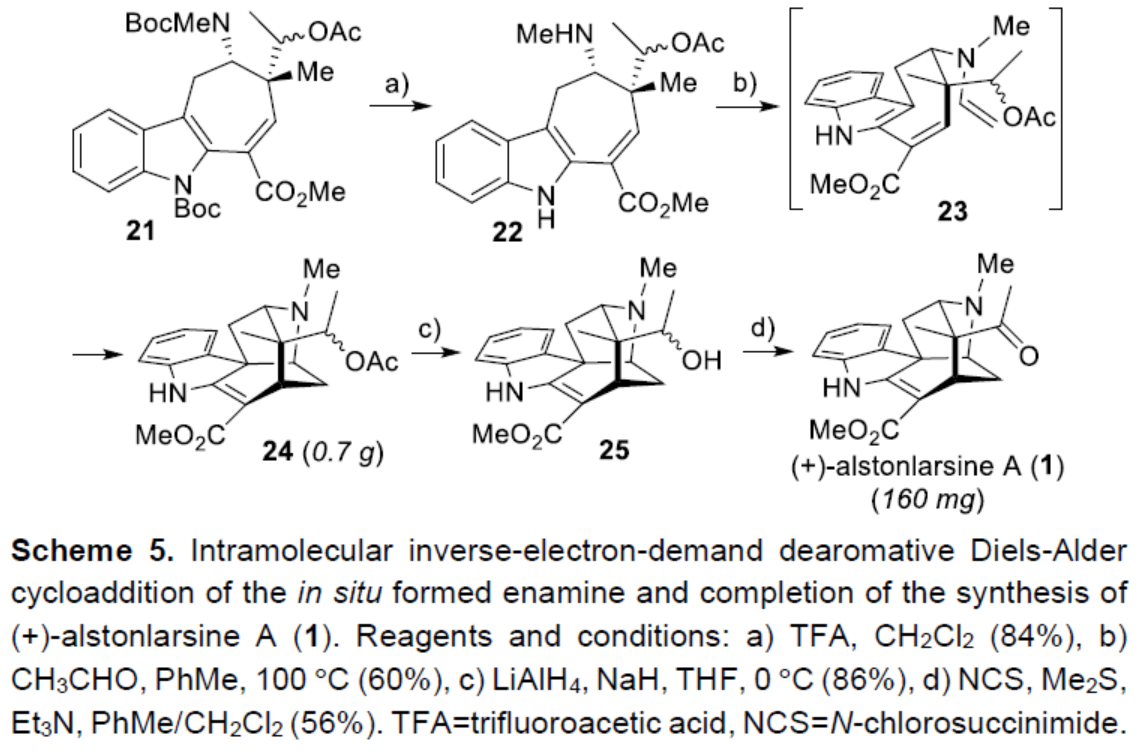
在酸性條件下,中間體21中的兩個Boc基團(tuán)脫保護(hù)后,可獲得胺中間體22,從而為關(guān)鍵的多米諾串聯(lián)反應(yīng)奠定了基礎(chǔ)(Scheme 5)。中間體22與乙醛反應(yīng),可原位生成烯胺中間體23。中間體23可順利進(jìn)行(形式)分子內(nèi)去芳構(gòu)化Diels-Alder環(huán)加成,獲得五環(huán)中間體24。值得注意的是,通過該多米諾串聯(lián)反應(yīng),可在一步過程中實(shí)現(xiàn)一個C-N鍵、兩個C-C鍵、三個手性中心以及五環(huán)骨架的兩個環(huán)的構(gòu)建。最后,通過大量條件的優(yōu)化后發(fā)現(xiàn),中間體24使用LiAlH4還原時,在NaH存在下,可選擇性去除乙酸酯基團(tuán),獲得一級醇中間體25。中間體25在Corey-Kim條件下進(jìn)行氧化,從而完成了(+)-alstonlarsine A(1)的不對稱全合成。合成產(chǎn)物(160 mg)的所有譜圖數(shù)據(jù)與分離的(+)-alstonlarsine A(1)的譜圖數(shù)據(jù)一致。
(圖片來源:Angew. Chem. Int. Ed.)
總結(jié):
貝爾格萊德大學(xué)Zorana Ferjancic與Filip Bihelovic團(tuán)隊(duì)報道了(+)-alstonlarsine A(1)的對映選擇性全合成,涉及關(guān)鍵的多米諾串聯(lián)過程(原位形成烯胺/Diels-Alder反應(yīng)),可在一步過程中實(shí)現(xiàn)一個C-N鍵、兩個C-C鍵、三個手性中心以及五環(huán)骨架的兩個環(huán)的構(gòu)建。此外,通過將吲哚衍生物C(2)-H鍵的官能團(tuán)化與分子內(nèi)Horner-Wadsworth-Emmons反應(yīng)相結(jié)合,從而實(shí)現(xiàn)了環(huán)庚烯并[b]吲哚骨架的構(gòu)建,并可用于其它吲哚并六-八元環(huán)的稠合三環(huán)骨架的構(gòu)建。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn