

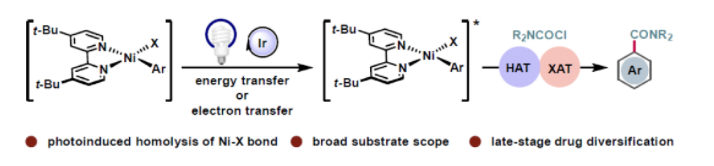
(圖片來源:Angew. Chem. Int. Ed.)
鑒于酰胺骨架的重要性和應用性,探索其高效合成方法是十分必要的。近些年,利用過渡金屬催化的有機鹵,一氧化碳和胺的三組分偶聯酰胺化過程得到了廣泛的發展(Figure 1a)。然而,反應中需要使用有毒的一氧化碳氣體以及需要較高的壓力限制了此類反應的實際應用。此外,反應通常需要較高的溫度,從而限制了底物適應性以及敏感官能團的兼容性。因此,探索高效、溫和的催化體系實現酰胺骨架的構建具有重要的意義。
為了改進現有方法的不足,利用可見光和金屬共催化實現酰胺骨架的構建得到了廣泛的關注。Melchiorre課題組近期報道了光/鎳共催化,利用4-胺甲酰基-1,4-二氫吡啶衍生物作為胺甲酰基自由基源來構建碳酰胺(Figure 1a)。然而,此反應所需的胺甲酰基自由基前體的合成步驟較長,且此方法不能兼容(雜)芳基溴化物。而目前在商業可得的芳基鹵化物中芳基氯化物是最多的且廣泛存在于天然產物和藥物相關分子中(Figure 1b)。因此,發展溫和的催化體系利用芳基氯化物或者芳基溴化物一步實現酰胺骨架的構建具有很好的實用價值。最近,印度理工學院孟買分校Debabrata Maiti課題組發展了溫和的光/鎳共催化反應體系,利用(雜)芳基溴化物或氯化物與胺甲酰氯的交叉親電偶聯反應實現了酰胺骨架的構建(Scheme 1c)。
(圖片來源:Angew. Chem. Int. Ed.)
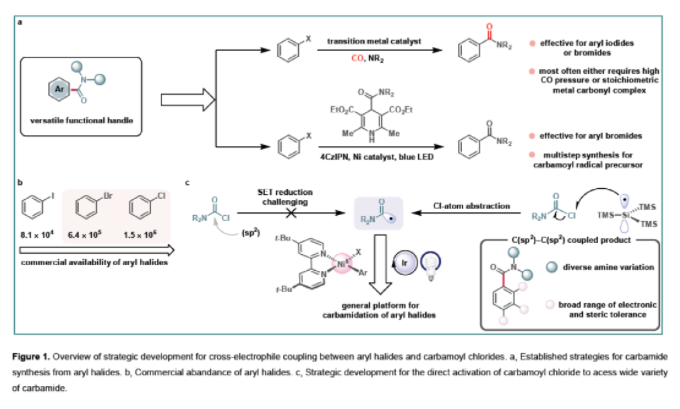
作者首先選用4-溴苯腈1a和N,N-二甲基胺甲酰氯2a作為模板底物進行條件篩選,發現當使用Ir[(dF(CF3)ppy]2(dtbbpy)PF6 (1.0 mol%), 三(三甲基甲硅烷基)硅烷TTMSS (2.5 equiv.), NiBr2.glyme (5.0 mol%), dtbbpy (6.0 mol%), 四甲基胍(tetramethylguanidine, TMG)(3.0 equiv.), CH3CN (1.5 mL), Blue LEDs照射下反應24 h可以以78%的分離產率得到相應的產物4。為了對反應機理有更深入的理解,作者進行了CV和磷光淬滅實驗。CV實驗表明,激發態的光催化劑*Ir[dF(CF3)ppy]2(dtbbpy)PF6并不能夠還原胺甲酰氯為胺甲酰基自由基。磷光淬滅實驗再次表明胺甲酰氯與激發態的光催化劑之間并沒有相互作用。此外,磷光淬滅實驗表明TTMSS也不能使光催化劑*Ir[dF(CF3)ppy]2(dtbbpy)PF6的強度降低,這就排除了兩者之間的相互作用。接下來,作者分別合成出了Ni(0)與ArBr氧化加成絡合物B1和Ni(0)與ArCl氧化加成絡合物B2來嘗試淬滅激發態的光催化劑。實驗結果表明B1和B2與激發態的Ir光催化劑之間通過三線態-三線態能量轉移或者直接單電子轉移產生激發態Ni(II)絡合物,或者在氧化時產生Ni(III)絡合物。為了探索Ni(II)絡合物的確切轉化方式,作者進行了直接激發試驗(Figure 2a)和Ni(II)絡合物的計量反應實驗(Figure 2b)。實驗結果表明(雜)芳基溴化物的轉化可能涉及能量轉移(EnT)機理,而(雜)芳基氯化物的轉化可能設計單電子轉移(SET)機理。此外,作者通過紫外-可見光譜得出在加入TMG后,Ni(II)絡合物在500-800 nm處完全消失。這表明體系中的TMG不僅僅作為堿,還可作為還原劑使Ni(II)催化劑還原成活性的Ni(0)催化劑(Figure 2c)。
通過上述實驗結果,作者提出了可能的反應機理。首先,在堿促進下Ni(II)被還原成Ni(0)活性物種A,隨后A與芳基鹵化物發生氧化加成得到Ni(II)中間體B。與此同時,光催化劑C (Ir[(dF(CF3)ppy]2(dtbbpy)PF6)在可見光照射下吸收光子得到三線態激發態絡合物D。D可以與Ni-ArBr氧化加成絡合物B1發生能量交換得到光敏Ni(II)絡合物E1*。隨后E1*發生均裂得到Ni(I)絡合物F1和溴自由基并再生光催化劑C(Figure 2d)。對于芳基氯化物參與的反應,*Ir[dF(CF3)ppy]2(dtbbpy)+可以通過SET路徑實現Ni(II)絡合物B2的氧化得到Ni(III)中間體E2(Figure 2e)。隨后中間體E2發生光解生成氯自由基和Ni(II)物種F2。接著,產生的鹵自由基會與TTMSS發生HAT過程得到親核硅基自由基H。隨后H從胺甲酰氯2中攫取氯原子形成關鍵的胺甲酰基自由基中間體I。接著胺甲酰基自由基I分別與Ni(I)物種和Ni(II)物種結合得到相應的Ar-Ni(II)-CONMe2絡合物J1和Ar-Ni(III)-CONMe2絡合物J2。隨后通過還原消除得到目標酰胺產物并形成基態Ni(0)物種A和Ni(I)物種K。最后,Ni(I)中間體K通過SET過程被具有較高還原性的Ir(III)光催化劑L還原再生低價Ni催化劑A和基態光催化劑C,完成催化循環。
(圖片來源:Angew. Chem. Int. Ed.)
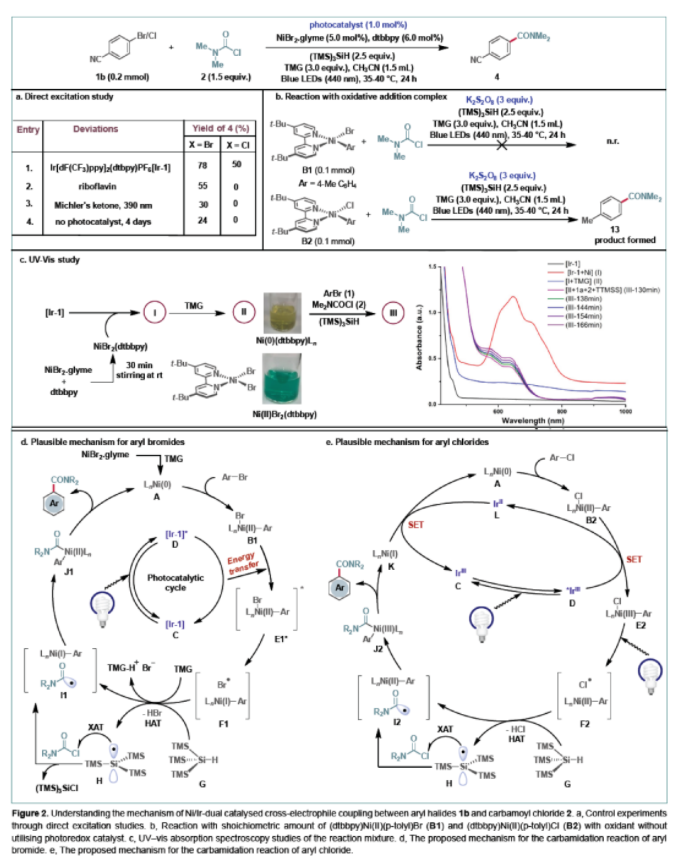
在篩選出最優條件和對機理進行探索后,作者首先對芳基鹵化物的底物適用范圍進行探索(Scheme 1)。實驗結果表明芳基鹵對位不論吸電子基(三氟甲基、氰基、酯基、酮、氟、磺酰基)還是給電子基或電中性基團均可兼容此轉化。此外,間位或鄰位取代的芳基鹵化物展現出較好的兼容性。高興的是,多環芳基溴化物也可以成功的參與反應,以62-72%的產率得到產物28-31。值得注意的是,藥物或天然產物所衍生出的芳基溴化物也均可以實現此轉化,以53-79%的產率得到產物32-37。
(圖片來源:Angew. Chem. Int. Ed.)
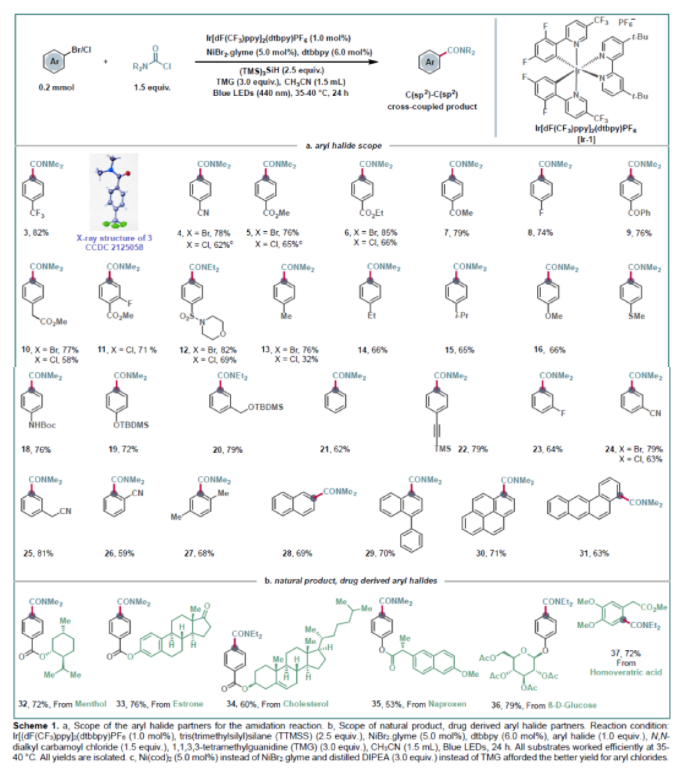
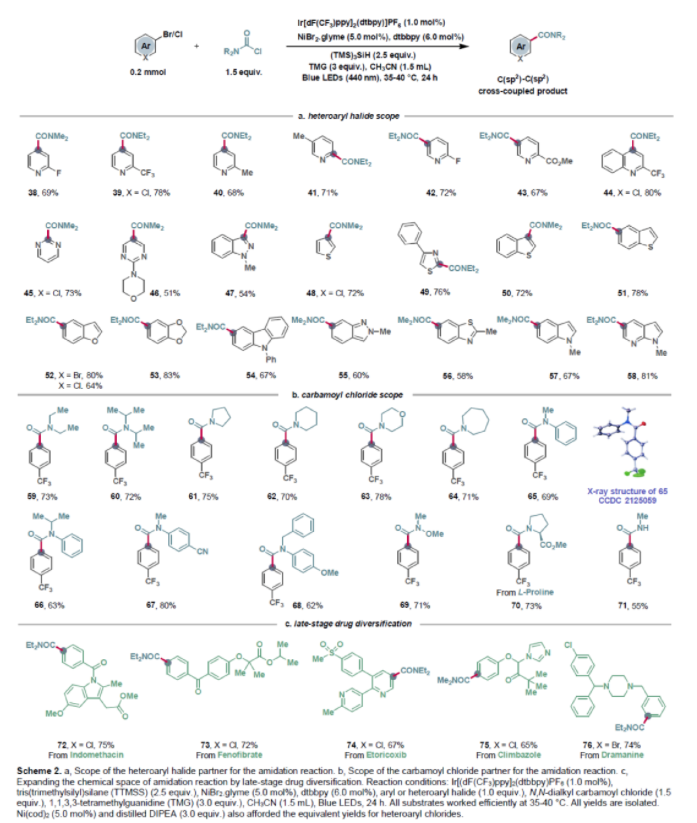
接下來,作者嘗試探索雜芳基鹵化物的兼容性(Scheme 2a)。實驗結果表明,含有吡啶、喹啉、嘧啶、吲唑、噻吩、噻唑、苯并噻吩、苯并呋喃、咔唑、苯并噻唑、吲哚、氮雜吲哚等不同雜環的雜芳基鹵化物均具有良好的兼容性。此外,作者還對胺甲酰氯的底物范圍進行探索,結果表明不同的胺甲酰氯均具有良好的底物適應性(Scheme 2b)。為了證明此轉化的實用性,作者對一些含芳基鹵結構的藥物分子進行酰胺化衍生(Scheme 2c)。包括抗炎藥-吲哚美辛(indomethacin)、治療血脂水平異常口服藥-非諾貝特(fenofibrate)、選擇性COX-2抑制劑-依托考昔(etoricoxib)、抗真菌劑-甘寶素(climbazole)、止吐藥-暈海寧(dramanine)等均可以通過此反應實現從芳基鹵到酰胺的轉化。值得注意的是,由于暈海寧分子中即含有芳基氯又含有芳基溴部分,而反應后作者發現反應會選擇性的在芳基溴位點處發生,而芳基氯部分可以保持,這為此分子的后續官能團化提供了更多的可能性。
(圖片來源:Angew. Chem. Int. Ed.)
最后,作者還利用此反應的分子間交叉親電偶聯過程實現了一系列具有生物活性的異吲哚酮分子的合成,證明了此反應體系的兼容性和高效性(Scheme 3)。

(圖片來源:Angew. Chem. Int. Ed.)
總結:
印度理工學院孟買分校Debabrata Maiti課題組發展了溫和的光/鎳共催化反應體系,利用(雜)芳基溴化物或氯化物與胺甲酰氯的交叉親電偶聯反應實現了酰胺骨架的構建。反應具有良好的底物適應性和官能團兼容性,并可以兼容多種雜環骨架以及藥物分子骨架,具有較好的實用性。控制實驗表明不同的芳基鹵化物參與反應經歷不同的反應路徑,對于(雜)芳基溴化物來說主要涉及EnT路徑,而對于(雜)芳基氯化物主要涉及SET路徑。此反應使用硅自由基中間體的攫鹵模式,可以直接利用商業可得的胺甲酰氯來產生胺甲酰基自由基,從而實現酰胺化過程。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn