在合成官能團化的芳烴中,芳烴選擇性的C–H活化一直都具有挑戰性。在已知的合成策略中,使用雜原子導向策略可以精準實現芳烴的鄰位、間位、甚至是對位的官能團化。然而,對于不含有其他官能團的烷基芳烴,由于其烷基只有極弱的導向能力,導致選擇性的C–H活化十分困難,反應一般得到多種混合產物。當然也有一些例外,如對稱的二烷基取代芳烴,會在立體位阻較小的位置引入官能團,還有一些單取代烷基芳烴,也有報道稱可以選擇性地實現間位或對位C–H活化。
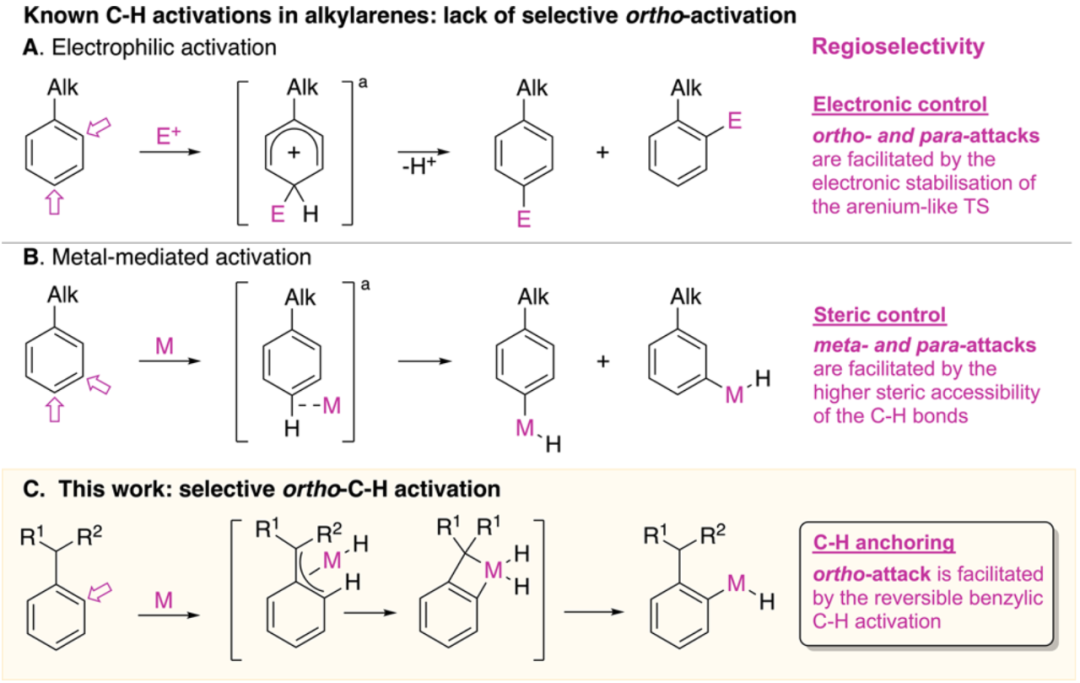
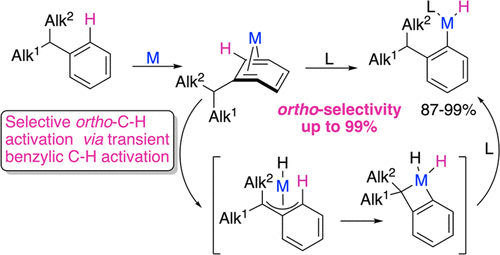
圖1.烷基芳烴的C–H活化模式(圖片來源:J. Am. Chem. Soc.)如圖1所示,非官能團化的烷基芳烴通常是由親電試劑或過渡金屬活化,得到鄰位取代的產物收率低于67%。在圖1A中,烷基的親電取代反應通常得到鄰對位取代的混合物,因為該反應的區域選擇性一般是由電子效應控制的。對比而言,過渡金屬參與的烷基芳烴C–H活化反應一般得到間位和對位取代的產物,且通常比例為2:1,說明空間位阻較小的C–H鍵更容易被金屬活化(圖1B)。在之前的研究中,這類反應中鄰位的區域性幾乎都不超過58%。在本文中,作者使用簡單的銥配合物,實現了烷基芳烴的選擇性鄰位C–H活化,而反應成功的關鍵就在于他們發現一種稀有的銥配合物,使得烷基可以作為一個有效的導向基團(圖1C)。
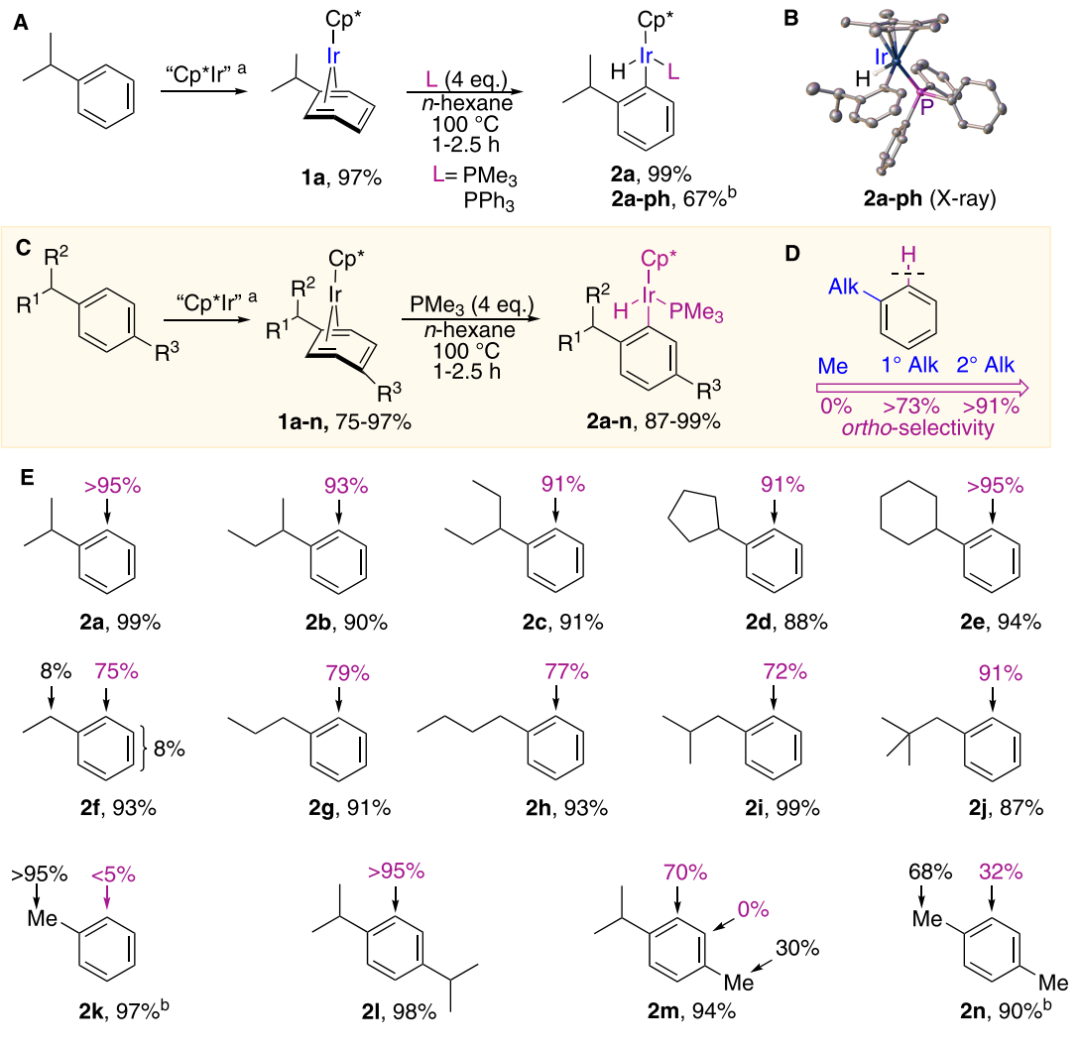
圖2. 銥參與的烷基芳烴鄰位C–H氧化加成反應研究(圖片來源:J. Am. Chem. Soc.)在之前的工作(Chem. Commun.2021, 57, 7894–7897)中,作者利用金屬銥配合物Cp*Ir(η4-methylarene)(Cp*為五甲基環戊二烯基)實現了甲基芳烴的芐位C–H活化。基于此,在本文研究中,他們繼續使用配合物Cp*Ir(η4-alkylarene) 1,計劃將反應底物拓展到其他一級和二級烷基取代的芳烴,卻意外地得到了一系列區域選擇性與之前工作不同的鄰位C–H活化產物(圖2)。異丙基苯配合物1a與PMe3在正己烷中100 °C加熱條件下完全轉化為鄰位C–H氧化加成的產物——芳基銥氫化物2a。當使用更大位阻的PPh3配體時,對應的配合物產物2a-Ph收率為67%,結構也通過單晶衍射分析確認。另外,反應不加入配體時會得到多種復雜的產物。隨后,作者將一系列烷基芳烴銥配合物1a-n與PMe3進行反應,以考察芳烴上取代基對其C–H鍵氧化加成的區域選擇性的影響。如圖2C所示,多種銥配合物都能以較高的收率得到(87-99%)。通過對比產物2a-e(二級烷基取代基)與2f-e(一級烷基取代基)發現一些規律:烷基取代基級數越大,鄰位的選擇性越高。有一個例外就是取代基較大的新戊基苯(21,一級烷基取代基),最終以91%的鄰位選擇性得到目標銥配合物。相較而言,取代基最小的甲苯卻無法得到鄰位C–H活化產物,而是得到芐位C–H活化的氫化物2k。顯然,該反應鄰位選擇性的規律是,二級烷基 >一級烷基 >> 甲基,與經典的烷基芳烴的親電取代反應及已知的烷基芳烴C–H氧化加成進行對比(圖1A和B)可以發現,該反應呈現的選擇性完全不同。以對異丙基甲苯所得到的產物2m為例,該反應芳環上的C–H氧化加成只發生在位阻更大的異丙基的鄰位,而沒有得到甲基鄰位金屬化的產物。
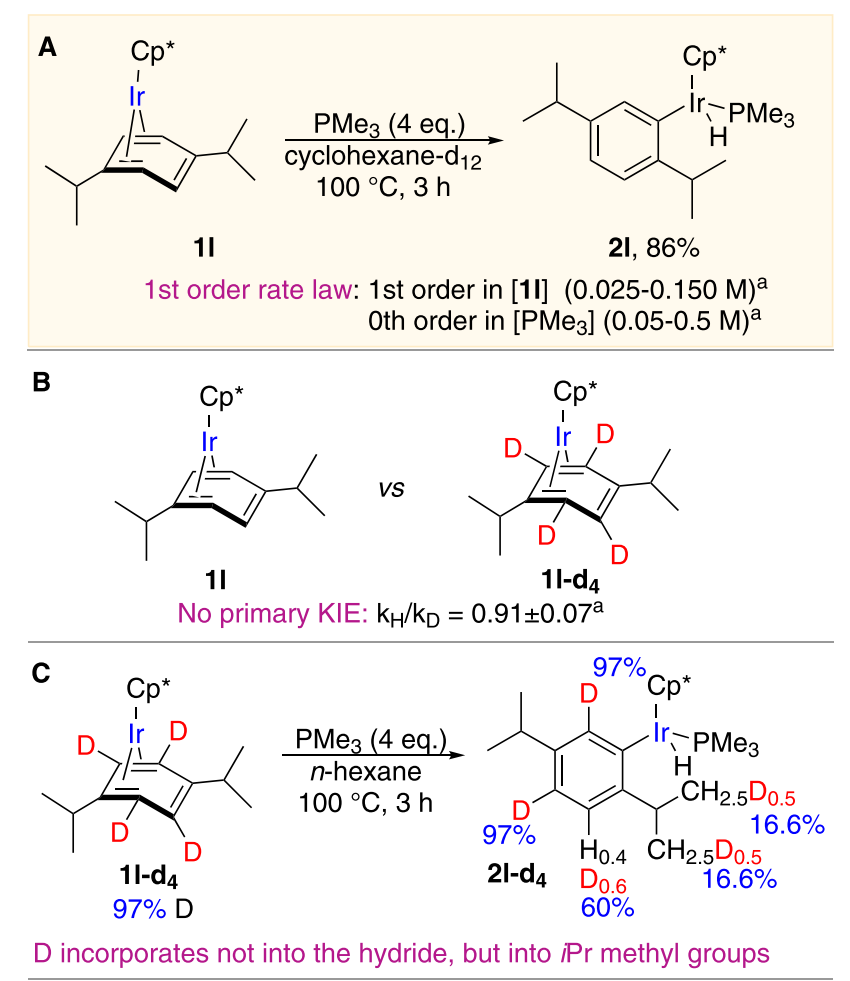
圖3. 反應機理研究(圖片來源:J. Am. Chem. Soc.)為了解釋該反應反常的區域選擇性,作者選用配合物1l在氘代環己烷-d12中對該反應的機理進行了研究。動力學KIE實驗(1H NMR)研究表明,該反應對于底物1l為一級,對于配體PMe3為零級,同時該實驗還說明產物與氘代溶劑之間不存在H/D交換(圖3A)。隨后,作者分別研究配合物1l和芳環被氘代的配合物1l-d4的初始反應速率,結果表明鄰位的C–H鍵并沒有參與反應的決速步(圖3B)。另外,作者在研究氘代底物1l-d4還發現出乎意料的結果:被取代的芳環上的D并沒有轉移到中心金屬銥上,核磁分析表明金屬銥的配體是H而不是D,而D被轉移到異丙基的兩個甲基上。作者認為,此結果可能是由配體D與兩個甲基之間的分子內H/D重新分配導致的,并且該重新分配過程發生在反應的某一中間體。

圖4. 反應機理研究(圖片來源:J. Am. Chem. Soc.)隨后,作者根據銥配合物1l鄰位選擇性的實驗結果提出了可能的反應歷程,并對其進行了計算。圖4中path 1 展示了能量最低的反應途徑:反應首先由1l生成η2-芳烴中間體3,隨后異丙基上芐位的H發生C–H鍵氧化加成,所得到的η3-芐基氫配合物4經過銥插入到鄰位C–H從而異構化為環銥中間體5,其芐位的C–H快速消除形成配位不飽和的芳基氫物種6,繼續與PMe3配體配位從而得到了最終產物2l。作者認為,由于生成4個中間體的能量相近,無法判斷反應的決速步,只能從上述KIE實驗確定中間體4所發生的芳環C–H氧化加成不是反應的決速步。另一方面,該機理研究解釋了銥η3-芳烴配合物進行選擇性的鄰位C–H活化的原因:反應從動力學和熱力學上都有利于芳環鄰位的C–H活化,不利于競爭反應芐位的C–H活化,并且,芳環鄰位的C–H活化從動力學上有利歸因于烷基特殊的導向作用。配位的烷基芳烴底物通過最初的芐位C–H活化從而將金屬銥綁定在鄰位,從而促進后續鄰位C–H鍵氧化加成得到中間體5。從圖4A中還可以看出,經歷兩次C–H鍵氧化加成的能壘(path 1)比直接的鄰位C–H鍵氧化加成(path 2)要低。另一方面,底物1l的鄰位C–H活化在熱力學上比競爭的芐位C–H活化更有優勢(圖4,path 3),與之前甲基芳烴得到芐位金屬化產物的結果對比可以發現,芳烴上烷基取代基級數越高,形成的芐基金屬配合物中間體越不穩定,就越有利于生成芳基鄰位C–H活化產物。最后,對于圖3C中氘代實驗的結果,作者提出了可能的反應歷程進行解釋。他們認為,氘代配合物2l-d4經由圖4A中path 1得到氘代中間體6-iso-d4和6-d4,初步計算表明,這兩個中間體之間存在平衡,可能是通過兩個五元環銥物種8-iso-d4和8-d4,即在該過程中產生了H/D重新分配。總之,Alexey G. Sergeev課題組采用概念上的新方法,實現了不含導向基的烷基芳烴的選擇性鄰位C–H活化,各類一級和二級烷基取代的芳烴均能以優良的選擇性得到鄰位C–H活化產物。作者證明了烷基取代基超越金屬介導的C–H活化對位阻最小的芳烴C–H鍵的典型偏好的能力是由銥瞬時插入芐基C–H鍵引起的,這使得銥能夠快速插入到鄰位C–H鍵,然后通過還原消除再生芐基C–H鍵。更大的烷基取代基增加了鄰位選擇性。所描述的化學方法在概念上代表了現有芳基C–H活化方法的新替代方案。另外,如何將該策略從化學計量的C–H活化反應轉移到催化量的C–H官能團化反應依然具有挑戰性,也需要進一步擴大反應底物范圍,提高反應的選擇性。如何設計合理的催化循環,可以由烷基芳烴直接生成關鍵的不飽和η2-烷基芳烴銥中間體,并且在C–H官能團化后能再次生成該中間體,也是該反應的未來研究方向。
文獻詳情:
Antony P. Y. Chan, Martin Jakoobi, Chenxu Wang, Robert T. O’Neill, Gu?lsevim S. S. Aydin, Nathan Halcovitch, Roman Boulatov, and Alexey G. Sergeev*.Selective ortho-C?H Activation in Arenes without Functional Groups. J. Am. Chem. Soc.2022. https://doi.org/10.1021/jacs.2c04621








