髓細(xì)胞白血病-1 (MCL-1) 屬于B細(xì)胞淋巴瘤-2 (BCL-2) 蛋白家族成員之一,可作為細(xì)胞凋亡的調(diào)節(jié)因子,參與調(diào)節(jié)細(xì)胞存活等生理過程。MCL-1的過度表達(dá)存在于在各種血液瘤和實(shí)體瘤中,使得MCL-1成為治療癌癥的潛在靶標(biāo)。近年來,隨著對(duì)MCL-1的結(jié)構(gòu)基礎(chǔ)和致病機(jī)理的大量研究,許多制藥公司都致力于MCL-1高效抑制劑的研發(fā)。迄今為止,藥物化學(xué)家已經(jīng)陸續(xù)報(bào)道了多種不同類型的MCL-1抑制劑,其中活性和安全性最為優(yōu)異的是由楊森制藥公司(Janssen Pharnarceutcia)研發(fā)的JNJ-4355(Figure 1),其最顯著的特征之一是其存在聯(lián)芳基手性軸,且這個(gè)四取代的 Csp2-Csp2鍵對(duì)化合物的活性至關(guān)重要。聯(lián)芳基阻旋異構(gòu)化合物越來越廣泛地出現(xiàn)在藥物分子、有機(jī)催化劑及手性配體之中。鑒于此,聯(lián)芳基阻旋異構(gòu)體的不對(duì)稱合成受到了一定的關(guān)注,目前常見的合成方式包括聯(lián)芳基化合物的不對(duì)稱交叉偶聯(lián);外消旋或前手性聯(lián)芳基化合物的不對(duì)稱修飾(如動(dòng)力學(xué)拆分等);中心手性向軸手性的傳遞及聯(lián)芳基化合物的去對(duì)稱化等。然而,過渡金屬催化的交叉偶聯(lián)反應(yīng)因底物位阻、合成步驟冗長、條件嚴(yán)苛等因素嚴(yán)重阻礙其反應(yīng)活性和選擇性,使得四鄰位取代聯(lián)芳基骨架的構(gòu)建仍然是有機(jī)化學(xué)領(lǐng)域的一大難題。因此,發(fā)展高效合成聯(lián)芳基阻旋異構(gòu)體的方法長期以來一直是有機(jī)化學(xué)家的研究重點(diǎn)。
近日,楊森制藥公司的Katharina Neufeld研究員發(fā)展了一類手性Suzuki-Miyaura偶聯(lián)/酶動(dòng)力學(xué)拆分相結(jié)合的合成聯(lián)芳基阻旋異構(gòu)體的方法,并成功實(shí)現(xiàn)了JNJ-4355的高效合成。相關(guān)成果發(fā)表在ACS Catal.上(DOI: 10.1021/acscatal.2c02090)。
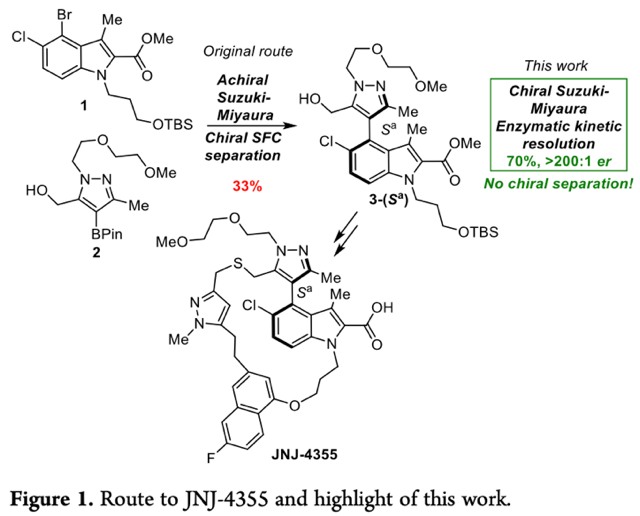
基于HTE技術(shù),作者以N-取代吲哚(1)和吡唑硼酸(2)作為模型底物,對(duì)催化劑的配體進(jìn)行了篩選(Table 1)。首先,作者發(fā)現(xiàn)以(S)-KenPhos (L1)、(S)- MOP (L2)和L3為配體時(shí),反應(yīng)僅以60:40er值和< 55:45 er值得到目標(biāo)產(chǎn)物3。接著,作者在相同反應(yīng)條件下,將配體替換成二茂鐵配體L4和單苯環(huán)配體L5時(shí),發(fā)現(xiàn)反應(yīng)對(duì)映選擇性略有提高。然后,作者繼續(xù)對(duì)一系列手性聯(lián)芳基單膦配體(L6-L24)進(jìn)行篩選,發(fā)現(xiàn)以L10和L15為配體時(shí),產(chǎn)物的選擇性顯著提高,但均無法同時(shí)達(dá)到最優(yōu)的產(chǎn)率、非對(duì)映選擇性和對(duì)映選擇性,而以L22為配體時(shí),反應(yīng)能夠在保持良好產(chǎn)率的同時(shí)顯著提高選擇性。
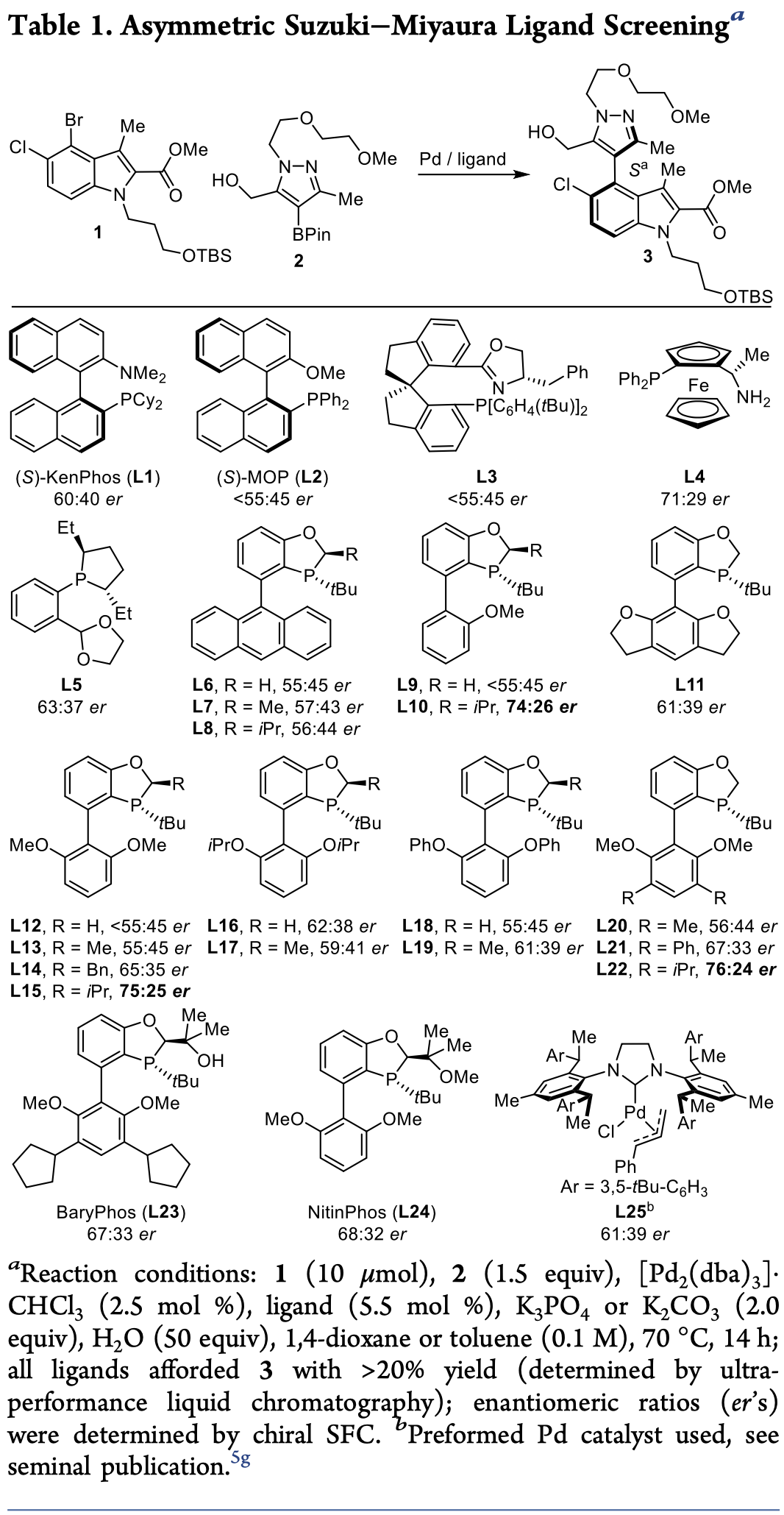
基于篩選的最優(yōu)配體,作者繼續(xù)對(duì)堿和反應(yīng)溶劑進(jìn)行了篩選(Table 2)。首先,作者發(fā)現(xiàn)以[Pd(dba)2]為催化劑和K3PO4為堿時(shí),反應(yīng)能以96%的分離產(chǎn)率和76:24 er值得到產(chǎn)物3。接著,作者在相同反應(yīng)條件下,分別將催化劑和堿替換成[Pd(dba)2].CHCl3和K2CO3時(shí),發(fā)現(xiàn)反應(yīng)能保持優(yōu)異的選擇性得到產(chǎn)物,但其反應(yīng)產(chǎn)率顯著降低。然后,作者改變催化劑與配體用量比,發(fā)現(xiàn)反應(yīng)產(chǎn)率同樣下降(81%)。最后,作者又嘗試改變?nèi)軇┗蚍磻?yīng)濃度,反應(yīng)以76%-86%的分離產(chǎn)率得到目標(biāo)產(chǎn)物。經(jīng)過篩選,作者確定了[Pd(dba)2]為催化劑(2.5 mol%)、L22(2.75 mol%)為配體、K3PO4為堿和MeTHF/H2O為溶劑的最佳反應(yīng)條件。
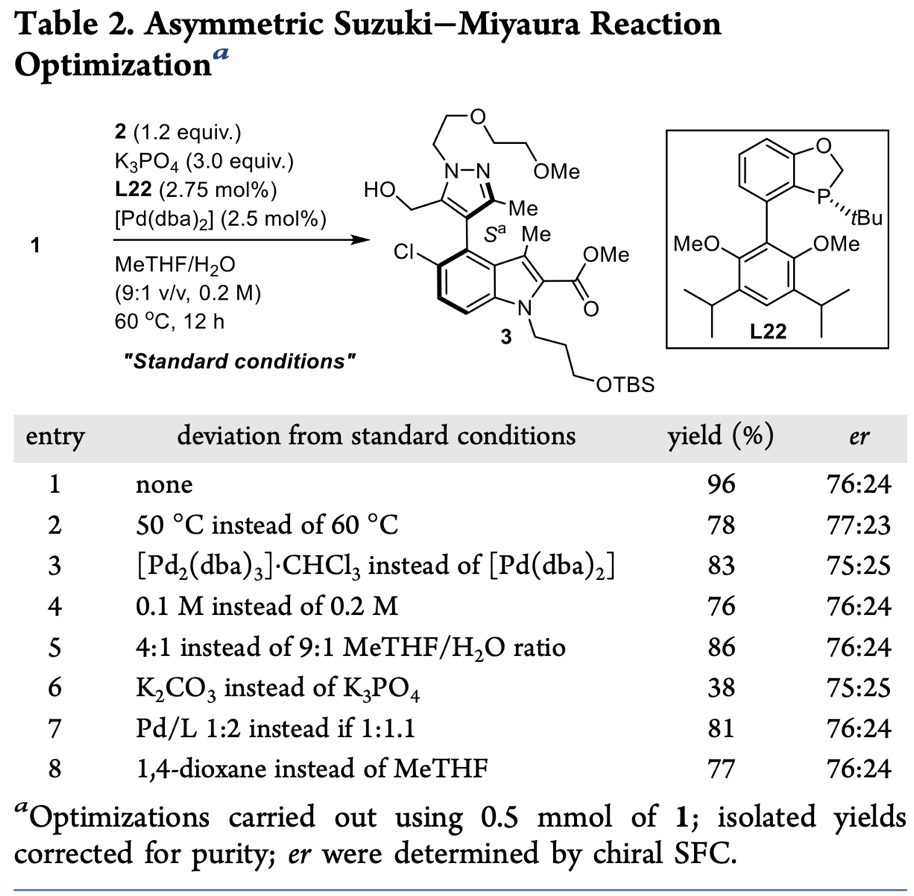
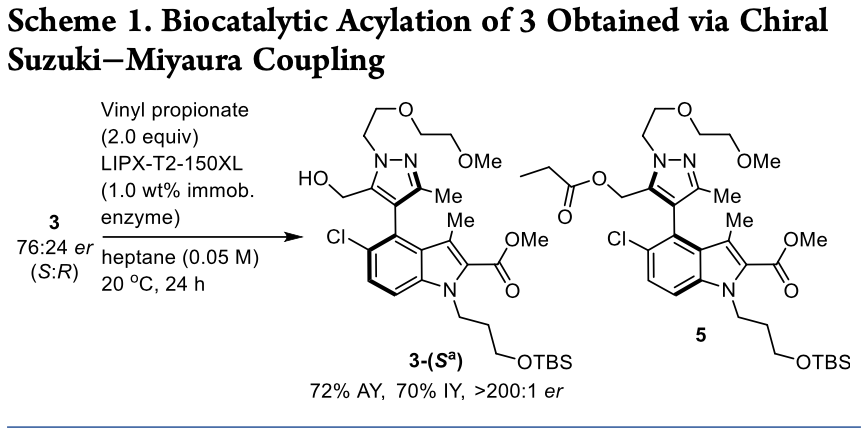
雖然通過手性Suzuki-Miyaura偶聯(lián)反應(yīng)能夠以高產(chǎn)率得到化合物3,但其對(duì)映選擇性仍有待提高,因此,作者猜想是否能夠先將化合物3乙酰化,再利用生物催化水解得到手性豐富的S構(gòu)型產(chǎn)物,從而達(dá)到分離的目的。基于此,作者對(duì)300余種商業(yè)可得的水解酶進(jìn)行了篩選(Figure 2)。結(jié)果顯示,其中ChiralVision LIPX-T2-150XL (lipase Lipex 100L)、ChiralVisionRES-T2-150XL (lipase Resinase HT)和ChiralVision TLL-T2-150XL (lipase from Thermomyces lanuginose)三種催化劑表現(xiàn)出優(yōu)異的選擇性。
為了驗(yàn)證三種催化劑的選擇性,作者對(duì)多種不同的酰基供體進(jìn)行了篩選(Figure 3)。結(jié)果顯示,以丙酸乙烯酯作為酰基化供體時(shí),三種催化劑均表現(xiàn)出優(yōu)異的選擇性,尤其是ChiralVision LIPX-T2-150XL。
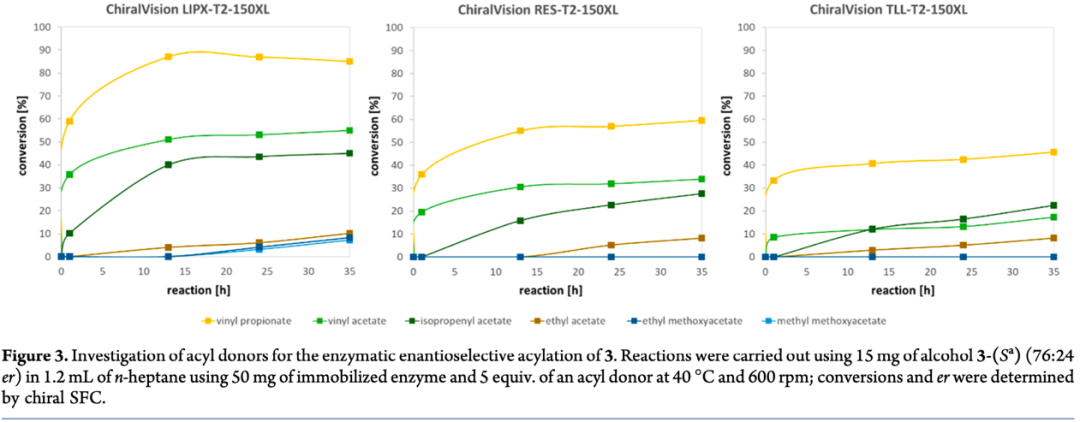
接下來,作者以化合物3為底物,將丙酸乙烯酯作為酰基供體,利用ChiralVision LIPX-T2-150XL為生物催化劑,成功的以70%的分離產(chǎn)率和>200:1的er值得到目標(biāo)構(gòu)型產(chǎn)物3-(Sa)。
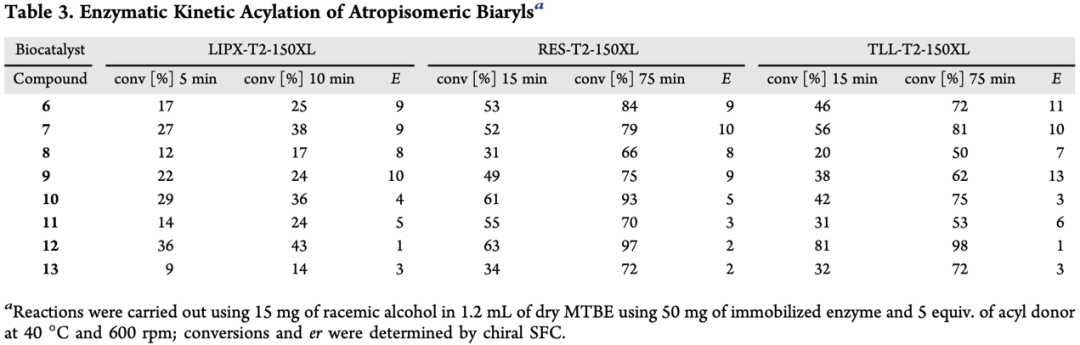
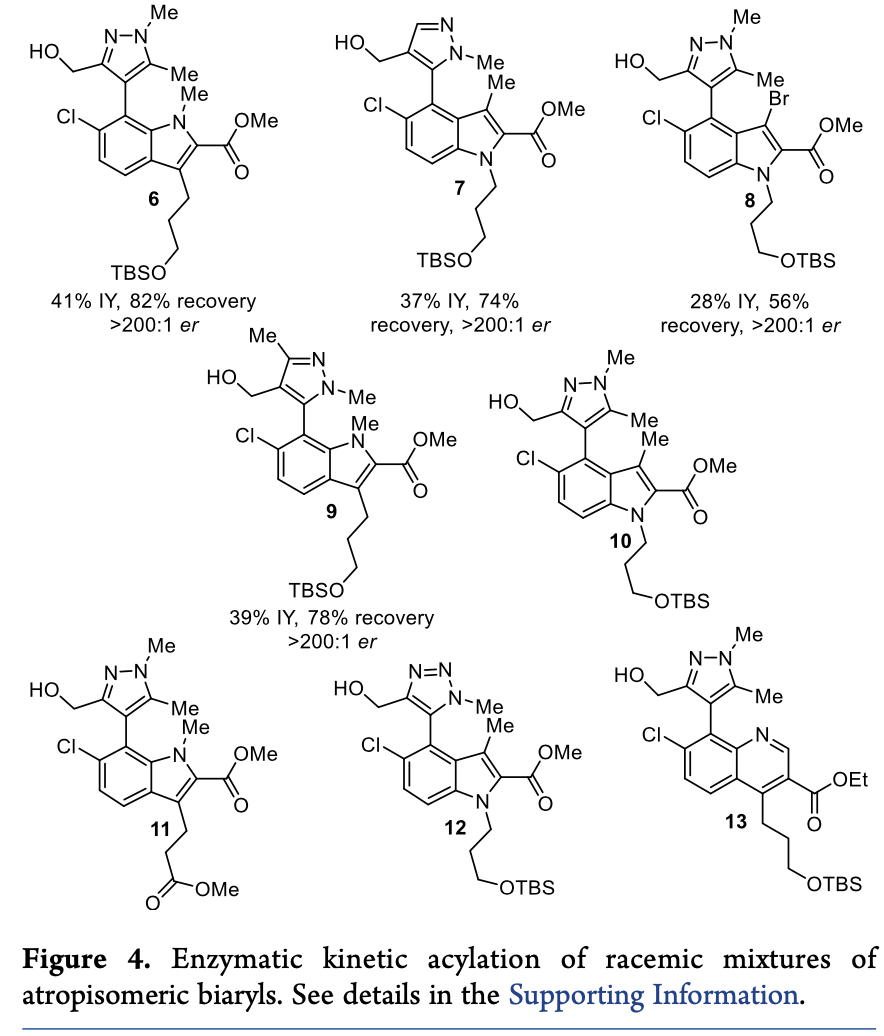
緊接著,為了驗(yàn)證該拆分方法是否具有普適性,作者考察了多種不同結(jié)構(gòu)的聯(lián)芳基阻旋異構(gòu)體底物(Table 3 & Figure 4)。結(jié)果顯示,相比于化合物3,這些化合物不僅乙酰化的轉(zhuǎn)化率顯著降低,且E值均小于10。作者猜想乙二醇取代基對(duì)于反應(yīng)選擇性具有至關(guān)重要的作用。然后,作者利用相同反應(yīng)條件,對(duì)化合物6-9進(jìn)行了拆分,雖然反應(yīng)分離產(chǎn)率較低(28%-41%),但能夠保持優(yōu)異的對(duì)映選擇性(>200:1)。
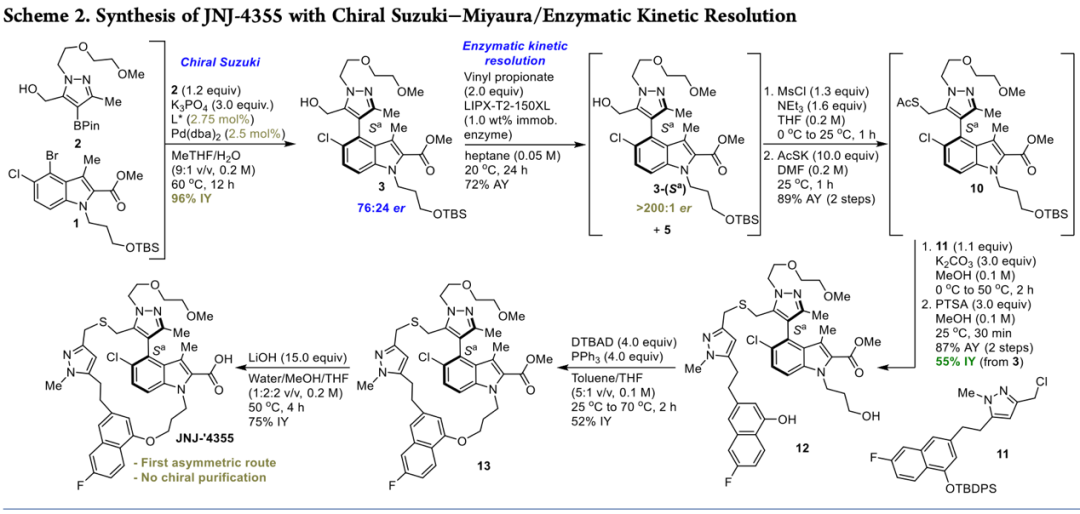
最后,作者利用開發(fā)的方法成功實(shí)現(xiàn)了JNJ-4355的高效合成(Scheme 2)。首先,以N-取代吲哚(1)和吡唑硼酸(2)作為反應(yīng)底物,在標(biāo)準(zhǔn)條件下,以96%的分離產(chǎn)率得到化合物3,再經(jīng)酶動(dòng)力學(xué)拆分以>200:1的對(duì)映選擇性得到目標(biāo)化合物3-(Sa)。然后,化合物3-(Sa)經(jīng)羥基磺酰化和親核取代以兩步89%的產(chǎn)率得到化合物10,再經(jīng)親核取代和PTSA脫保護(hù)基以87%的產(chǎn)率得到關(guān)鍵中間體12。最后,化合物12經(jīng)分子內(nèi)Mitsunobu反應(yīng)得到化合物13,再經(jīng)堿性條件水解得到目標(biāo)產(chǎn)物。
總結(jié):楊森制藥公司的Katharina Neufeld研究員報(bào)道了一類手性Suzuki-Miyaura偶聯(lián)/酶動(dòng)力學(xué)拆分相結(jié)合的合成聯(lián)芳基阻旋異構(gòu)體的方法,并成功實(shí)現(xiàn)了JNJ-4355的高效合成。該反應(yīng)不僅條件溫和、官能團(tuán)兼容性好以及立體選擇性高,在藥物化學(xué)和有機(jī)合成中具有一定實(shí)用性。
[1] LaPlante, S. R.; Fader, L. D.; Fandrick, K. R.; et al. Assessing Atropisomer Axial Chirality in Drug Discovery and Development. J. Med. Chem.2011, 54, 7005-7022.
[2] Bringmann, G.; Price Mortimer, A. J.; Keller, P. A.; et al. Atroposelective Synthesis of Axially Chiral Biaryl Compounds. Angew. Chem., Int. Ed. 2005, 44, 5384-5427.
[3] Beutner, G.; Carrasquillo, R.; Geng, P.; Hsiao, Y.; Huang, E. C.; et al. Adventures in Atropisomerism: Total Synthesis of a Complex Active Pharmaceutical Ingredient with Two Chirality Axes. Org. Lett.2018, 20, 3736-3740.
文獻(xiàn)詳情:
Matthieu Jouffroy* and Katharina Neufeld*.Synthesis of Atropisomeric Biaryls via Chiral Suzuki–Miyaura/Enzymatic Kinetic Resolution.
ACS Catal.2022.https://doi.org/10.1021/acscatal.2c02090














